ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
- АМП – антимикробные препараты
- ВИЧ – вирус иммунодефицита человека
- ВОЗ – всемирная организация здравоохранения
- ГСИ – гнойно-септические инфекции
- Изолят – чистая культура бактерий, выделенная из клинического материала или окружающей среды
- ИСМП – инфекции, связанные с оказанием медицинской помощи
- МПК – минимальная подавляющая концентрация
- НГОБ – неферментирующие грамотрицательные бактерии
- ОМС – обязательное медицинское страхование
- ПСБ – пенициллин-связывающий белок
- УПМ – условно-патогенные микроорганизмы
- ЦВК – центральный венозный катетер
- ЦС – цефалоспорины
- Штамм – единичный изолят или группа изолятов, отличающихся по фенотипическим или генетическим признакам от других изолятов того же вида
НОРМАТИВНАЯ БАЗА, В СООТВЕТСТВИИ С КОТОРОЙ ПРОВЕДЕН ПИЛОТНЫЙ ПРОЕКТ
- СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней»
- Санитарно-эпидемиологические правила и нормативы. СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» (утв. постановлением Главного государственного санитарного врача РФ от 9 декабря 2010 г. N 163)
- МУ 1.3.1884-04 «Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III-IV групп патогенности».
- СП 1.2.1318-03 Санитарно-эпидемиологические правила. 1.2. Эпидемиология. «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I–IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами», утвержденные Постановлением Главного Государственного санитарного врача МЗ РФ № 85 от 30.04.2003 г.
- СП 1.2.036-95. Санитарные правила. 1.2. ЭПИДЕМИОЛОГИЯ. Порядок учета хранения, передачи и транспортировки микроорганизмов I–IV групп патогенности. Госкомсанэпиднадзор России, М., 1996.
- СП 1.2.731-99. Санитарные правила. 1.2. ЭПИДЕМИОЛОГИЯ. Безопасность работы с микроорганизмами III–IV групп патогенности и гельминтами. Минздрав России, М., 1999.
- МУК. 4.2.801-99 4.2 Методы контроля. Биологические и микробиологические факторы. М.: Минздрав России, 2000.
- Руководство по медицинской микробиологии // Ред. Лабинская А.С., Костюкова Н.Н., Иванова С.М.- М.: Бином.- 2010.-1152с.
- Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2015-02 (взамен МУК 4.2.1890-04 определение чувствительности микр организмов к антибактериальным препаратам. 4.2. методы контроля. биологические и микробиологические факторы определения чувствительности микроорганизмов к антибактериальным препаратам).
ВВЕДЕНИЕ
Создание и развитие сети перинатальных центров изменило структуру родовспоможения в России. Концентрация в этих учреждениях наиболее тяжелого контингента женщин и новорожденных, требующих более длительного пребывания в стационаре, необходимость антибактериальной терапии и профилактики, частых инвазивных процедур, является значительным фактором риска по высокому уровню заболеваемости и смертности от инфекций, связанных с оказанием медицинской помощи (ИСМП). Низкий уровень заболеваемости ИСМП в РФ по сравнению с другими развитыми странами указывают на дефекты в системе учета и регистрации ИСМП в нашей стране. Это не позволяет в полной мере оценить этиологическую структуру и резистентность к антимикробным препаратам основных возбудителей ИСМП в родовспоможении, что в свою очередь не позволяет своевременно и полноценно проводить противоэпидемические мероприятия и обеспечивать качественное своевременное лечение.
ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России (далее – Центр мониторинга) в 2016–2017 годах совместно с лечебно-профилактическими учреждениями родовспоможения шести регионов РФ реализовал пилотный проект по изучению распределения и интенсивности циркуляции штаммов возбудителей (в т.ч. резистентных к антибактериальным препаратам) оппортунистических инфекционных заболеваний среди беременных, родильниц и новорожденных (далее – Пилотный проект). Для его реализации организован сбор штаммов микроорганизмов, выделенных у беременных, родильниц и новорожденных в период их пребывания в родовспомогательных учреждениях указанных регионов России.
1. ЦЕЛИ И ЗАДАЧИ ПРОЕКТА
ЦЕЛЬ ПИЛОТНОГО ПРОЕКТА: разработать системы взаимодействия специализированных медицинских учреждений родовспоможения для создания программно-целевого подхода к ранней профилактике, диагностике и лечению оппортунистических инфекций в акушерстве и неонатологии с учетом региональных особенностей.
ЗАДАЧИ ПРОЕКТА:
- создать на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России научно-координационный Центр мониторинга и контроля оппортунистических инфекций в акушерстве и неонатологии;
- определить список учреждений и лабораторий, участвующих в пилотном проекте (далее – Территориальные центры);
- разработать нормативную документацию для реализации Пилотного проекта
- организовать сбор клинически значимых изолятов УПМ, выделенных из клинического материала беременных, рожениц, родильниц и новорожденных детей;
- создать пилотную коллекцию репрезентативных штаммов возбудителей оппортунистических инфекций у женщин и новорожденных и охарактеризовать ее с помощью бактериологических и молекулярно-генетических методов;
- на основании полученных результатов дать рекомендации по внедрению системы мониторинга оппортунистических инфекций в родовспоможении в современных условиях, а также разработать нормативную и методическую базу для включения в основной проект «Изучение распределения и интенсивности циркуляции штаммов возбудителей (в т.ч. резистентных) инфекционных заболеваний среди беременных, родильниц и новорожденных в регионах Российской Федерации» всех субъектов РФ.
2. СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ МОНИТОРИНГА ОППОРТУНИСТИЧЕСКИХ ИНФЕКЦИЙ И ИСМП В АКУШЕРСТВЕ И НЕОНАТОЛОГИИ
Инфекции на протяжении многих тысячелетий оставались основной причиной смертности как среди взрослого, так и среди детского населения. С началом эры антибиотиков, активным развитием фарминдустрии и клинической микробиологии произошли значительные изменения как в этиологии инфекций со смещением от приоритетной роли абсолютных патогенов к условно-патогенным микроорганизмам (УПМ), так и в структуре населения, подверженного инфицированию, за счет увеличения доли иммунокомпрометированных лиц.
Особое место по наносимому ущербу среди ИСМП занимают ГСИ (сепсис, пневмония, остеомиелит, инфекции области операции) и гемотрансмиссивные инфекции (вирусные гепатиты, ВИЧ). ИСМП не только снижают качество оказания медицинской помощи и уровень здоровья населения, но и ведут к значительному экономическому ущербу как на уровне отдельных медицинских учреждений, так и на уровне субъектов РФ и всего государства. Прямой экономический ущерб для лечебного учреждения при возникновении ИСМП связан со значительным удлинением сроков пребывания пациента в стационаре, потребностью в назначении дорогостоящих лекарственных препаратов, использовании высокотехнологичного медицинского оборудования и расходных материалов для их диагностики и лечения. Фонды ОМС предусматривают отказ в оплате медицинской помощи (уменьшение оплаты) согласно ежегодно обновляемым перечням. Согласно этим перечням ИСМП могут быть отнесены к пункту «ненадлежащее выполнение необходимых пациенту диагностических или лечебных мероприятий, оперативных вмешательств, приведшее к: удлинению сроков лечения; ухудшению состояния здоровья; инвалидизации; летальному исходу».
Мониторинг антибиотикорезистентности УПМ в родовспоможении затруднен также вследствие отсутствия нормативной базы по учету используемых антимикробных препаратов. Необходимость проведения антибиотикопрофилактики ИСМП в стационаре нормативно закреплена в СанПин 2.1.3.2630-10, где в п.3.37-3.44 обозначены общие принципы антибиотикопрофилактики. Однако учет уровня потребления антимикробных препаратов нормативно не закреплен ни в одном документе. Имеются рекомендации ВОЗ по методологии учета потребления лекарственных препаратов – так называемый метод «Defined Daily Dose» (DDD). Этот метод широко применяется в клинической фармакологии, и подразумевает учет DDD. DDD – это средняя суточная доза лекарственного средства, используемого по его основному показанию у взрослых [12]. При этом метод DDD не предназначен для учета антимикробных препаратов, т.к. для лечения одной инфекции нередко используют комбинацию из двух препаратов, а дозы антибиотиков могут варьироваться в зависимости от тяжести заболевания и нозологии [13]. В неонатологии и акушерстве метод DDD не применим также из-за значительных различий в массе тела у детей и особенностей фармакокинетики лекарственных средств в организме ребенка и беременной женщины.
В настоящее время на государственном уровне особое внимание уделяется проблеме полирезистентных к антибиотикам возбудителей ИСМП, что привело в 2017 к старту работ Пилотного проекта по учету ИСМП и изучению антибиотикорезистентности в РФ. Целью проекта является обеспечение эпидемиологической безопасности оказания медицинской помощи населению РФ и снижение социально-экономического ущерба от ИСМП на основе совершенствования технологий и методов профилактики, диагностики и лечения, создания системы риск-менеджмента инфекций, связанных с оказанием медицинской помощи. В процессе реализации данного проекта будут разработаны современные критерии постановки диагноза ИСМП, критерии для последующей эффективной оценки интенсивных показателей заболеваемости ИСМП, определена структура основных возбудителей ИСМП и охарактеризована их чувствительность к антибиотикам, дезинфицирующим средствам и антисептикам, оценена структура потребления и адекватность назначения антибиотиков, использования дезинфицирующих средств и антисептиков в медицинских организациях, внедрена система фармако-микробиологического мониторинга.
3. ПОРЯДОК СБОРА, ВЫДЕЛЕНИЯ, ХРАНЕНИЯ И ТРАНСПОРТИРОВКИ ШТАММОВ МИКРООРГАНИЗМОВ, ВЫДЕЛЕННЫХ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛА ЖЕНЩИН И НОВОРОЖДЕННЫХ
Сбор биологического материала от женщин и новорожденных и выделение штаммов УПМ осуществлялись непосредственно в родовспомогательном учреждении, участвующем в Пилотном проекте. Территориальные лаборатории микробиологии находились на территории родовспомогательных учреждений, участвовавших в Пилотном проекте. Центр мониторинга и контроля оппортунистических инфекций в акушерстве и неонатологии располагался на базе Центра.
Критерии отбора результатов микробиологических и молекулярно-генетических исследований
Для проекта были отобраны штаммы УПМ, выделенные из биологического материала, квалифицированного как «материал из предполагаемого очага инфекции», полученного от женщин и новорожденных, находящихся в родовспомогательном учреждении. Перечень биологических материалов, взятых на исследование у пациентов с разным клиническим статусом, представлен в таблицах 1–3.

Для исследования отбирали штаммы микроорганизмов, выделенные из биологического материала вышеуказанного контингента пациентов. Для транспортировки биологического материала в лабораторию микробиологии территориального центра использовали стерильную коммерческую посуду для микробиологического исследования (табл. 4):

После взятия биологического материала врач-акушер-гинеколог или неонатолог заполняли данные о пациенте в паспорте штамма (приложение 2) – первая страница паспорта, за исключением пункта «единый код штамма», который присваивала лаборатория микробиологии Центра мониторинга. Заполненный паспорт с данными пациента и биологический материал от этого пациента направляли в территориальную лабораторию микробиологии.
Весь жидкий биологический материал транспортировали в лабораторию микробиологии на исследование незамедлительно, допускалось хранение крови во флаконах для гемокультивирования и биологический материала с кожи и слизистых оболочек в течение 12 часов при комнатной температуре.
В территориальной лаборатории микробиологии данные о пациенте заносили в журнал регистрации анализов (присваивали лабораторный номер и заносили этот номер в паспорт штамма) – заполняли колонки 14 (табл. 5).
В территориальной лаборатории микробиологии биологический материал засевали на питательные среды и инкубировали 24–48 часов в термостате при 37°С. Кровь во флаконах для гемокультур инкубировали в автоматическом бактериологическом анализаторе для гемокультур или в термостате с последующим высевом на плотные питательные среды. В случае выделения из биологического материала микроорганизмов проводили их идентификацию при помощи методик, используемыми в лаборатории. В случае выделения микроорганизмов из перечня: Escherichia coli, Klebsiella spp., Enterobacter spp., Pseudomonas aeruginosa, Acinetobacter spp., Streptococcus agalactiae, Enterococcus spp., Staphylococcus aureus штамм тестировали на чувствительность к антибиотикам при помощи методик, используемых в лаборатории, заполняли паспорт штамма до конца второй страницы. Также заполняли столбец 5 в журнале регистрации анализов (табл. 5).
Хранение и транспортировку биологического материала осуществляли в соответствии с инструкцией по транспортировке и хранению биологического материала (приложение 3). Дату отправки штамма регистрировали в журнале регистрации анализов (колонка 6 – табл. 1).
В лаборатории микробиологии Центра мониторинга каждому штамму присваивали идентификационный номер в соответствии с инструкцией (приложение 4).
4. МАТЕРИАЛЫ И МЕТОДЫ
Все штаммы из коллекции микроорганизмов были повторно идентифицированы (на времяпролетном масс-спектрометре AutoflexIII (BrukerDaltonics, Германия), проведено фенотипическое тестирование на чувствительность к антибиотикам (на автоматическом бактериологическом анализаторе Vitek 2 Compact (bioMerieux, США).
Фенотипическую оценку чувствительности к антибиотикам проводили по следующим группам антимикробных препаратов:
- Энтеробактерии: ампициллин, амоксициллин/клавулановая кислота (ампициллин/сульбактам), цефтазидим, цефтриаксон, цефепим, имипенем (меропенем), норфлоксацин (ципрофлоксацин, левофлоксацин), гентамицин, амикацин.
- Стафилококки: бензилпенициллин, цефокситин (оксациллин), ванкомицин, линезолид, эритромицин, кларитромицин, гентамицин, ципрофлоксацин (левофлоксацин).
- Неферментирующие грамотрицательные бактерии: гентамицин, амикацин, цефтазидим, цефепим, имипенем (меропенем), ципрофлоксацин (левофлоксацин).
- Энтерококки: ампициллин, ванкомицин, линезолид, гентамицин, ципрофлоксацин (левофлоксацин).
Все штаммы коллекции микроорганизмов были проверены на наличие/отсутствие молекулярно-генетических детерминант резистентности к антимикробным препаратам с помощью тест-системы, основанной на проведении ПЦР-анализа в режиме реального времени (патент № 2629322RU, ФГБУ «НЦАГиП им. В.И.Кулакова» Минздрава России). Тест-система включает в себя наиболее информативные с точки зрения предикции устойчивости маркерные локусы ДНК и способна выявлять следующие гены и группы генов: blaTEM, blaSHV, blaCTX-M, blaOXA-40-подобные гены, blaOXA-48-подобные гены, blaOXA-51-подобные гены, blaNDM, blaVIM, blaKPC, blaGES, blaIMP, vanA/B, и mecA. Дополнительно отдельные штаммы проходили проверку на наличие / отсутствие генов резистентности - vanA, vanB, mecA, blaOXA-48, blaNDM, blaVIM, blaKPC, blaIMP на анализаторе экспертного класса методом ПЦР в режиме реального времени GeneXpert (Cepheid, США).
Краткая характеристика детектируемых генов:
- blaTEM. Группа генов, кодирующих бета-лактамазы грамотрицательных бактерий. Ферменты TEM-1 и TEM-2 наиболее эффективно гидролизуют различные пенициллины и значительно менее активны по отношению к цефалоспоринам. Другие разновидности бета-лактамаз, относящиеся к группе TEM, наряду с пенициллинами, способны активно расщеплять и цефалоспорины I-IV поколений. При этом штаммы обладают фенотипом «бета-лактамазы расширенного спектра» (БЛРС). Часть ферментов этой группы активно подавляется подавляется ингибиторами бета-лактамаз. Выявление в геномах грамотрицательных бактерий генов из группы blaTEM является маркером резистентности к пенициллинам и/или цефалоспоринам.
- blaSHV. Группа генов, кодирующих бета-лактамазы грамотрицательных бактерий. По особенностям проявления резистентности ферменты этой группы бета-лактамаз сходны с ферментами группы blaTEM. Часть ферментов, относящихся к группе SHV, в том числе и SHV-1 способна расщеплять пенициллины, а ряд других разновидностей бета-лактамаз из группы SHV – и цефалоспорины I-IV поколений (фенотип БЛРС). Большая часть ферментов этой группы эффективно подавляется ингибиторами бета-лактамаз. Выявление в геномах грамотрицательных бактерий генов из группы blaSHV является маркером резистентности к пенициллинам и/или цефалоспоринам.
- blaCTX-M. Группа генов, кодирующих бета-лактамазы с плазмидной локализацией. Штаммы с генами из группы blaCTX-M также проявляют фенотип БЛРС. Однако ферменты отличаются высокой скоростью гидролиза цефотаксима и низкой активностью по отношению к цефтазидиму. Выявление в геномах грамотрицательных бактерий генов из группы blaCTX-M является маркером резистентности к пенициллинам и цефотаксиму.
- blaOXA-48-подобные гены (blaOXA-48-like). Группа генов, кодирующих бета-лактамазы у грамотрицательных бактерий. Гены бета-лактамаз, относящихся к группе OXA, в ряде случаев имеют низкий уровень гомологии нуклеотидной последовательности, поэтому бета-лактамазы OXA были выделены в отдельную группу скорее по фенотипическим, чем по генотипическим причинам. Часть OXA-ферментов обладает пенициллиназной активностью, часть – способна расщеплять также и цефалоспорины (фенотип штаммов – БЛРС). Бета-лактамазы, гомологичные ферменту OXA-48, нередко встречаются в грамотрицательных бактериях. Они не обладают способностью расщеплять цефалоспорины, но, как правило, обладают карбапенемазной активностью, то есть способны эффективно расщеплять карбапенемы. Выявление в геномах грамотрицательных бактерий генов из подгруппы blaOXA-48 является маркером резистентности к пенициллинам и карбапенемам.
- blaOXA-40-подобные гены (blaOXA-40-like). Аналогично описанной выше группе blaOXA-48-подобных генов, гены, относящиеся к группе blaOXA-40, кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-40 является маркером резистентности к пенициллинам и карбапенемам.
- blaOXA-51-подобные гены (blaOXA-51-like). Гены, относящиеся к группе blaOXA-51, также кодируют карбапенемазы, но не обладают способностью расщеплять цефалоспорины. Выявление в геномах бактерий генов из подгруппы blaOXA-51 является маркером резистентности к пенициллинам и карбапенемам.
- blaNDM. Ген blaNDM-1 кодирует металло-бета-лактамазу, которая проявляет карбапенемазную активность. Ген имеет плазмидную локализацию и способен к быстрому переносу между бактериями. Выявление в геномах грамотрицательных бактерий гена blaNDM-1 является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
- blaVIM. Кодирует металло-бета-лактамазу с карбапенемазной активностью. Выявление в геномах грамотрицательных бактерий гена blaVIM является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
- blaKPC. Кодирует сериновую бета-лактамазу c карбапенемазной активностью. Выявление в геномах грамотрицательных бактерий гена blaKPC является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
- blaGES. Кодирует бета-лактамазу, обладающую способностью расщеплять пенициллины и цефалоспорины. Чаще всего обнаруживается у Pseudomonas aeruginosa. Выявление в геномах грамотрицательных бактерий генов из группы blaGES является маркером резистентности к пенициллинам и/или цефалоспоринам.
- blaIMP. Группа генов, кодирующих металло-бета-лактамазы с карбапенемазной активностью. Гены имеют плазмидную локализацию, чаще всего встречаются у представителей семейства Enterobacteriaceae и у бактерий, относящихся к родам Pseudomonas и Acinetobacter. Выявление в геномах грамотрицательных бактерий генов из группы blaIMP является маркером резистентности к пенициллинам, цефалоспоринам и карбапенемам.
- vanA и vanB. Опероны бактерий, относящихся к роду Enterococcus, состоящие, как минимум, из семи генов и обуславливающие резистентность бактерий к гликопептидным антибиотикам. Опероны vanA и vanB имеют сходную структуру, но степень гомологии генов, кодирующих регуляторные белки, у них довольно низкая и составляет всего 25–35%. Продукты двух генов, входящих в состав оперонов – vanS и vanR – кодируют систему регуляции экспрессии резистентности, продукты генов vanA, vanH и vanX – участвуют в процессе модификации концевого дипептида D-Ala-D-Ala на D-Ala-D-Lac, к которому аффинность гликопептидов резко снижена. Продукты экспрессии остальных генов, входящих в состав оперонов, не являются обязательными для приобретения устойчивости к гликопептидам. Гликопептидные антибиотики (ванкомицин и тейкопланин) широко используются при лечении энтерококковых инфекций, вызываемых штаммами микроорганизмов, устойчивых к бета-лактамным антибиотикам. Установление наличия резистентности к гликопептидным антибиотикам предполагает замену антибиотика для конкретного пациента. Выявление в геномах энтерококков оперонов vanA и/или vanB является маркером резистентности соответствующих штаммов бактерий к гликопептидам.
- mecA. Ген, кодирующий бета-лактамазу у бактерий рода Staphylococcus. Среди всех антибактериальных препаратов бета-лактамы характеризуются наибольшим уровнем активности в отношении стафилококков и на настоящее время составляют основу терапии инфекций, вызванных стафилококками. Ген mecA, входящий в состав мобильного генетического элемента «стафилококковая хромосомная кассета mec», кодирует дополнительный пенициллинсвязывающий белок ПСБ-2а, который обладает пониженной афинностью к бета-лактамным антибиотикам. В результате у стафилококков появляется устойчивость ко всему классу бета-лактамных антибиотиков (MRSA), маркером наличия которой и является ген mecA.
Тест-система является достаточно универсальным инструментом для проведения молекулярно-генетического анализа штаммов микроорганизмов, обладает широким охватом, что позволяет в рамках одного комплексного анализа тестировать штаммы микроорганизмов, относящихся к разным видам. Однако в ходе анализа те генетические детерминанты резистентности микроорганизмов к антимикробным препаратам, которые не встречаются в штаммах того или иного вида мы во внимание не принимались. В ряде случаев, при выделении бактерий вида Enterobacter cloacae, проводилась детекция видоспецифичного генов гена blaAZECL (группа AmpC), специфичных для вида Enterobacter cloacae.
Анализ полученных данных выполнен для каждого вида бактерий, с целью исключения горизонтального переноса генов от штаммов одного вида штаммам другого вида. Такое представление результатов наиболее информативно с точки зрения клинической микробиологии. Это позволяет проследить динамику распространенности генов устойчивости к антимикробным препаратам внутри одного вида и является полезным при выборе оптимальной антибиотикотерапии для отдельно взятых пациентов.
5. РЕЗУЛЬТАТЫ
Внутренним приказом по ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России был организован научно-координационный Центр мониторинга и контроля оппортунистических инфекций в акушерстве и неонатологии на базе структурного подразделения Центра – отдела микробиологии, клинической фармакологии и эпидемиологии, включающего три подразделения: лабораторию микробиологии, отделение клинической фармакологии антимикробных и иммунобиологических препаратов и отделение эпидемиологии. Руководитель отдела – д.м.н., доцент кафедры микробиологии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России Припутневич Татьяна Валерьевна.
В соответствии с письмом Минздрава России от 05.08.2016 г. №27-5/10/2-4841 «Об исследовании антимикробной резистентности штаммов возбудителей инфекционных болезней у беременных, родильниц, рожениц и новорожденных», был организован сбор сведений о медицинских учреждениях регионов РФ, оказывающих медицинские услуги по профилю «акушерство и гинекология», «неонатология» для отбора участников проекта Министерства здравоохранения. Проведен скрининг родовспомогательных учреждений РФ на наличие в составе учреждения лабораторий микробиологии и специалистов – эпидемиологов и клинических фармакологов путем рассылки анкеты (табл. 6) и анализа полученных результатов анкетирования.
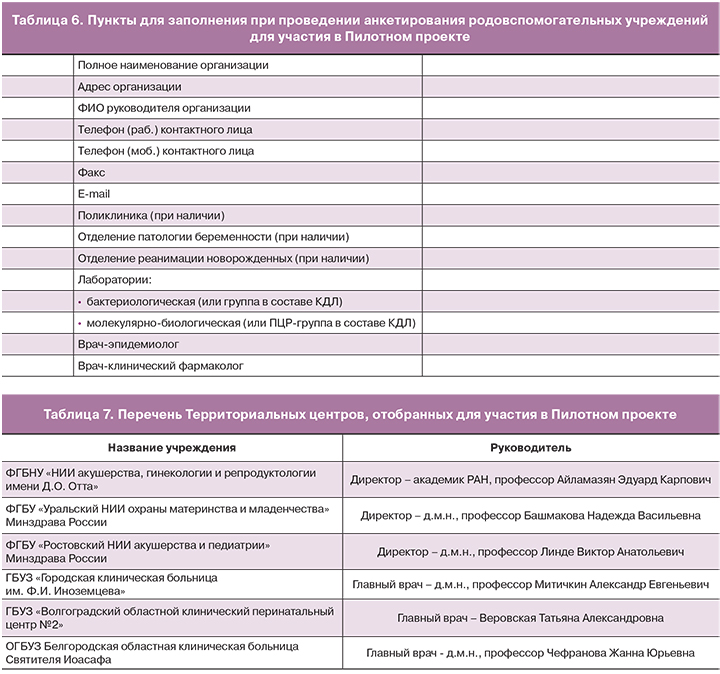
На основании результатов анкетирования для участия в Пилотном проекте отобраны следующие Территориальные центры (табл. 7).
Для реализации Пилотного проекта была разработана нормативная документация, регламентирующая сбор, транспортировку и работу с биологическим материалом на базе Территориальных центров и работу с полученными изолятами УПМ на базе Центра мониторинга. Разработанные материалы были изложены в инструкции по Пилотному проекту и утверждены Директором Центра мониторинга (Приложение 5).
 5.1 Структура коллекции УПМ
5.1 Структура коллекции УПМ
В результате реализации Пилотного проекта создана пилотная коллекция УПМ, состоящая из 500 штаммов УПМ, относящихся к 23 видам. Наибольшую часть коллекции составили представители семейства Enterobacteriaceae – 253 штамма, энтерококки – 101 штамм, стафилококки – 68 штаммов, НГОБ – 44 штамма, стрептококки – 34.
Коллекция включала 5 видов неферментирующих грамотрицательных бактерий (НГОБ) – Acinetobacter baumannii - 9 штаммов, Acinetobacter lwoffii – 2 штамма, Chriseobacterium gleum – 1 штамм, Pseudomonas aeruginosa – 31 штамм, Stenotrophomonas maltophilia – 1 штамм; 7 видов представителей семейства Enterobacteriaceae (Escherichia coli – 92 штамма, Klebsiella pneumoniae – 84 штамма, Klebsiella oxytoca – 12 штаммов, Enterobacter aerogenes – 15 штаммов, Enterobacter cloacae – 46 штаммов, Proteus mirabilis – 3 штамма, Serratia marciscens – 1 штамм); 3 вида Enterococcaceae (E.faecalis – 50 штаммов, E.faecium – 50 штаммов и E.gallinarum – 1 штамм); 6 видов Staphylococcaceae (S.aureus – 39 штаммов, S.epidermidis – 20 штаммов, S.haemolyticus – 6 штаммов, S.hominis – 1 штамм, S.warneri – 1 штамм, S.pasteuri – 1 штамм) и 2 вида Streptococcaceae (S.mitis – 1 штамм и S.agalactiae – 33 штамма). Процентное соотношение штаммов в Пилотной коллекции УПМ представлено на рисунке 1.
 Коллекцию микроорганизмов составили штаммы, собранные в регионах-участниках Пилотного проекта, из них Белгород – 81 штамм, Волгоград – 88 штаммов, Екатеринбург – 24 штамма, Ростов-на-Дону – 14 штаммов, Санкт-Петербург – 58 штаммов и Москва – 235 штаммов. Структура количества штаммов, поступивших из Центров – участников Пилотного проекта, представлена на рисунке 2.
Коллекцию микроорганизмов составили штаммы, собранные в регионах-участниках Пилотного проекта, из них Белгород – 81 штамм, Волгоград – 88 штаммов, Екатеринбург – 24 штамма, Ростов-на-Дону – 14 штаммов, Санкт-Петербург – 58 штаммов и Москва – 235 штаммов. Структура количества штаммов, поступивших из Центров – участников Пилотного проекта, представлена на рисунке 2.
Среди штаммов, составляющих Пилотную коллекцию, 37% выделено из биологического материала женщин, 63% - из биологического материала новорожденных (табл. 8).
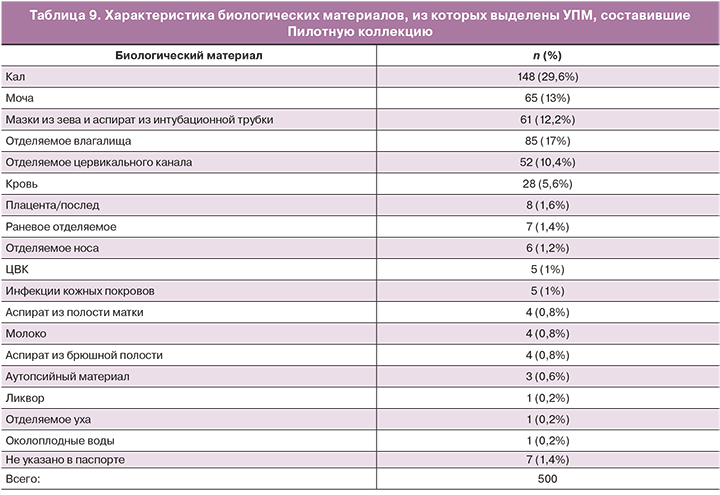
Наиболее представленными (суммарно 82,2%) биологическими материалами были: кал, мазки из зева (ротоглотки) на тампоне и аспираты из интубационных трубок – у новорожденных; отделяемое влагалища, цервикального канала и моча – у женщин. Остальные 17,8% составили кровь (5,6%), раневое отделяемое и мазки с поврежденной кожи, аспираты из полости матки и брюшной полости, центральные венозные катетеры (ЦВК), ликвор и др. (табл. 9).

Видовая принадлежность штаммов, выделенных из различных биологических материалов
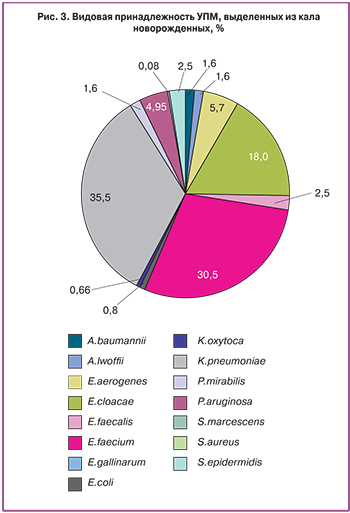 Кал – основной биологический материал, поступивший от новорожденных – пациентов отделений ОРИТ. Данный биологический материал представляет прямую диагностическую ценность только при НЭК, в остальных случаях, как правило, отражает динамику микробной колонизации кишечника новорожденных и выявляет спектр штаммов, циркулирующих в отделении реанимации. Собранная коллекция показала, что у новорожденных из ОРИТ кишечник колонизирован в большинстве случаев представителями ESKAPE патогенов – чаще всего K.pneumoniae (35,5% штаммов, из них продуценты БЛРС – 93%, продуценты карбапенемаз – 74%), E. faecium (30,5% штаммов, из них ванкомицин-резистентные штаммы – 81%), E.cloacae (18%, из них продуценты БЛРС – 77%, продуценты карбапенемаз – 40,9%) и P.aeruginosa (4.95% штаммов, все штаммы устойчивы к антисинегнойным цефалоспоринам и карбапенемам). Представители индигенной микрофлоры кишечника (E.faecalis, E.coli) встречались в 0,8 и 2,5% случаев, соответственно. S.aureus составили 0,08% штаммов, выделенных из кала (рис. 3).
Кал – основной биологический материал, поступивший от новорожденных – пациентов отделений ОРИТ. Данный биологический материал представляет прямую диагностическую ценность только при НЭК, в остальных случаях, как правило, отражает динамику микробной колонизации кишечника новорожденных и выявляет спектр штаммов, циркулирующих в отделении реанимации. Собранная коллекция показала, что у новорожденных из ОРИТ кишечник колонизирован в большинстве случаев представителями ESKAPE патогенов – чаще всего K.pneumoniae (35,5% штаммов, из них продуценты БЛРС – 93%, продуценты карбапенемаз – 74%), E. faecium (30,5% штаммов, из них ванкомицин-резистентные штаммы – 81%), E.cloacae (18%, из них продуценты БЛРС – 77%, продуценты карбапенемаз – 40,9%) и P.aeruginosa (4.95% штаммов, все штаммы устойчивы к антисинегнойным цефалоспоринам и карбапенемам). Представители индигенной микрофлоры кишечника (E.faecalis, E.coli) встречались в 0,8 и 2,5% случаев, соответственно. S.aureus составили 0,08% штаммов, выделенных из кала (рис. 3).
Из зева новорожденных ОРИТ были выделены штаммы P. aeruginosa (26%, все устойчивы к антисинегнойным цефалоспоринам, 81% - устойчивы к карбапенемам), K.pneumoniae (19.6%, из них 91,6% продуценты БЛРС, 58 - карбапенемаз) и E.cloacae (19.6%, из них 91,6% продуценты БЛРС, 33,3% - карбапенемаз), S.aureus (8%, один из них – метициллин-резистентный, mecA+) (рис. 4).
Среди штаммов, выделенных из мочи преобладали штаммы E.coli (33%, из них устойчивы к защищенным пенициллинам 8%, 8% имели промежуточный тип устойчивости; продуценты БЛРС составили 33%; 16,6% были устойчивы к фторхинолонам, устойчивых к карбапенемам штаммов не обнаружено), E.faecalis (29%, все штаммы чувствительны к ампициллину, нитрофурантоину, ванкомицину, фторхинолонам), K.pneumoniae (10%, из них 57% (4/7) – продуценты БЛРС, 28,6% (2/7) - карбапенемаз, 28,6% (2/7) устойчивых к фторхинолонам) (рис. 5).

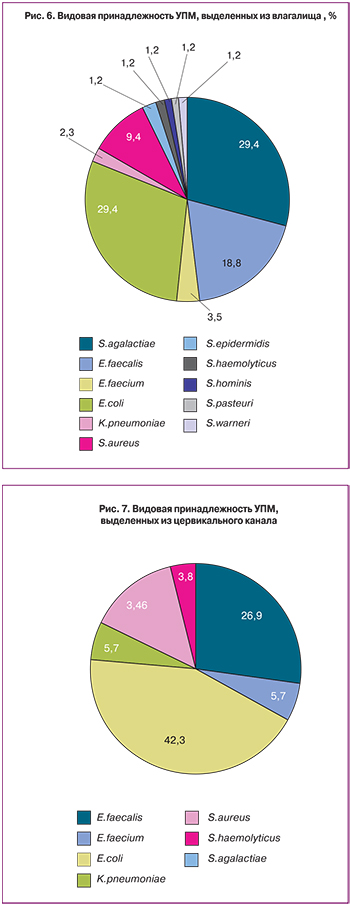 Из влагалища обследованных женщин чаще всего выделяли штаммы E.coli (41%, из них 8% устойчивы к защищенным пенициллинам, 4% имеют промежуточный тип устойчивости; продуценты БЛРС составили 52%, продуцентов карбапенемаз не обнаружено), S.agalactiae, E.faecalis (27%, все штаммы чувствительны к пенициллинам, ванкомицину, 25% устойчивы к фторхинолонам), S.aureus (13%, все штаммы метициллин-чувствительные) (рис. 6).
Из влагалища обследованных женщин чаще всего выделяли штаммы E.coli (41%, из них 8% устойчивы к защищенным пенициллинам, 4% имеют промежуточный тип устойчивости; продуценты БЛРС составили 52%, продуцентов карбапенемаз не обнаружено), S.agalactiae, E.faecalis (27%, все штаммы чувствительны к пенициллинам, ванкомицину, 25% устойчивы к фторхинолонам), S.aureus (13%, все штаммы метициллин-чувствительные) (рис. 6).
В цервикальном канале преобладали штаммы E.coli (43%, из них 9% устойчивы к защищенным пенициллинам; продуценты БЛРС составили 54,5%, продуцентов карбапенемаз не обнаружено), E.faecalis (27%, все штаммы чувствительны к пенициллинам, ванкомицину), S.aureus (14%, все штаммы метициллин-чувствительные) (рисунок 7).
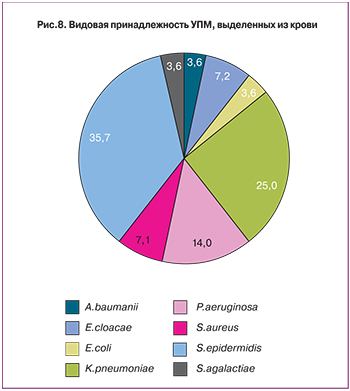
Среди штаммов, выделенных из крови, преобладали S.epidermidis (36%, 80% (8/10) метициллин-резистентные, ген mecА+), K.pneumoniae (25%, из них 6 из 7 – продуценты БЛРС, 3 из 7 – карбапенемаз), P.aeruginosa (14%, все от новорожденных, 3 из 4 устойчивы к антисинегнойным цефалоспоринам и карбапенемам) (рисунок 8).
ЭНТЕРОБАКТЕРИИ
Пилотная коллекция штаммов энтеробактерий включает в себя 253 штамма, из них полученных из Белгорода – 49, Волгограда – 23, Екатеринбурга – 18, Москвы – 127, Ростова-на-Дону – 5, Санкт-Петербурга – 31.
ESCHERIСHIA COLI
Чаще всего штаммы E.coli обладали устойчивостью к пенициллинам – 66,3%, цефалоспоринам III–IV поколения (ЦС III-IV) были устойчивы 51%, устойчивость к гентамицину и защищенным пенициллинам была сопоставима – 20,6% и 21,7% соответственно. К карбапенемам устойчивы оказались 8,7% штаммов.
Коллекцию из Москвы составили 38 штаммов E.coli.
В Москве при фенотипической устойчивости E.coli к ЦС III–IV в большинстве случаев выявляли гены CTX-M (28/37; 75,6%), при этом гены CTX-M ни у одного штамма не обнаруживались одновременно с генами SHV, но обнаруживались одномоментно с генами TEM у 8 штаммов (8/28; 28,6%). Устойчивость к ЦС III-IV на фоне отсутствия CTX-M наблюдалась у двух штаммов и была связана с генами TEM и SHV, в одном из которых содержалось одновременно два гена. Выявлено 5 штаммов E.coli, у которых при фенотипической устойчивости к ЦС III–IV никаких из тестируемых генов резистентности не обнаружено. Среди штаммов E.coli, устойчивых к карбапенемам, у 7 обнаружены гены NDM, из них 3 – в сочетании с OXA-48 и генами БЛРС, 2 – с OXA-51 (генов БЛРС не обнаружено). Таким образом, наиболее распространенными генами резистентности в Московском перинатальном центре среди БЛРС были гены CTX-M, в трети случаев в сочетании с другими типами генов БЛРС, преимущественно TEM-типа. Среди карбапенемаз – NDM, однако практически всегда в сочетании с генами сериновых карбапенемаз типа OXA. Устойчивость к аминогликозидам у штаммов E.coli отмечалась к гентамицину в два раза чаше (36,8%), чем к амикацину (18,4%).
В Волгограде из 17 штаммов E.col 6 (35%) были устойчивы к пенициллинам, 2 (12%) – к защищенным пенициллинам, 3 (17,6%) – к ЦС III–IV, из них у одного штамма не было обнаружено детектируемых генов резистентности, у одного штамма выявлены гены CTX-M+SHV БЛРС+TEM БЛРС, у одного – только CTX-M. Продуцентов карбапенемаз не обнаружено.
Из Санкт-Петербурга поступило 18 штаммов E.coli, из них устойчивы к пенициллинам – 38,8% (7/18), к защищенным пенициллинам и карбапенемам все штаммы были чувствительны, к цефалоспоринам III–IV – 3 (16%), резистентность была обусловлена генами CTX-M (в одном случае ген CTX-M сочетался с геном TEM), к фторхинолонам – 3 (16%), к гентамицину – 1 (5%).
Коллекцию из Белгорода составили 9 штаммов E.coli, все от женщин (моча – 1, плацента – 2, отделяемое цервикального канала – 2, отделяемое влагалища – 4). Почти в половине случаев обнаружена устойчивость к пенициллинам, у одного штамма в сочетании с устойчивостью к защищенным пенициллинам, штаммов, устойчивых к ЦС III–IV и карбапенемам, не обнаружено, генов резистентности из тестируемого набора не обнаружено.
Таким образом, штаммы E.coli, выделенные от женщин, обладали хорошим профилем антибиотикочувствительности, не содержали генов БЛРС и карбапенемаз, в большинстве случаев штаммы были чувствительны к ингибиторам.
Из Екатеринбурга получено 7 штаммов E.coli, из них 57% были устойчивы к ампициллину, 43% устойчивы - к защищенным пенициллинам и 28% (2/7) – к цефалоспоринам III-IV поколения (у обоих штаммов обнаружен ген CTX-M). У двух штаммов обнаружены гены группы TEM, однако фенотипически данный признак у штаммов не обнаружен. Продуцентов карбапенемаз не было.
Из Ростова-на-Дону поступило 2 штамма E.coli, оба устойчивы к пенициллинам, но чувствительны к ингибиторам, оба продуцировали БЛРС, обусловленные геном CTX-M. Таким образом, среди 92 штаммов E.coli Пилотной коллекции наиболее распространена была устойчивость к пенициллинам 65% (60/92) и цефалоспоринам III–IV – 51% (47/92). При этом устойчивость к цефалоспоринам в 79% случаев была ассоциирована с геном CTX-M (37/47), 22% (20/92) штаммов коллекции устойчивы к ингибиторам.
Среди популяции новорожденных полирезистентные штаммы выделяли чаще, чем у женщин (86% vs 53%). В популяции женщин все полирезистентные штаммы были представлены продуцентами БЛРС, в то время как среди новорожденных 41,6% штаммов содержали гены только БЛРС, а 58,4% - гены БЛРС в сочетании с генами карбапенемаз. Наиболее часто встречаемым геном БЛРС были CTX-M гены, гены карбапенемаз обнаружены только у штаммов из Москвы и представлены в большинстве своем генами металло-бета-лактамаз типа NDM и сериновыми карбапенемаз типа OXA 48, 51.
KLEBSIELLA SPP.
Пилотную коллекцию составили 96 штаммов представителей рода Klebsiella, из них K.oxytoca – 12 (12,5%), K.pneumoniae – 84 (87,5%).
Наибольшей устойчивостью штаммы Klebsiella Пилотной коллекции обладали в отношении пенициллинов – 100%, защищенных пенициллинов – 82,3%, цефалоспоринов III–IV – 80,2%, к карбапенемам и фторхинолонам – 50% и 48,9% соответственно. Устойчивость к аминогликозидам не отличалась для гентамицина и амикацина (64,6% и 61,4% соответственно).
В Москве устойчивость штаммов Klebsiella (n=50) к пенициллинам составила 100%, к защищенным пенициллинам – 96%, 90% штаммов были устойчивы к ЦС III–IV, 80% – к карбапенемам. При фенотипической устойчивости Klebsiella к ЦС III–IV гены CTX-M выявляли в 57,7% (26/45), из них у четырех штаммов ген CTX-M обнаружен без других генов, в остальных случаях – в сочетании с SHV и TEM или генами карбапенемаз. 1 штамм содержал только ген SHV БЛРС, а 8 штаммов (16,6%) – ген SHV БЛРС в сочетании с OXA48, OXA 51, NDM.
В Волгограде из 3 штаммов K.pneumolniae 3 были устойчивы к пенициллинам, 2 – к защищенным пенициллинам и ЦС III–IV, по 1 – к фторхинолонам и аминогликозидам.
Из Санкт-Петербурга поступило 9 штаммов Klebsiella, из них 6 – K.pneumoniae, 3 – K.oxytoca. 100% штаммов были устойчивы к пенициллинам, 22% (2/9) - к защищенным пенициллинам, 30% (3/9) – к ЦС III-IV (все содержали CTX-M ген, один – K.oxytoca только CTX-M, у двух штаммов – K.pneumoniae - в комбинации с SHV БЛРС и TEM БЛРС). К карбапенемам (генов карбапенемаз не обнаружено) и фторхинолонам фенотипической устойчивости не выявлено.
В Белгороде штаммы Klebsiella (n=24) представлены видом K.pneumoniae в 100% случаев, 21 из них – от новорожденных (11 из них – из кала и зева, 1- с кожных покровов, 1 – отделяемое глаза, 2 – не указано), 2 – от женщин из цервикального канала и влагалища, 1 – статус пациента не указан, локус – не указан. Устойчивость к пенициллину составила 100%, 17 штаммов (70,8%) устойчивы к защищенным пенициллинам, устойчивые к ЦС III–IV штаммы составляли 79% (19/24), к карбапенемам – 25% (6/24). При этом генов карбапенемаз, включенных в тестируемую панель, не обнаружено. У штаммов, фенотипически устойчивых к ЦС III–IV, методом ПЦР обнаружены гены БЛРС у 94,7% (18/19) штаммов: CTX-M составили 89,5% (17/19), из них 9 – в сочетании с SHV , 8 – в сочетании с TEM . Штаммы с одновременным наличием SHV и ТЕМ не встречались. Следует отметить, что у штаммов K.pneumoniae, которые фенотипически не проявляли устойчивость к ЦС III–IV, у двух обнаружены CTX-M гены, у всех – гены SHV; один из них содержал одновременно гены CTX-M, SHV и TEM.
NB! У одного штамма, фенотипически устойчивого к ЦС III-IV и карбапенемам, выделенного с кожных покровов ребенка, генов резистентности методом ПЦР не обнаружено.
Из Екатеринбурга получено 7 штаммов Klebsiella: 6 штаммов отнесено к виду K.oxytoca, все они были устойчивы к ЦС III–IV и защищенным пенициллинам, у 5 устойчивость обусловлена наличием CTX-M гена, у одного – SHV. Также штаммы K.oxytoca были 100% устойчивы к фторхинолонам и аминогликозидам. Штамм K.pneumoniae фенотипически проявил устойчивость только к амипициллину, генов резистентности из тестируемой панели не содержал.
Из Ростова-на-Дону поступило 3 штамма K.pneumoniae, все устойчивы к пенициллинам, защищенным пенициллинам, ЦС III–IV и аминогликозидам. 2 из трех устойчивы к карбапенемам и фторхинолонам.
Таким образом, среди 96 штаммов Klebsiella spp. Пилотной коллекции резистентность к пенициллинам, защищенным пенициллинам и цефалоспоринам значительно более распространена, нежели среди штаммов E.coli и составила 100%, 75% и 80,2% соответственно). Устойчивость к аминоглиозидам II поколения (гентамицин) сопоставима с таковой к аминогликозидам III поколения и составляет 64,6% и 61,4% соответственно.
ENTEROBACTER SPP.
Пилотную коллекцию составили 61 штамм представителей рода Enterobacter - Enterobacter aerogenes – 15 штаммов, Enterobacter cloacae – 46 штаммов.
Из Москвы Пилотную коллекцию составил 31 штамм E.cloacae, из них, выделенные от женщин – 1 (кровь), остальные – от новорожденных. Штаммы получены из следующих биологических материалов: аутопсийный материал – 1, зев – 1, аспират из трахеи (интубационная трубка) – 10, из кала - 12, кровь – 1, моча – 4, ЦВК – 2. Все штаммы фенотипически были устойчивы к пенициллинам и ингибиторзащищенным пенициллинам. У 26 полирезистентных штаммов обнаружены гены CTX-M, из них в сочетании только с SHV БЛРС – 4, с SHV БЛРС и TEM БЛРС – 2, в сочетании только с TEM БЛРС – 17. Гены карбапенемаз обнаружены у 3 штаммов: 2 OXA 48 и у 1 – OXA 48 в сочетании с NDM
Из Белгорода в состав Пилотной коллекции вошло 9 штаммов E.cloacae, из них из кала и зева новорожденных, 2 – биоматериал не указано в анкете. Фенотипически все штаммы были полирезистентными: устойчивы к ампициллину, защищенным пенициллинам, аминогликозидам, цефалоспоринам III-IV, но чувствительны к карбапенемам. Штаммов с промежуточной чувствительностью к фторхинолонам было 22% (2/9). Все штаммы содержали CTX-M гены в сочетании с TEM БЛРС, генов карбапенемаз не обнаружено.
Из Екатеринбурга в Пилотную коллекцию включено 4 штамма E.cloacae, все из кала новорожденных. Штаммы были устойчивы только к пенициллинам и защищенным пенициллинам и не содержали генов БЛРС и карбапенемаз.
Из Волгограда в коллекцию включен один штамм E.cloacae, выделенный из крови новорожденного. Штамм содержал ген OXA 51 и фенотипически оказался устойчив только к пенициллинам и защищенным пенициллинам, к цефалоспоринам III-IV, карбапенемам, фторхинолонам и аминогликозидам – чувствителен.
Из Санкт-Петербурга в Пилотную коллекцию включен один штамм E.cloacae, выделенный с кожных покровов новорожденного. Штамм был устойчив к пенициллинам, защищенным пенициллинам и цефалоспоринам III-IV, но чувствителен к фторхинолонам, аминогликозидам. Гены БЛРС и карбапенемаз не обнаружены.
Из Ростова-на-Дону штаммов Enterobacter cloacae не поступало.
ENTEROBACTER AEROGENES
Из Москвы в состав Пилотной коллекции вошло 5 штаммов E.aerogenes, все получены от новорожденных – 4 из кала, 1 – из интубационной трубки. Все штаммы отличались полирезистентностью и были устойчивы к пенициллинам, ингибитор-защищенным пенициллинам, цефалоспоринам, карбапенемам, аминогликозидам, но сохраняли чувствительность к фторхинолонам. Все штаммы содержали гены CTX-M и TEM , генов карбапенемаз не обнаружено, несмотря на наличие фенотипической устойчивости к карбапенемам.
Из Белгорода в состав Пилотной коллекции вошло 7 штаммов E.aerogenes, все из кала и зева, 5 – от новорожденных, 2 – от женщин. У всех штаммов обнаружены гены CTX-M, из них в сочетании только с TEM – 3, в сочетании с TEM и SHV – 1. Генов карбапенемаз не обнаружено. Все штаммы были полирезистентными: устойчивы к пенициллинам, защищенным пенициллинам, цефалоспоринам, аминогликозидам, но чувствительны к карбапенемам и фторхинолонам.
Из Санкт-Петербурга поступило 3 штамма E.aerogenes, все из мочи, пациент не указан. Все штаммы были устойчивы к пенициллинам и защищенным пенициллинам и чувствительны к цефалоспоринам III-IV, карбапенемам, фторхинолонам и аминогликозидам.
Из Волгограда, Екатеринбурга и Ростов-на-Дону штаммов E.aerogenes не поступало.
НЕФЕРМЕНТИРУЮЩИЕ ГРАМОТРИЦАТЕЛЬНЫЕ БАКТЕРИИ
Коллекция включает 43 штамма неферментирующих грамотрицательных бактерий, из них из Белгорода – 11, Волгограда – 1, Москвы – 29, Ростова-на-Дону – 2. Один штамм выделен у женщин, 40 – у новорожденных, для двух штаммов паспорта заполнены некачественно, поэтому источник штаммов определить невозможно. Неферментирующие грамотрицательные бактерии относятся к трем группам: Pseudomonas aeruginosa, Acinetobacter baumannii complex и Stenotrophomonas maltophilia. Суммарно коллекцию составил 31 штамм Pseudomonas aeruginosa.
Из Москвы поступило 24 штамма Pseudomonas aeruginosa, выделенных у новорожденных. Из них 23 штамма были устойчивы как к цефалоспопринам III–IV поколения, так и к карбапенемам (96%), 22 штамма – устойчивы к амикацину (92%), 20 штаммов из 22 были устойчивы к ципрофлоксацину (91%), а 19 из 20 – к гентамицину (95%). По-видимому, основным генетическим фактором, приводящим к устойчивости к цефалоспоринам и карбапенемам, является ген blaVIM, кодирующий карбапенемазы: эта группа генов обнаружена у 22 штаммов из 23, устойчивых к карбапенемам. Причем, единственный штамм, чувствительный к карбапенемам и цефалоспоринам, этого гена лишен. В ряде штаммов были выявлены и гены цефалоспориназ, эффект которых на развитие устойчивости «теряется» при наличии одновременно гена blaVIM: два штамма содержали одновременно гены blaTEM и blaCTX-M вместе с геном blaVIM.
Из Белгорода в состав Пилотной коллекции вошло 7 штаммов P.aeruginosa, выделенных из кала и зева новорожденных. Все штаммы устойчивы к антисинегнойным ЦС III поколения (цефтазидим), к антисинегнойным ЦС IV поколения – 3, 1 – с промежуточной чувствительностью. К фторхинолонам 4 штаммы были чувствительны, 1 – с промежуточной чувствительностью. Устойчивых к карбапенемам штаммов – 3, гены карбапенемаз обнаружены у 3-х и относились к генам металло-бета-лактамаз типа VIM. Других генов резистентности не обнаружено.
Единственный штамм Pseudomonas aeruginosa, поступивший из Волгограда, устойчив к амикацину и чувствителен к цефалоспопринам III–IV поколения, карбапенемам и ципрофлоксацину. Не выявлено ни гена blaVIM, ни цефалоспориназных генов. Штамм выделен у новорожденного.
Единственный штамм Pseudomonas aeruginosa, поступивший из Ростова-на-Дону, выделен у новорожденного и чувствителен к цефалоспопринам III–IV поколения, гентамицину, амикацину, карбапенемам и ципрофлоксацину. Не выявлено ни гена blaVIM, ни цефалоспориназных генов.
ACINETOBACTER BAUMANNII COMPLEX
Комплекс видов Acinetobacter baumannii complex включает ряд близких, часто трудноопределяемых видов. В коллекцию вошло 11 штаммов двух видов: A. baumannii (9 штаммов) и A. lwoffii (2 штамма).
Из Москвы поступило 4 штамма Acinetobacter baumanii complex, выделенных у новорожденных. У всех штаммов выявлена устойчивость к амикацину, у трех штаммов из трех – к ципрофлоксацину, у двух штаммов из двух – к гентамицину. Три штамма устойчивы к цефалоспопринам III–IV поколения и карбапенемам. У устойчивых к карбапенемам штаммов выявлены гены карбапенемаз blaOXA-40 (2 штамма) и blaOXA-51 (три штамма). У единственного чувствительного к карбаменемам штамма гены резистентности не выявлены.
Из Белгорода: 4 штамма – A. baumannii и 2 – A. lwoffii. 5 штаммов выделены из кала и зева новорожденных, 1 (A.baumannii) – из последа. Все штаммы были устойчивы к пенициллинам, защищенным пенициллинам. 4 штамма (3 – от новорожденных, 1 – от женщины) были полирезистентыми: устойчивы к цефалоспоринам III–IV поколения, карбапенемам, амикацину и ципрофлоксацину. У всех четырех полирезистентных штаммов выявлены гены карбапенемаз blaOXA-40 и blaOXA-51. Видимо, эти гены являются основными генетическими детерминантами устойчивости штаммов Acinetobacter baumanii к карбапенемам.
Из Ростова-на-Дону поступил 1 штамм, выделенный у новорожденного и устойчивый ко всем группам антибиотиков, входящих в исследование. ПЦР-исследование выявило наличие генов карбапенемаз blaOXA-40 и blaOXA-51.
Таким образом, основной причиной появления устойчивости штаммов к цефалоспопринам III–IV поколения, так и к карбапенемам является наличие генов карбапенемаз из групп blaOXA-40 и blaOXA-51.
Единственный штамм еще одного представителя НГОБ Stenotrophomonas maltophilia был выделен у новорожденного Москвы. Штамм устойчив к ко-тримоксазолу. Гены устойчивости к антибиотикам не обнаружены.
ЭНТЕРОКОККИ
Пилотную коллекцию составили 101 штамм энтерококков – 50 штаммов Enterococcus faecalis, 50 штаммов Enterococcus faecium и 1 штамм Enterococcus gallinarum, из них из Белгорода – 20, Волгограда – 30, Екатеринбурга – 5, Москвы – 33, Ростова-на-Дону – 1, Санкт-Петербурга – 12.
Из Москвы и Ростова-на-Дону штаммы Enterococcus faecalis не поступали.
Из Волгограда поступило 25 штаммов Enterococcus faecalis. Один штамм выделен у новорожденного, остальные 24 – у женщин. Штаммов, устойчивых к пенициллину, ванкомицину, линезолиду и нитрофурантоинам, выявлено не было. Семь штаммов были устойчивы к ко-тримоксазолу (28%), 4 штамма – к ципрофлоксацину (16%), 2 штамма – к гентамицину (8%).
Из Санкт-Петербурга получено 12 штаммов, из них устойчивых к пенициллину, ванкомицину и нитрофурантоинам не выявлено. Все 12 штаммов были устойчивы к ко-тримоксазолу, у всех пяти штаммов, для которых проводилось определение чувствительности к линкозамидам, выявлена устойчивость к антибиотикам из этой группы.
В Белгороде у 8 пациентов (5 женщин, 3 новорожденных) выделены штаммы Enterococcus faecalis. Четыре штамма из восьми (50%) были устойчивы к ципрофлоксацину, три штамма (11%) устойчивы к пенициллинам, 1 штамм устойчив к ванкомицину, 1 штамм из трех – к линезолиду, 2 из пяти – к гентамицину и по 2 из 5 штаммов – к гентамицину и линкозамидам.
У пяти штаммов, полученных из Екатеринбурга, не выявлены штаммы, устойчивые к пенициллинам, ванкомицину и ципрофлоксацину.
Гены резистентности (vanA/vanB), входящие в состав тестируемой панели, выявлены не были.
Суммарно поступило 50 штаммов Enterococcus faecium.
Из Москвы поступило 32 штамма Enterococcus faecium. Все штаммы выделены у новорожденных и обладали устойчивостью к ванкомицину, у каждого штамма выявлены гены vanA/vanB, являющиеся генетическими детерминантами устойчивости энтерококков к ванкомицину. У 21 штамма (65%) обнаружена устойчивость к ципрофлоксацину, у одного штамма – к линезолиду (3%). У всех штаммов выявлена устойчивость к пенициллинам (100%) и к гентамицину (100%).
Из Белгорода получено 12 штаммов Enterococcus faecium. Восемь штаммов выделено у новорожденных (7 - из кала, 1 – из уха), 3 – у женщин (плацента, полость матки, цервикальный канал), для одного штамма паспорт заполнен некачественно, поэтому источник штамма определить невозможно. Штаммы, устойчивые к ванкомицину, не выявлены. Не обнаружены и гены устойчивости к ванкомицину vanA/vanB. 10 штаммов устойчивы к пенициллинам (83%), все штаммы устойчивы к нитрофуранам, гентамицину, 7 устойчивы (58%) к ципрофлоксацину, 1 – с промежуточной чувствительностью. Все штамы, кроме одного, устойчивы к триметоприму/сульфометоксазолу.
Из пяти штаммов, поступивших из Волгограда, у 1 была выявлена устойчивость к ванкомицину, при этом гены устойчивости к ванкомицину vanA/vanB. Видимо, у этого штамма устойчивость к ванкомицину обусловлена другими причинами, что требует дальнейшего изучения. Один штамм был устойчив к пенициллинам, 3 штамма – к ципрофлоксацину, по 2 штамма из трех - устойчивы к ко-тримоксазолу и гентамицину, 1 штамм из трех обладал устойчивостью к линкозамидам. Все штаммы выделены у женщин.
У единственного штамма из Ростова-на-Дону, выделенного у новорожденного, выявлена устойчивость к ванкомицину, подтвержденного ПЦР-детекцией генов устойчивости к ванкомицину vanA/vanB. Кроме того, штамм был устойчив к пенициллинам, гентамицину, линкозамидам и ципрофлоксацину.
Из Екатеринбурга и Санкт-Петербурга штаммы Enterococcus faecium не поступали.
Единственный штамм Enterococcus gallinarum был выделен у новорожденного в Москве и оказался устойчив к пенициллину, ванкомицину, гентамицину и чувствителен к линезолиду. Гены vanA/vanB в геноме этого штамма не обнаружены.
СТАФИЛОКОККИ
Стафилококки были разделены на две группы: Staphylococcus aureus и виды, входящие в группу коагулазонегативных стафилококков.
Пилотную коллекцию составили 39 штаммов Staphylococcus aureus, из которых 20 -выделены у женщин, 11 штаммов – у новорожденных, для 8 штаммов паспорт заполнен некачественно, поэтому источник выделения штамма определить невозможно.
Из Москвы поступило 12 штаммов Staphylococcus aureus, из них 7 штаммов выделено у новорожденных и 5 штаммов у женщин. Из 12 штаммов у 11 выявлена устойчивость к пенициллинам (58%), у 2 – к цефокситиму (фенотип MRSA) (16%), по одному штамму с устойчивостью к эритромицину, линкозамидам и гентамицину (8%). У обоих штаммов с фенотипом MRSA обнаружен ген mecA, являющийся генетической детерминантой устойчивости ко всему классу бета-лактамных антибиотиков.
Из Волгограда поступило 17 штаммов Staphylococcus aureus, из них 14 штаммов выделено у женщин, 2 штамма у новорожденных, для одного штамма паспорт заполнен некачественно, поэтому источник штамма определить невозможно. Из 17 штаммов у 8 выявлена устойчивость к пенициллинам (47%), у 3 – к цефокситиму (фенотип MRSA) (17%), по 2 штамма с устойчивостью к эритромицину и линкозамидам (11%). У двух штаммов с фенотипом MRSA обнаружен ген mecA. У третьего штамма, видимо, устойчивость к бета-лактамам обусловлена иной причиной, что требует проведения дальнейшего исследования.
Из Санкт-Петербурга поступило 7 штаммов Staphylococcus aureus. Устойчивость к пенициллинам выявлена у 6 штаммов, устойчивость к другим антибиотикам не выявлена. Ген mecA не обнаружен.
Из Ростова-на-Дону поступило два штамма, выделенных у новорожденных. У одного штамма выявлена устойчивость к пенициллину, устойчивость к другим антибиотикам не выявлена. Ген mecA не обнаружен.
Из Белгорода поступил один чувствительный ко всем тестируемым антибиотикам штамм, выделенный у женщины. Ген mecA не обнаружен.
Из Екатеринбурга штаммы Staphylococcus aureus не поступали.
В коллекцию вошло 29 коагулазонегативных стафилококков (CoNS), относящихся к пяти разным видам: Staphylococcus epidermidis (n=20), S. haemolyticus (n=6), S. hominis (n=1), S. warneri (n=1) и S. pasteuri (n=1). Гены vanA/vanB не были выявлены ни у одного из штаммов коллекции.
Из Москвы поступило 8 штаммов Staphylococcus epidermidis, из них 7 штаммов выделено у новорожденных и 1 штамм у женщины. Все штаммы были устойчивы к цефокситину, все 4 штамма из 4 исследуемых устойчивы к пенициллинам, 6 из 6 – устойчивы к гентамицину. Шесть штаммов из 8 были устойчивы к эритромицину и линкозамидам, 4 штамма из 6 – к ципрофлоксацину, 2 из 3 – к линезолиду и 1 из 6 – к ванкомицину. У всех 8 штаммов обнаружен ген mecA, являющийся генетической детерминантой устойчивости ко всему классу бета-лактамных антибиотиков.
Из Волгограда поступило 17 штаммов CoNS, из них 11 штаммов Staphylococcus epidermidis, 3 штамма S. haemolyticus и по одному штамму S. hominis, S. warneri и S. pasteuri. Девять штаммов выделено у женщин, восемь – у детей. У 14 штаммов выявлена устойчивость к пенициллинам (82%), по 8 штаммов обладали устойчивостью к цефокситину и эритромицину (47%), по 5 штаммов – к линкозамидам и гентамицину (29%). Три штамма из 17 были устойчивы к ципрофлоксацину (17%). У всех 8 штаммов с метициллин-резистентным фенотипом обнаружен ген mecA, продукт которого приводит к появлению фенотипа.
Из Ростова-на-Дону поступило 3 штамма S. haemolyticus. Два штамма выделены у новорожденных, один – у женщины. Все три штамма были устойчивы к пенициллинам, цефокситину, эритромицину и гентамицину, два штамма из трех – к линкозамидам. У всех штаммов обнаружен ген mecA, продукт которого приводит к появлению метициллин-резистентного фенотипа.
Из Санкт-Петербурга поступил 1 штамм Staphylococcus epidermidis, выделенный у новорожденного. Несмотря на обнаружение гена mecA, устойчивость к цефокситину у этого штамма не была выявлена. Штамм был устойчив к пенициллинам, эритромицину, гентамицину и ципрофлоксацину и чувствителен к цефокситину и линезолиду.
Из Белгорода и Екатеринбурга штаммы CoNS не поступали.
5.2 Молекулярно-генетическая характеристика штаммов коллекции
Klebsiella pneumoniae
Для бактерий, относящихся к виду Klebsiella pneumoniae, характерно наличие большого количества генов, кодирующих бета-лактамазы, обладающие способностью расщеплять бета-лактамные антибиотики. При этом различные бета-лактамазы обладают способностью расщеплять разные спектры бета-лактамных антибиотиков: от пенициллинов и защищенных пенициллинов до цефалоспоринов и карбапенемов. Наиболее важным является наличие генов, кодирующих бета-лактамазы с активностью в отношении карбапенемов (карбапенемазы) и цефалоспоринов (цефалоспориназы, БЛРС). И если можно сравнительно легко выделить и детектировать ряд генов, кодирующих карбапенемазы (blaOXA-40-подобные гены, blaOXA-48-подобные гены, blaOXA-51-подобные гены, blaNDM, blaVIM, blaKPC, blaIMP), то в отношении бета-лактамаз расширенного спектра очень сложно выделить и детектировать гены, однозначно приводящие к фенотипу БЛРС. Однако проблему можно решить, выявляя три основных группы генов: blaCTX-M и blaTEM, blaSHV. Несмотря на то, что детекция генов, относящихся к двум последним группам, не всегда будет означать, что фенотип однозначно будет БЛРС: в ряде случаев обнаруженные гены будут кодировать бета-лактамазы, способные расщеплять только пенициллины, но не цефалоспорины. Поэтому при детекции генов БЛРС неизбежно будет наблюдаться небольшой процент ложноположительных результатов. Кроме того, не следует исключать возможности обнаружения генов из группы blaGES.
В ходе пилотного проекта проанализировано 84 штамма Klebsiella pneumoniae. Результаты детекции генов антибиотикорезистентности приведены в таблице 10.
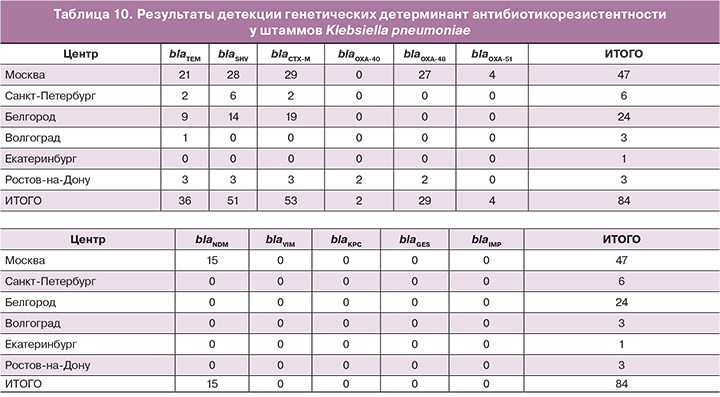
Наиболее часто встречаемыми генами были гены из групп blaCTX-M, blaSHV и blaTEM и blaOXA-48. Значительно реже отмечались гены blaOXA-51 и blaOXA-40. Остальных генов (blaVIM, blaKPC, blaGES, blaIMP) выявлено не было.
Klebsiella oxytoca – вид бактерий, близкий как с точки зрения таксономическом положения, так и по составу генов устойчивости к антимикробным препаратам к виду Klebsiella pneumoniae. В ходе пилотного проекта проанализировано 12 штаммов (табл. 11).
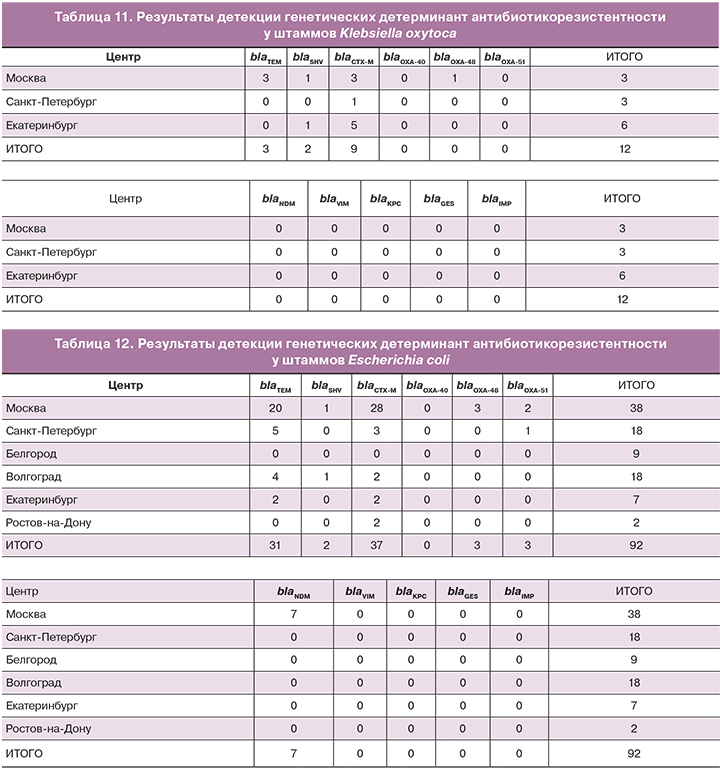
Результаты сходны с результатами, полученными для штаммов Klebsiella pneumoniae: обнаружены гены blaCTX-M, blaSHV и blaTEM. Однако других генов обнаружено не было. Представляется интересным то, что гены blaTEM были обнаружены только у штаммов Klebsiella oxytoca, выделенных у московских пациентов.
Proteus mirabilis
В коллекцию включены три штамма микроорганизмов Proteus mirabilis. Два штамма выделены у московских пациентов, у одного штамма обнаружен ген blaTEM, другие гены не были обнаружены. У третьего штамма, выделенного у пациента из Волгограда гены резистентности не обнаружены.
Escherichia coli
В ходе пилотного проекта проанализировано 92 штамма Escherichia coli. Результаты детекции генов антибиотикорезистентности приведены в таблице 12.
Среди анализируемых генов чаще всего встречались гены blaCTX-M (40% штаммов) и blaTEM (34% штаммов). Гораздо реже наблюдали наличие генов blaNDM, blaOXA-48, blaOXA-51 и blaSHV. Остальные гены антибиотикорезистентности не обнаружены. Двенадцать случаев обнаружения генов, кодирующих карбапенемазы, из тринадцати связаны со штаммами из Москвы.
Enterobacter cloacae
В ходе пилотного проекта проанализировано 46 штаммов Enterobacter cloacae. Результаты приведены в таблице 13.
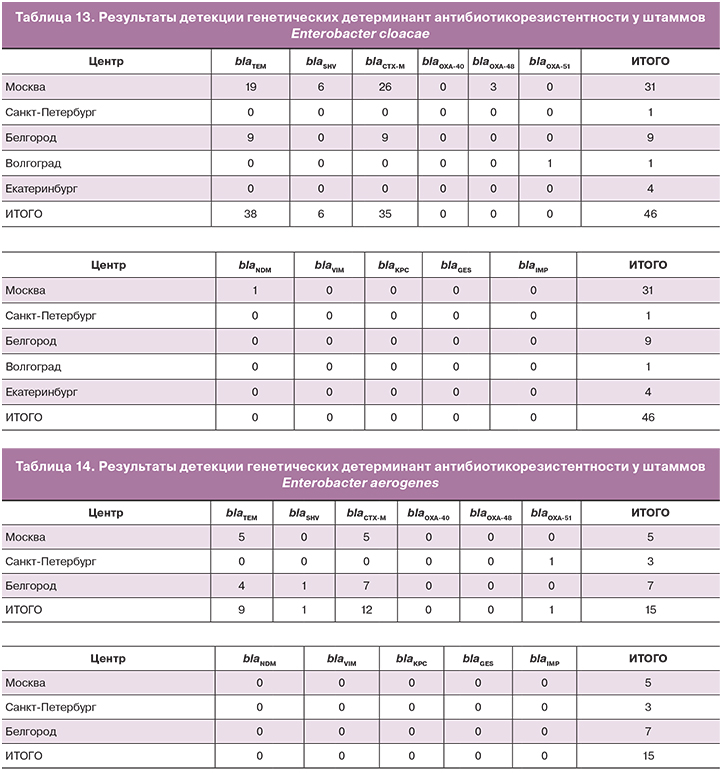
У анализируемых штаммов с очень высокой частотой встречались гены blaTEM (83% штаммов) и blaCTX-M (76% штаммов). Гораздо реже наблюдали наличие генов blaSHV (13%) и blaOXA-48 (7%). По одному штамму обнаружились гены металло-бета-лактамазы blaNDM и сериновой бета-лактамазы blaOXA-51.
Остальные гены не обнаружены.
Кроме того, для четырех штаммов Enterobacter cloacae, выделенных от пациентов из Екатеринбурга, у которых отмечено несоответствие наблюдаемого фенотипа с выявленными генами резистентности, проводилась детекция генов blaAZECL (группа AmpC), специфичных для вида Enterobacter cloacae. Гены были обнаружены в каждом из четырех случаев.
Enterobacter aerogenes
Близкий по таксономии к Enterobacter cloacae вид микроорганизмов Enterobacter aerogenes представлен в коллекции 15 штаммами, выделенных у пациентов Москвы, Белгорода и Санкт-Петербурга. Результаты приведены в таблице 14.
Аналогично Enterobacter cloacae у штаммов Enterobacter aerogenes отмечена высокая частота генов blaTEM и blaCTX-M. Из остальных групп генов по одному штамму содержали гены blaSHV и blaOXA-51.
Serratia marcescens
Еще один представитель семейства Enterobacteriaceae. В коллекцию попал всего один штамм, относящийся к этому виду, выделенный у пациента из Москвы. Гены антибиотикорезистентности не обнаружены.
Acinetobacter baumannii complex
Представитель группы НГОБ. Комплекс видов включает ряд близких, часто трудно-определяемых видов. В коллекцию вошло 11 штаммов двух видов: A. baumannii (9 штаммов) и A. lwoffii (2 штамма), выделенных у пациентов Москвы, Белгорода и Ростова-на-Дону. Результаты приведены в таблице 15.

У штаммов Acinetobacter baumannii обнаружены гены blaOXA-51 (8 штаммов), blaOXA-40 и blaTEM (по 4 штамма), blaCTX-M (2 штамма) и blaGES (1 штамм). Остальные гены не обнаружены.
Pseudomonas aeruginosa
Другим важнейшим представителем группы неферментирующих грамотрицательных бактерий является Pseudomonas aeruginosa. В коллекцию вошло штаммов, выделенных у пациентов Москвы, Волгограда, Белгорода и Ростова-на-Дону. Результаты приведены в таблице 16.
У штаммов Pseudomonas aeruginosa отмечена высокая частота генов blaVIM, кодирующих карбапенемазы: эта группа генов обнаружена у 80% штаммов. Кроме того, обнаружен один штамм с генами blaTEM и blaCTX-M одновременно.
Stenotrophomonas maltophilia
Еще один представитель НГОБ представлен всего одним штаммом, выделенным у пациента из Москвы. Гены устойчивости к антибиотикам обнаружены не были.
Chryseobacterium gleum
Единственный штамм вида Chryseobacterium gleum, грамотрицательных бактерий, относящихся к семейству Flavobacteriaceae, не содержал детектируемых генов.
Streptococcus spp
В коллекцию вошло 32 штамма Streptococcus agalactiae, выделенных у пациентов Москвы, Санкт-Петербурга, Екатеринбурга и Ростова-на-Дону, а также 1 штамм Streptococcus mitis, выделенный у пациента из Санкт-Петербурга. Однако детекция генов, входящих в ПЦР тест-систему, у стрептококков лишена смысла и поэтому не проводилась.
Enterococcus spp.
Для энтерококков характерно наличие генов устойчивости к гликопептидным антибиотикам таким, как ванкомицин и тейкопланин. Считается, что гораздо чаще такие гены распространены среди Enterococcus faecium, но встречаются также и у Enterococcus faecalis. Чаще всего два типа устойчивости энтерококков к гликопептидам обусловлены наличием и деятельностью одного из двух оперонов vanA и vanB. Структура обоих оперонов сходна, они состоят из семи генов, локализованных на транспозонах и способных распространяться от одних бактерий к другим. Гены оперонов vanA и vanB обладают высоким уровнем взаимной гомологии по структурным генам и относительно низкий – по регуляторным генам. Штаммы VanB фенотипа при вариабельном уровне устойчивости к ванкомицину сохраняют чувствительность к тейкопланину, в то время как штаммы VanA фенотипа проявляют устойчивость как к ванкомицину, так и к тейкопланину. Для других видов энтерококков таких, как E. gallinarum, E. casseliflavus и E. flavescens, характерно наличие генов кластера VanC, обуславливающих низкий уровень устойчивости к ванкомицину при полной чувствительности к тейкопланину.
В коллекцию вошло 50 штаммов Enterococcus faecalis, 50 штаммов Enterococcus faecium и 1 штамм Enterococcus gallinarum.
У энтерококков детектировали наличие хотя бы одного из двух оперонов vanA/vanB, так это достаточное условие для развития устойчивости штамма к ванкомицину. При проведении ПЦР использовалась пара групповых праймеров без разделения на vanA и vanB.
У штаммов Enterococcus faecalis, входящих в коллекцию, гены vanA/vanB не обнаружены. У Enterococcus faecium гены vanA/vanB были обнаружены в 33 штаммах (66% штаммов). Распределение выявленных генов по центрам представлено в таблице 17. У штамма Enterococcus gallinarum, выделенного у пациента из Москвы, гены vanA/vanB были обнаружены.

Staphylococcus aureus
В отношении стафилококков среди всех антибактериальных препаратов бета-лактамы характеризуются наибольшим уровнем активности и на настоящее время составляют основу терапии инфекций, вызванных стафилококками. Ген mecA, кодирующий бета-лактамазу у бактерий рода Staphylococcus и входящий в состав мобильного генетического элемента, – «стафилококковая хромосомная кассета mec», кодирует дополнительный пенициллинсвязывающий белок ПСБ-2а, который обладает пониженной афинностью к бета-лактамным антибиотикам. В результате у стафилококков появляется устойчивость ко всему классу бета-лактамных антибиотиков (MRSA), маркером наличия которой и является ген mecA.
Для стафилококков необходимо проводить детекцию гена mecA, а также, так как в литературе описаны достаточно редкие случаи переноса генов, входящих в опероны vanA/vanB, от энтерококков, детекцию генов vanA/vanB.
Стафилококки уместно разделить на две группы: Staphylococcus aureus и виды, входящие в группу коагулазонегативных стафилококков.
В коллекцию вошло 50 штаммов Staphylococcus aureus. Результаты распределения результатов детекции гена mecA по центрам приведены в таблице 18. В целом, ген mecA обнаруживался в 4 штаммах из 39 (10%). Гены vanA/vanB не были выявлены ни у одного из штаммов коллекции.
Коагулазонегативные стафилококки
В коллекцию вошло 29 коагулазонегативных стафилококков, относящихся к пяти разным видам: Staphylococcus epidermidis (20), S. haemolyticus (6), S. hominis (1), S. warneri (1) и S. pasteuri (1). Гены vanA/vanB не были выявлены ни у одного из штаммов коллекции. Результаты распределения результатов детекции гена mecA по центрам с учетом видовой принадлежности штаммов приведены в таблице 19. В целом, ген mecA обнаруживался в 20 штаммах из 29 (69%). Гены vanA/vanB не были выявлены ни у одного из штаммов коллекции.
Таким образом, среди штаммов Пилотной коллекции метициллин-резистентные S.aureus составили 10% (4/39) из Волгограда и Москвы. Среди CoNS метициллин-резистентные штаммы составили 69% (20/29), в основном из Волгограда и Москвы. Среди энтерококков 33,6% штаммов были носителями гена vanA (34/101), все ванкомицин-резистентные штаммы были представлены видом E.faecium и один штамм E.gallinarum, штаммов энтерококков – носителей гена vanB не обнаружено. Абсолютное большинство (33/34) ванкомицин-резистентных штаммов энтерококков представлено штаммами из Москвы, один штамм – из Ростова-на-Дону. Среди энтеробактерий-продуцентов БЛРС большинство были носителями генов blaCTX-M и blaTEM (59 и 43% соответственно), и встречались наиболее часто у штаммов из Москвы (72 и 54%), Белгорода (71 и 45%), Екатеринбурга (39 и 11%); штаммы из Волгограда реже всего несли гены БЛРС, что соответствовало фенотипу. Среди генов карбапенемаз у штаммов из Москвы преобладали гены blaOXA48 (27,5%), также штаммы – носители данного гена выявлены в Ростове-на-Дону, в остальных регионах штаммов-носителей blaOXA48 не обнаружено. Штаммы – продуценты металло-беталактамаз (носители гена NDM) обнаружены только в Москве, среди них виды E.coli, K.pneumoniae, E.cloacae. Генов blaOXA40, blaKPC, blaGES у энтеробактерий не обнаружено.
У 6 из 9 штаммов A.baumannii обнаружены носители blaOXA40 и blaOXA51 из Москвы, Ростова-на Дону и Белгорода, при этом все эти штаммы содержали в себе два гена одновременно, а один штамм содержал в себе дополнительно ген blaGES. Генов blaOXA48 у A.baumannii не обнаружено. У штаммов P.aeruginosa детектированы гены blaVIM 80,6% (25/31), большинство из них 88% (22/25) – из Москвы.
Заключение
Проблема профилактики и лечения инфекций в акушерстве и неонатологии не может быть решена без изменения существующей системы учета, регистрации и мониторинга антибиотикорезистентности возбудителей госпитальных инфекций. Необходима стандартизация и дальнейшая разработка единой системы учета и регистрации инфекций в акушерстве и неонатологии, а также глубокий анализ состояния проблемы антибиотикорезистентности возбудителей, разработка единых алгоритмов диагностики и лечения с учетом региональных особенностей. Проблема профилактики инфекций в акушерстве и неонатологии должна быть более ориентирована на предотвращение появления и распространения госпитальных штаммов микроорганизмов часто отличающихся множественной резистентностью антибактериальным препаратам и дезинфектантам. Поэтому при отнесении случая инфекции к ИСМП в современных условиях при возможности проведения полноценного микробиологического исследования должен использоваться комплекс критериев, а не факт пребывания или длительность пребывания пациентки или новорожденного в стационаре. Важным пунктом при постановке инфекционного диагноза должно быть выделение условно-патогенного и в особенности полирезистентного или характерного для данного лечебного учреждения (госпитального) штамма микроорганизма. В современных условиях наличие функционирующей системы микробиологического мониторинга является обязательным условием профилактики инфекций в акушерских стационарах и перинатальных центрах. Наличие микробиологических лабораторий и совместная работа микробиологов, клинических фармакологов и эпидемиологов в составе групп инфекционного контроля должна быть ориентирована на решение единых задач. Такое взаимодействие должно быть нормативно закреплено, регламентировано и прописано. Для перинатальных центров требуется нормативно закрепить обязательное наличие в их составе микробиологической лаборатории или группы в составе клинико-диагностической лаборатории.
В связи с этим государственное регулирование уровня заболеваемости инфекциями в акушерстве и неонатологии основывается на принципе обратной связи между мероприятиями, направленными на учет и регистрацию случаев, выявлением и расследованием их причин и принятием решений.
РЕЗУЛЬТАТЫ ПИЛОТНОГО ПРОЕКТА
Создана и внедрена в практику модель взаимодействия Центра мониторинга и контроля оппортунистических инфекций в акушерстве и неонатологии с территориальными центрами.
Разработан комплект нормативной документации для осуществления сбора штаммов микроорганизмов и мониторинга резистентности возбудителей оппортунистических инфекций в акушерстве и неонатологии.
Проанализирован видовой состав возбудителей инфекционно-воспалительных заболеваний, выделенных из различных биологических локусов женщин и новорожденных.
Создана и охарактеризована (с помощью бактериологических и молекулярно-генетических методов) пилотная коллекция репрезентативных штаммов возбудителей оппортунистических инфекций у женщин и новорожденных, в том числе, обладающих резистентностью (панрезистентностью) к антимикробным препаратам: выявлены основные тенденции разнообразия генов антибиотикорезистентности, циркулирующих среди штаммов родовспомогательных учреждений.
Разработан проект технического задания на создание типового программного комплекса по формированию и валидации данных об устойчивости микроорганизмов к лекарственным препаратам для обеспечения взаимодействия референс-центров (Центров мониторинга) по различным направлениям медицинской деятельности и микробиологических лабораторий, функционирующих на базе медицинских организаций.
Приложение 1


Приложение 2

Приложение 3
Транспортировка и хранение биологического материала
Основной задачей хранения культур является поддержание их жизнеспособности, сохранение стабильности таксономически важных признаков, а также любых других определенных свойств, представляющих интерес для науки и практики.
В условиях лаборатории штаммы должны храниться таким образом, чтобы возможность мутаций и контаминации культуры была минимальной.
В коллекциях жизнеспособность микроорганизмов поддерживается преимущественно следующими методами:
- периодическими пересевами (субкультивирование): метод подходит для непродолжительного хранения штаммов, их выращивают в пробирке со скошенным агаром (триптиказо-соевым или другим аналогичным для «неприхотливых» микроорганизмов, шоколадным для «прихотливых» бактерий) и хранят в холодильнике при температуре 2–8°С, субкультивируя еженедельно.
- в условиях низких и ультранизких температур: метод основан на приготовлении суспензии микроорганизмов в стабилизирующем растворе (50% фетальной телячьей сыворотки в бульоне, 10–15% глицерина в триптиказо-соевом бульоне, дефибринированная баранья или кроличья кровь). Наилучшую сохранность культур удается получить при хранении в замороженном состоянии при температуре -70°С и ниже в морозильной камере или в жидком азоте.
- под минеральным маслом;
- высушиванием;
- лиофилизацией;
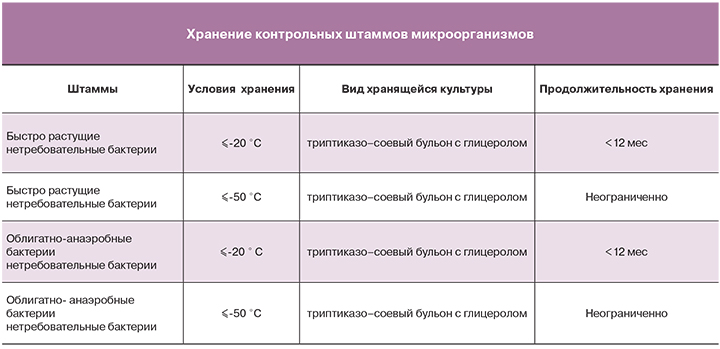
Штаммы хранят в лиофилизированном состоянии, в замороженном виде, в среде с криопротектором или на среде хранения в условиях и на протяжении сроков, приведенных в таблице.
Транспортирование штаммов осуществляется в герметически закрытых емкостях. Под герметически закрытыми емкостями следует понимать запаянные ампулы, пробирки, завальцованные флаконы, запечатанные трубки из толстого стекла или пластического материала, а также пробирки, закрытые пробкой и герметизированные различными пластификаторами (парафин и др.).
Эффективность доставки патологического материала и проведения дальнейших мониторинговых исследований зависит от качества работы системы «холодовой цепи», которая обеспечивает оптимальный температурный режим, гарантирующий сохранение исходной ростовой активности возбудителя при поступлении в Центр мониторинга.
Для этого необходимо пробирки типа – «Эппендорф» с замороженным при температуре -20–80˚С (в триптиказо-соевый бульон с глицеролом) штаммы отправлять в термосумке с контейнерами со льдом.
Емкости, содержащие штаммы микроорганизмов, должны иметь четкие, несмываемые надписи или прочно наклеенные этикетки с обозначением названия штамма, номера штамма и даты лиофилизации (пересева).
Материал доставляется в Центр мониторинга с учетом правил транспортировки для различных видов исследований и лицами, получившими специальный инструктаж.
Упаковка термосумки:
- На дно и по бокам термосумки уложить аккумуляторы холода.
- Извлечь из морозильной камеры подготовленный для отправки материал, поместить в термос со льдом и сразу уложить в термосумку между аккумуляторами холода.
- Накрыть сверху дополнительным аккумулятором холода.
- Приложить заполненный паспорт выделенного штамма возбудителя оппортунистических инфекций на каждый штамм и указать в нем дату и время отправки.
- Плотно закрыть крышку и передать курьеру.
Если штаммы микроорганизмов передаются в незамороженном виде, то емкости с изолятом заворачивают в лигнин или гигроскопическую вату, помещают в металлический или пластмассовый (только для III-IV групп) плотно закрывающийся или завинчивающийся пенал. Упаковка емкостей с штаммами в пенале должна исключать возможность их перемещения во избежание нарушения целостности при транспортировании, а поглощающий материал должен быть в достаточном количестве для сорбции всей жидкости в случае повреждения упаковки.
Отправка материала из межтерриториальных центров в Центр мониторинга, проводится в соответствии с индивидуальным графиком.
Приложение 4
Порядок присвоения номеров музейным штаммам
Каждому закладываемому на хранение штамму в Центре мониторинга будет присвоен уникальный идентификатор, состоящий из восьмирядного номера и даты закладки штамма на хранение.
В десятиразрядном номере два старших разряда будут принимать значения от 01 до 99, соответствующее номеру центра, в котором был выделен штамм. Последующие два разряда будут принимать значения от 01 до 99, соответствующие номеру вида микроорганизма, четыре младших разряда будут принимать значения от 0001 до 9999, соответствующее сквозному порядковому номеру закладки на хранение (Рисунок 1). Дата сохранения штамма позволит отслеживать пересевы, проводимые с культурой для решения возможности диссоциации ее фенотипических признаков. Такая система кодирования в перспективе даст возможность отслеживать поступление штаммов по каждому центру, по каждому виду микроорганизма и дате, а также произвести автоматизацию учета и маркировки хранимых контейнеров с использованием сканеров штрих-кодов. Пример штрих-года содержащего информацию, приведенную на рисунке 1 приведен на рисунке 2.

Приложение 5




