1) ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия;
2) ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия;
3) ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
Актуальность: В настоящее время принята дуалистическая теория развития рака яичника. Опухоли 1 типа и опухоли 2 типа представляют собой разные молекулярно-биологические образования и не являются звеньями одного пути канцерогенеза. Они различаются по морфологическому строению, молекулярному профилю, клиническому течению и подходам в терапии. Для клинической практики важно установить истинную причину онкологического заболевания, поскольку это может влиять на тактику лечения пациенток.
Описание: В статье описан клинический случай сочетания мутаций, характерных для опухолей 1 и 2 типа: у пациентки выявлено сочетание герминальной мутации в гене BRCA1 и соматической мутации в гене NRAS и развитие опухоли по молекулярному каскаду, нехарактерному для носителей мутации в гене BRCA1.
Заключение: Подчеркнуто важное значение выявления истинной генетической причины развития опухоли яичника, поскольку это влияет на стратегию лечения.
мутация NRAS
мутация BRCA1
low-grade серозная карцинома яичника
high-grade серозная карцинома яичника
В настоящее время принята дуалистическая теория развития рака яичника (РЯ). Опухоли 1 типа и опухоли 2 типа – это разные с точки зрения патогенеза заболевания и не являются звеньями одного пути канцерогенеза. Они различаются по морфологическому строению, молекулярному профилю, клиническому течению и подходам в терапии. Представлен клинический случай сочетания мутаций, характерных для опухолей 1 и 2 типа, у одной пациентки и развитие неопластического процесса по одному из молекулярных каскадов. Подчеркнуто важное значение выявления истинной генетической причины развития опухоли яичника, поскольку это влияет на стратегию лечения.
Эпителиальный РЯ – это гетерогенная группа заболеваний, которые различаются по морфологическому строению опухолей, характеризуются специфическим молекулярным фоном и клиническим исходом. Выделяют 2 патогенетических типа РЯ.
Первый тип развивается путем трансформации нормальной ткани яичников в пограничные опухоли, которые в дальнейшем могут прогрессировать до low-grade серозных, low-grade эндометриоидных, муцинозных и светлоклеточных карцином. Предполагается, что причинами развития неопластического процесса в опухолях 1 типа является эндометриоз, хроническое воспалениe, непрекращающаяся овуляция [1–3]. Опухоли этой группы характеризуются медленной пролиферацией и примерно 55% пятилетней выживаемостью [4]. В low-grade серозных карциномах яичников выявляют соматические активирующие мутации в генах – участниках сигнального пути RAS/RAF/MEK/ERK/MAP, включая KRAS, NRAS и BRAF [5]. Мутации BRAF и KRAS активируют их последующую мишень – митоген-активированную протеинкиназу, что приводит к неконтролируемой пролиферации клеток. Соматические мутации BRAF и KRAS обнаруживаются в 20–50% случаев серозных пограничных опухолей и в low-grade серозных карциномах яичника [6–10]. Мутации NRAS не характерны для пограничных опухолей яичника, в то время как в low-grade серозных карциномах их частота составляет 26% [11]. В low-grade серозных карциномах яичника мутации в гене NRAS являются потенциальным маркером прогрессирования заболевания [11, 12].
К опухолям 2 типа относят high-grade серозную карциному, high-grade эндометриоидную карциному, недифференцированную карциному и карциносаркому [13]. Эта группа РЯ характеризуется агрессивным клиническим течением, и в большинстве случаев диагноз устанавливается на поздних стадиях заболевания. Опухоли 2 типа обладают выраженной геномной нестабильностью, для них характерны мутации в генах TP53, BRCA1, BRCA2, но в то же время отсутствуют мутации, свойственные опухолям 1 типа. Интраэпителиальная карцинома фимбриального отдела маточной трубы (STIC) является предполагаемым предшественником high-grade серозной карциномы яичника и часто содержит соматические мутации TP53 [14–16]. Дефекты TP53 – «патогномоничный» молекулярный признак серозных карцином яичника высокой степени злокачественности: частота мутаций в этом подтипе РЯ составляет более 95% [17]. Дальнейшее изучение РЯ у носителей мутаций BRCA1 и BRCA2, а также спорадических случаев подтвердило, что мутации TP53, выявляемые в опухоли яичника, также обнаруживают в STIC маточных труб, что подтверждает их клональное происхождение [18, 19]. Аналогичные результаты были получены для серозного рака брюшины [14]. В дальнейшем в исследованиях подтверждено, что серозный РЯ и брюшины экспрессируют биомаркеры Мюллерова протока, такие, как PAX8, более характерные для маточных труб и не имеют мезенхимальных маркеров, таких как кальретинин яичников [20]. Важно отметить, что обязательным этапом канцерогенеза у носителей герминальной мутаций в генах BRCA1/2 является соматическая утрата второго аллеля гена (феномен потери гетерозиготности (loss of heterozygosity, LOH)), описанная еще в 2000 году Werness B.A. et al. [21]. По нашим наблюдениям, частота потери гетерозиготности в локусе BRCA1 в хемонаивных образцах РЯ составляет более 80% [22, 23].
Таким образом, опухоли 1 типа и опухоли 2 типа – абсолютно разные с точки зрения патогенеза заболевания, что непременно отражается в тактике лечения данных видов РЯ.
Клиническое наблюдение
Больная C., 47 лет, обратилась в онкологический диспансер по месту жительства в марте 2020 г., с жалобами на боли в малом тазу, увеличение живота в размере. У пациентки семейный онкологический анамнез не отягощен. При молекулярно-генетическом тестировании выявлена герминальная мутация в гене BRCA1 c.1961delA [rs80357522]. На первом этапе комбинированного лечения в связи с выраженным распространенным опухолевым процессом пациентке выполнена эксплоративная лапаротомия, двусторонняя овариоэктомия. При патоморфологическом исследовании удаленного препарата установлен гистологический тип опухоли: low-grade серозная карцинома яичника (рис. 1). Был установлен клинический диагноз РЯ IIIC стадии (FIGO), сT3сNхM0.
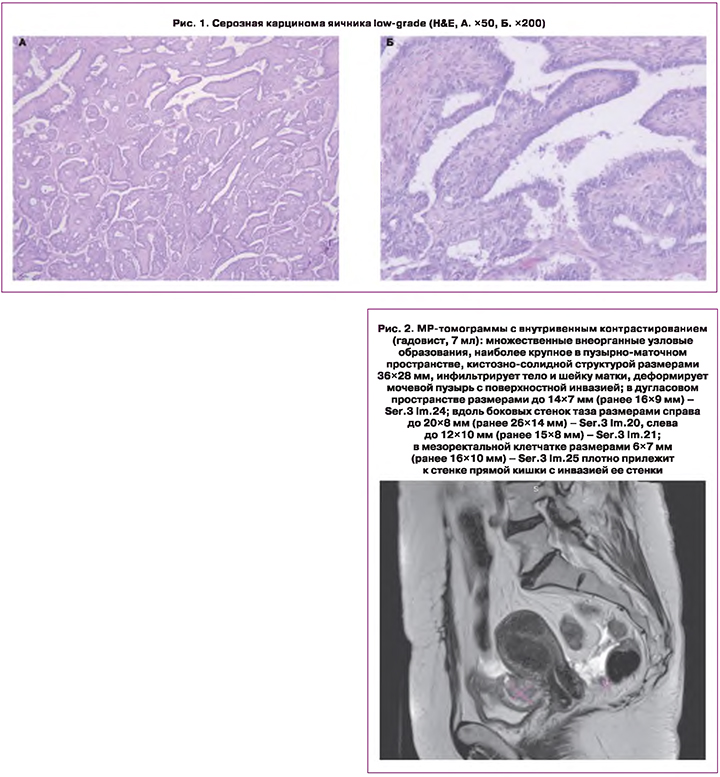
В послеоперационном периоде проведено 6 курсов платиносодержащей химиотерапии с паклитакселом (с апреля по сентябрь 2020 г.), достигнута стабилизация опухолевого процесса. В сентябре 2020 г. пациентке выполнена интервальная циторедуктивная операция в неоптимальном объеме (лапаротомия, оментэктомия) ввиду распространенного канцероматоза. Пациентке продолжено системное лечение: проведено 6 курсов монохимиотерапии препаратом доксорубицин (с декабря 2020 г. по апрель 2021 г.); на фоне лечения достигнут частичный регресс. При контрольном обследовании в мае 2021 г. по данным магнитно-резонансной томографии (МРТ) малого таза и компьютерной томографии (КТ) брюшной полости сохранялись внеорганные узловые образования (рис. 2): наиболее крупный в пузырно-маточном пространстве, кистозно-солидной структуры, размерами 36×28 мм (ранее 35×41 мм), инфильтрирующий тело и шейку матки; в дугласовом пространстве размерами до 14×7 мм (ранее 16×9 мм); вдоль боковых стенок таза размерами справа до 20×8 мм (ранее 26×14 мм), слева до 12×10 мм (ранее 15×8 мм); в мезоректальной клетчатке размерами 6×7 мм (ранее 16×10 мм) с поверхностной инвазией в стенку прямой кишки; по капсуле печени, селезенки, в боковых каналах живота, большом и малом сальнике, на уровне таза, определяются многочисленные сливающиеся узлы, некоторые с кальцинатами (контрольные очаги: в большом сальнике слева 10×9 мм (ранее 11×10 мм), на уровне слепой кишки 12×4 мм (ранее 12×6 мм).
Уровень онкомаркера СA-125 составил 36,51 Ед/мл.
Пациентка обратилась в НМИЦ онкологии им. Н.Н. Петрова для продолжения лечения. В мае 2021 г. выполнена диагностическая лапароскопия для оценки индекса перитонеального канцероматоза. Индекс PCI составил 10, что является предиктором для выполнения оптимальной циторедуктивной операции [24, 25]. В июне 2021 г. в НМИЦ онкологии им. Н.Н. Петрова выполнена оптимальная циторедуктивная операция в объеме экстирпации матки с передней резекцией прямой кишки, резекцией стенки мочевого пузыря, удаления культи большого сальника, перитонеумэктомией единым блоком. При гистологическом исследовании послеоперационного препарата выявлены метастазы серозной карциномы low-grade яичника с множественными опухолевыми эмболами в сосудах в серозную оболочку тела матки, брюшину малого таза, параметрий, параколитическую жировую клетчатку, брыжейку поперечной ободочной кишки, мочевой пузырь, большой сальник (0,9 см в наибольшем измерении), метастазы с признаками невыраженного лечебного патоморфоза в виде единичных участков фиброза, множественных псаммомных телец (рис. 3). В послеоперационном периоде пациентка оставлена под динамическое наблюдение.

История пациентки демонстрирует редкий случай развития low-grade серозной карциномы яичника и носительства герминальной мутации в гене BRCA1. Принимая во внимание, что BRCA1-ассоциированные карциномы яичника имеют high-grade морфологический фенотип, опухолевая ткань была подвергнута молекулярно-генетическому анализу. На первом этапе было принято решение исследовать образец хемонаивной опухоли на наличие феномена потери гетерозиготности (LOH) в гене BRCA1. Обнаружение LOH позволило бы предположить, что опухоль у данной пациентки ассоциирована с носительством мутации в гене BRCA1 вопреки существующим теориям о молекулярных типах опухолей яичника. Однако, при высокопроизводительном секвенировании (NGS) были обнаружены равные фракции прочтений с мутацией и прочтений, соответствующих нормальной последовательности (рис. 4.). Таким образом, в образце наблюдалось сохранение гетерозиготности BRCA1, что ставит под сомнение предположение о том, что данное новообразование ассоциировано с дефицитом функции BRCA1.
В ходе дальнейшего молекулярного анализа была выявлена соматическая мутация NRAS p.Q61R в опухолевой ткани яичника, характерная для low-grade карцином (рис. 5).

Обсуждение
Клинический случай демонстрирует интересное событие: у пациентки выявлено сочетание герминальной мутации в гене BRCA1 и соматической мутации в гене NRAS, при этом патогенетическое развитие опухоли идет по первому типу. Для клинической практики важно установить истинную причину онкологического заболевания, поскольку это может влиять на тактику лечения пациенток. При выявлении нетипичной клинической картины, как в данном случае сочетание low-grade карциномы яичника и герминальной мутации в гене BRCA1, представляется целесообразным установить, является ли данная опухоль дефицитной в отношении функции BRCA1. Последнее обстоятельство может влиять на выбор терапии, в частности, возможное применение BRCA1-специфических препаратов (алкилирующих препаратов, ингибиторов PARP). Отсутствие феномена потери гетерозиготности в опухолевой ткани у представленной пациентки – носительницы известного патогенного варианта в гене BRCA1 и не характерный для носителей наследственных мутаций BRCA1 молекулярный и гистологический тип новообразования свидетельствует, что серозная карцинома low-grade у конкретной пациентки является независимым событием. Однако, подчеркнем, что риск развития истинных BRCA1-ассоциированных новообразований у данной больной остается высоким и требует соответствующего мониторинга.
Заключение
Серозная карцинома яичников низкой степени злокачественности (low-grade) – это редкий подтип опухоли с высоким уровнем летальности у пациентов с метастатическим поражением. Существует острая необходимость в разработке эффективных методов лечения с использованием молекулярных мишеней. Мутации NRAS часто обнаруживаются не только в low-grade серозных карциномах яичника, но также в злокачественных новообразованиях толстой кишки и в меланомах. В настоящее время активно изучается эффективность МЕК ингибиторов в лечении low-grade серозных опухолей яичника.
В заключение, отметим, что определение молекулярного профиля может иметь решающее значение для выбора лекарственной терапии больных.
- Vercellini P., Crosignani P., Somigliana E., Viganò P., Buggio L., Bolis G., Fedele L. The “incessant menstruation” hypothesis: a mechanistic ovarian cancer model with implications for prevention. Hum. Reprod. 2011; 26(9): 2262-73. https://dx.doi.org/10.1093/humrep/der211.
- Saad A., Hu W., Sood A. Microenvironment and pathogenesis of epithelial ovarian cancer. Horm. Cancer. 2010; 1(6): 277-90. https://dx.doi.org/10.1007/s12672-010-0054-2.
- Munksgaard P., Blaakaer J. The association between endometriosis and ovarian cancer: a review of histological, genetic and molecular alterations. Gynecol. Oncol. 2012; 124(1): 164-9. https://dx.doi.org/10.1016/j.ygyno.2011.10.001.
- Sadłecki P., Walentowicz-Sadłecka M., Grabiec M. Molecular diagnosis in type I epithelial ovarian cancer. Ginekol. Pol. 2017; 88(12): 692-7. https://dx.doi.org/10.5603/GP.a2017.0123.
- Xing D., Rahmanto Y.S., Zeppernick F., Hannibal C.G., Kjaer S.K., Vang R. et al. Mutation of NRAS is a rare genetic event in ovarian low-grade serous carcinoma. Hum. Pathol. 2017; 68: 87-91. https://dx.doi.org/10.1016/j.humpath.2017.08.021.
- Vang R., Shih I., Kurman R. Ovarian low-grade and high-grade serous carcinoma: pathogenesis, clinicopathologic and molecular biologic features, and diagnostic problems. Adv. Anat. Pathol. 2009; 16(5): 267-82. https://dx.doi.org/10.1097/PAP.0b013e3181b4fffa.
- Wong K., Tsang Y., Deavers M., Mok S.C., Zu Z., Sun C. et al. BRAF mutation is rare in advanced-stage low-grade ovarian serous carcinomas. Am. J. Pathol. 2010; 177(4): 1611-7. https://dx.doi.org/10.2353/ajpath.2010.100212.
- Ardighieri L., Zeppernick F., Hannibal C., Vang R., Cope L., Junge J. et al. Mutational analysis of BRAF and KRAS in ovarian serous borderline (atypical proliferative) tumours and associated peritoneal implants. J. Pathol. 2014; 232(1): 16-22. https://dx.doi.org/10.1002/path.4293.
- Heublein S., Grasse K., Hessel H., Burges A, Lenhard M, Engel J. et al. KRAS, BRAF genotyping reveals genetic heterogeneity of ovarian borderline tumors and associated implants. BMC Cancer. 2013; 13: 483. https://dx.doi.org/10.1186/1471-2407-13-483.
- Tsang Y., Deavers M., Sun C., Kwan S.Y., Kuo E., Malpica A. et al. KRAS (but not BRAF) mutations in ovarian serous borderline tumour are associated with recurrent low-grade serous carcinoma. J. Pathol. 2013; 231(4): 449-56. https://dx.doi.org/10.1002/path.4252.
- Hunter S., Anglesio M., Ryland G., Sharma R., Chiew Y.E., Rowley S.M. et al. Molecular profiling of low grade serous ovarian tumours identifies novel candidate driver genes. Oncotarget. 2015; 6(35): 37663-77. https://dx.doi.org/10.18632/oncotarget.5438.
- Alsop K., Fereday S., Meldrum C., deFazio A., Emmanuel C., George J. et al. BRCA Mutation Frequency and Patterns of Treatment Response in BRCA Mutation-Positive Women With Ovarian Cancer: A Report From the Australian Ovarian Cancer Study Group. J. Clin. Oncol. 2012; 30(21): 2654-63. https://dx.doi.org/10.1200/JCO.2011.39.8545.
- Walker J.L., Powell C.B., Chen L., Carter J., Bae Jump V.L., Parker L.P. et al. Society of Gynecologic Oncology recommendations for the prevention of ovarian cancer. Cancer. 2015; 121(13): 2108-20. https://dx.doi.org/10.1002/CNCR.29321.
- Carlson J., Miron A., Jarboe E., Parast M.M., Hirsch M.S., Lee Y. et al. Serous tubal intraepithelial carcinoma: its potential role in primary peritoneal serous carcinoma and serous cancer prevention. J. Clin. Oncol. 2008; 26(25): 4160-5. https://dx.doi.org/10.1200/JCO.2008.16.4814.
- Kurman R. Origin and molecular pathogenesis of ovarian high-grade serous carcinoma. Ann. Oncol. 2013; 24(10, Suppl.): 16-21. https://dx.doi.org/10.1093/annonc/mdt463.
- Vang R., Shih I., Kurman R. Fallopian tube precursors of ovarian low- and high-grade serous neoplasms. Histopathology. 2013; 62(1): 44-58. https://dx.doi.org/10.1111/his.12046.
- Cole A.J., Dwight T., Gill A.J., Dickson K.A., Zhu Y., Clarkson A. et al. Assessing mutant p53 in primary high-grade serous ovarian cancer using immunohistochemistry and massively parallel sequencing. Sci. Rep. 2016; 18(6): 26191. https://dx.doi.org/10.1038/srep26191.
- Kindelberger D., Lee Y., Miron A., Hirsch M.S., Feltmate C., Medeiros F. et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: evidence for a causal relationship. Am. J. Surg. Pathol. 2007; 31(2): 161-9. https://dx.doi.org/10.1097/01.pas.0000213335.40358.47.
- Bowtell D. The genesis and evolution of high-grade serous ovarian cancer. Nat. Rev. Cancer. 2010; 10(11): 803-8. https://dx.doi.org/10.1038/nrc2946.
- Norquist B., Garcia R., Allison K., Jokinen C.H., Kernochan L.E., Pizzi C.C. et al. The molecular pathogenesis of hereditary ovarian carcinoma: alterations in the tubal epithelium of women with BRCA1 and BRCA2 mutations. Cancer. 2010; 116(22): 5261-71. https://dx.doi.org/10.1002/cncr.25439.
- Werness B., Parvatiyar P., Ramus S., Whittemore A.S., Garlinghouse-Jones K., Oakley-Girvan I. et al. Ovarian carcinoma in situ with germline BRCA1 mutation and loss of heterozygosity at BRCA1 and TP53. J. Natl. Cancer Inst. 2000; 92(13): 1088-91. https://dx.doi.org/10.1093/jnci/92.13.1088.
- Gorodnova T.V., Sokolenko A.P., Ivantsov A.O., Iyevleva A.G., Suspitsin E.N., Aleksakhina S.N. et al. High response rates to neoadjuvant platinum-based therapy in ovarian cancer patients carrying germ-line BRCA mutation. Cancer Lett. 2015; 369(2): 363-7. https://dx.doi.org/10.1016/j.canlet.2015.08.028.
- Sokolenko A.P., Savonevich E.L., Ivantsov A.O., Raskin G.A., Kuligina E.S., Gorodnova T.V. et al. Rapid selection of BRCA1-proficient tumor cells during neoadjuvant therapy for ovarian cancer in BRCA1 mutation carriers. Cancer Lett. 2017; 397: 127-32. https://dx.doi.org/10.1016/j.canlet.2017.03.036.
- Берлев И.В., Беляев А.М., Карачун А.М., Городнова Т.В., Доманский А.А., Пелипась Ю.В., Гусейнов К.Д., Ибрагимов З.Н., Соколенко А.П., Яковева М.Г. и др. Циторедуктивные операции с перитонеумэктомией у больных раком яичников: технические аспекты и непосредственные результаты. Вопросы онкологии. 2018; 64(3): 345-52.
- Жорданиа К.И., Паяниди Ю.Г., Калиничева Е.В. Парадигма этиологии серозного рака яичников. Акушерство и гинекология. 2014; 9: 10-5.
Поступила 27.12.2021
Принята в печать 02.03.2022
Городнова Татьяна Васильевна, к.м.н., н.с., НМИЦ онкологии им. Н.Н. Петрова Минздрава России, 197758, Россия, Санкт-Петербург, пос. Песочный,
ул. Ленинградская, д. 68,
t.gorodnova@mail.ru, https://orcid.org/0000-0003-1719-7498, SPIN-код: 2661-9106, Scopus AuthorID: 36010503000
Соколенко Анна Петровна, к.м.н., с.н.с. лаборатории молекулярной онкологии, НМИЦ онкологии им. Н.Н. Петрова Минздрава России,
197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68; доцент кафедры общей и молекулярной медицинской генетики, СПбГПМУ
Минздрава России, 194100, Россия, Санкт-Петербург, ул. Литовская, д. 2,
annasokolenko@mail.ru, https://orcid.org/0000-0001-6304-1609, РИНЦ AuthorID: 153982,
Scopus AuthorID: 7004209770, Researcher ID: G-3123-2013
Котив Христина Богдановна, к.м.н., н.с. отделения онкогинекологии, НМИЦ онкологии им. Н.Н. Петрова Минздрава России,
197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68; ассистент кафедры акушерства и гинекологии, СЗГМУ им. И.И. Мечникова
Минздрава России, 191015, Россия, Санкт-Петербург, ул. Кирочная, д. 41,
kotiv.onc@gmail.com, https://orcid.org/0000-0002-0486-2404, SPIN-code: 3049-8250,
Scopus AuthorID: 57193895371
Иванцов Александр Олегович, д.м.н., Ученый секретарь, НМИЦ онкологии им. Н.Н. Петрова Минздрава России, 197758, Россия, Санкт-Петербург,
пос. Песочный,ул. Ленинградская, д. 68,
shurikiv@mail.ru, https://orcid.org/0000-0001-6279-2312, SPIN-код: 8347-0332
Ибрагимов Заур Намиг оглы, к.м.н., н.с. отделения онкогинекологии, НМИЦ онкологии им. Н.Н. Петрова Минздрава России,
197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68.
zaur-ibragimov@yandex.ru
Берлев Игорь Викторович, д.м.н., профессор, заслуженный врач РФ, заведующий отделением онкогинекологии, НМИЦ онкологии им. Н.Н. Петрова Минздрава России, 197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68; заведующий кафедрой акушерства и гинекологии, СЗГМУ им. И.И. Мечникова
Минздрава России, 191015, Россия, Санкт-Петербург, ул. Кирочная, д. 41,
i.berliv@gmail.com, SPIN-код: 4169-6011, AuthorID: 668976, Scopus AuthorID: 6603322008
Урманчеева Аделия Федоровна, д.м.н., профессор, в.н.с. отделения онкогинекологии, НМИЦ онкологии им. Н.Н. Петрова Минздрава России,
197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68; заведующая учебной частью кафедры онкологии, СЗГМУ им. И.И. Мечникова
Минздрава России, 191015, Россия, Санкт-Петербург, ул. Кирочная, д. 41,
adaurm@mail.ru, https://orcid.org/0000-0003-2835-2983, SPIN-код: 4169-6011
Имянитов Евгений Наумович, д.м.н., профессор, член-корр. РАН, заведующий научным отделом биологии опухолевого роста, НМИЦ онкологии им. Н.Н. Петрова Минздрава России, 197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, д. 68; заведующий кафедрой общей и молекулярной медицинской генетики, СПбГПМУ Минздрава России, 194100, Россия, Санкт-Петербург, ул. Литовская, д. 2,
evgeny@imyanitov.spb.ru, https://orcid.org/0000-0003-4529-7891,
SPIN-code: 1909-7323, Scopus AuthorID: 7003644486
Вклад авторов: Городнова Т.В., Соколенко А.П., Иванцов А.О. – разработка концепции научной работы, чистовой вариант рукописи; Котив Х.Б., Ибрагимов З.Н. – дизайн статьи, составление черновика рукописи; Берлев И.В., Урманчеева А.Ф., Имянитов Е.Н. – критический пересмотр с внесением ценного интеллектуального содержания.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Работа выполнена при поддержке гранта РНФ № 21-75-30015.
Одобрение Этического комитета: Исследование было одобрено локальным Этическим комитетом ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России.
Согласие пациентов на публикацию: Пациентка подписала информированное согласие на публикацию своих данных и изображений.
Для цитирования: Городнова Т.В., Соколенко А.П., Котив Х.Б., Иванцов А.О., Ибрагимов З.Н., Берлев И.В., Урманчеева А.Ф., Имянитов Е.Н.
Редкий случай развития low-grade серозной карциномы яичника с мутацией NRAS у носительницы патогенного варианта BRCA1.
Акушерство и гинекология. 2022; 4: 176-182
https://dx.doi.org/10.18565/aig.2022.4.176-182






