Преэклампсия (ПЭ) является важной медико-социальной проблемой во всем мире и одной из главных причин материнской заболеваемости и смертности [1, 2]. За последние десятилетия знания в области изучения звеньев патогенеза ПЭ достаточно расширились. Предполагается, что осложнение связано с дисбалансом системного воспалительного ответа, возникающего при беременности, и иммунной толерантностью к полуаллогенному плоду (или полностью аллогенному в случае донации яйцеклетки) [3, 4].
Ранее проведенное нами исследование широкого спектра цитокинов в периферической крови показало, что при ПЭ наиболее значимые различия имеют цитокины моноцитарного происхождения – интерлейкины (IL) IL-10 и IL-6 [4]. Моноциты являются многофункциональными клетками, которые принимают участие в гомеостазе, иммунном ответе и репарации тканей [5]. Согласно классификации, предложенной Международным союзом иммунологических обществ, моноциты разделены на три популяции по фенотипическим признакам. В зависимости от уровня экспрессии рецептора липополисахарида (LPS), CD14 и Fcγ-III рецептора CD16 были определены классические (CD14++CD16–), промежуточные (CD14++CD16+) и неклассические (CD14+CD16++) моноциты [6]. Известно, что моноциты экспрессируют лейкоцитарный антиген-DR (HLA-DR), молекулу, опосредующую антигенную презентацию Т-клеткам, и комбинация поверхностных маркеров CD14, CD16 и HLA‐DR позволяет наиболее точно отличать моноциты от лимфоцитов и других лейкоцитов.
У здоровых людей приблизительно 80–90% моноцитов представляют собой CD16-негативные классические моноциты. Остальные 10–20% моноцитов являются CD16-положительными промежуточными и неклассическими моноцитами [6]. При здоровой беременности наблюдается снижение числа классических моноцитов и увеличение числа промежуточных моноцитов [7]. Данные изменения могут быть вызваны врожденным иммунитетом, что наблюдается, в частности, при трансплантации органов. Так, при пересадке почки наблюдается снижение количества CD16-негативных моноцитов и увеличение CD16-положительных моноцитов обоих субпопуляций [8]. Соотношение субпопуляций моноцитов изменяется при некоторых патологических состояниях, включающих воспалительные и инфекционные заболевания [9] и ишемическую болезнь сердца [10].
Несмотря на то что моноцитам в периферической крови при ПЭ уделяется большое внимание, четкого распределения моноцитов по группам ранее сделано не было [11]. В данной работе исследовано относительное содержание субпопуляций моноцитов в периферической крови женщин с диагнозами умеренной ПЭ, тяжелой ПЭ и женщин с физиологически протекающей беременностью.
Цель исследования – изучить относительное содержание субпопуляций моноцитов в периферической крови женщин с ПЭ и физиологически протекающей беременностью.
Материалы и методы
Было проведено исследование, включающее 48 беременных женщин, которые наблюдались в научно-поликлиническом отделении и были родоразрешены в ФГБУ «НМИЦ АГП им. В.И Кулакова» Минздрава России. Женщины были разделены на две группы – основную и контрольную. Основную группу составили две подгруппы: 1-я подгруппа – 20 беременных женщин с умеренной ПЭ; 2-я подгруппа – 12 беременных женщин с тяжелой ПЭ. Контрольную группу составили 16 женщин с физиологически протекающей беременностью, без отягощенного акушерского анамнеза, родоразрешенных в срок. Постановка диагноза умеренной/тяжелой ПЭ основывалась на данных клинической картины, лабораторных и инструментальных методах общепринятой диагностики. Данное исследование одобрено этическим комитетом. Все пациенты были ознакомлены с целью и методами исследования, получено добровольное письменное согласие. Критерии включения в исследование: беременные в сроке от 22 до 40 недель, возраст – от 18 до 45 лет, отсутствие тяжелой экстрагенитальной патологии, наличие умеренной или тяжелой ПЭ (для основной группы). Критериями исключения были резус-конфликт, обострение и/или хронические воспалительные заболевания, аутоиммунные заболевания, онкологические заболевания, пороки развития плода.
 Забор венозной крови проводился в пробирки, содержащие этилендиаминтетраацетат (ЭДТА), после чего цельная кровь наслаивалась на раствор Histopaque-1077 (Sigma-Aldrich, USA) и разделялась на компоненты 20-минутным центрифугированием при 400g. Лейкоцитарное кольцо осторожно отбиралось, и двумя последующими центрифугированиями клетки отмывались от присутствия Histopaque. Осадок лейкоцитов суспендировали в проточной жидкости Facs Flow и каждый из образцов разделяли на две аликвоты по 100 мкл. В одну аликвоту добавляли коктейль из антител против IgG, меченных фикоэритрином (PE), флуоресцеином (FITC) и аллофикоцианином (APC) (Beckman Coulter, USA) в количестве 10 мкл каждого. Во вторую аликвоту вносили антитела CD14-PE, CD16-FITC, HLA-DR-APC (Beckman Coulter, USA). Инкубацию с антителами проводили в течение 30 минут при +4°С. Далее объем аликвот доводили Facs Flow до 1,5 мл и анализ осуществляли на проточном цитофлуориметре (BD FacsCalibur, USA). Были идентифицированы три субпопуляции моноцитов: классические (CD14++CD16−HLA-DR+), промежуточные (CD14++CD16+HLA-DR+) и неклассические (CD14+CD16++HLA-DR+) (рис. 1).
Забор венозной крови проводился в пробирки, содержащие этилендиаминтетраацетат (ЭДТА), после чего цельная кровь наслаивалась на раствор Histopaque-1077 (Sigma-Aldrich, USA) и разделялась на компоненты 20-минутным центрифугированием при 400g. Лейкоцитарное кольцо осторожно отбиралось, и двумя последующими центрифугированиями клетки отмывались от присутствия Histopaque. Осадок лейкоцитов суспендировали в проточной жидкости Facs Flow и каждый из образцов разделяли на две аликвоты по 100 мкл. В одну аликвоту добавляли коктейль из антител против IgG, меченных фикоэритрином (PE), флуоресцеином (FITC) и аллофикоцианином (APC) (Beckman Coulter, USA) в количестве 10 мкл каждого. Во вторую аликвоту вносили антитела CD14-PE, CD16-FITC, HLA-DR-APC (Beckman Coulter, USA). Инкубацию с антителами проводили в течение 30 минут при +4°С. Далее объем аликвот доводили Facs Flow до 1,5 мл и анализ осуществляли на проточном цитофлуориметре (BD FacsCalibur, USA). Были идентифицированы три субпопуляции моноцитов: классические (CD14++CD16−HLA-DR+), промежуточные (CD14++CD16+HLA-DR+) и неклассические (CD14+CD16++HLA-DR+) (рис. 1).
Относительное содержание (%) моноцитов вычисляли как количество моноцитов в каждой субпопуляции к общему количеству моноцитов.
Статистическая обработка. Результаты представлены в виде медианы, верхней и нижней квартили Me (Q1;Q3) для непараметрической статистики. Статистическая значимость различий определялась с помощью параметрического t-критерия Стьюдента при соблюдении нормального распределения, определенного с помощью критерия Шапиро–Уилка и равенства дисперсий, определенного с помощью критерия Левина. При несоблюдении указанных условий использовался непараметрический критерий Манна–Уитни. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Различия считали статистически значимыми при p<0,05. Для сравнения трех независимых групп по одному количественному признаку применялся дисперсионный анализ (ANOVA) при нормальном распределении признаков и равенстве дисперсий в сравниваемых генеральных совокупностях или ранговый анализ вариаций по Краскелу–Уоллису при распределении, отличном от нормального. При наличии статистически значимых различий в ANOVA или по Краскелу–Уоллису проводился апостериорный попарный анализ с помощью t-критерия Стьюдента при соблюдении нормального распределения или критерия Манна–Уитни при отсутствии нормального распределения с поправкой Бонферрони в обоих случаях. При сравнении 3 групп по качественным признакам также применялась поправка на множественные сравнения. Для определения диагностической эффективности исследуемой модели использовался ROC-анализ. Данные ROC-анализа представлены в виде площади под кривой с 95% доверительным интервалом (ДИ). Для статистической обработки результатов и построения графиков использовались программы Attestat (Россия), Statistica 10 и OriginPro 8.5 (USA).
Результаты и обсуждение
Основные клинико-анамнестические данные и значимые осложнения беременности женщин представлены в таблице.
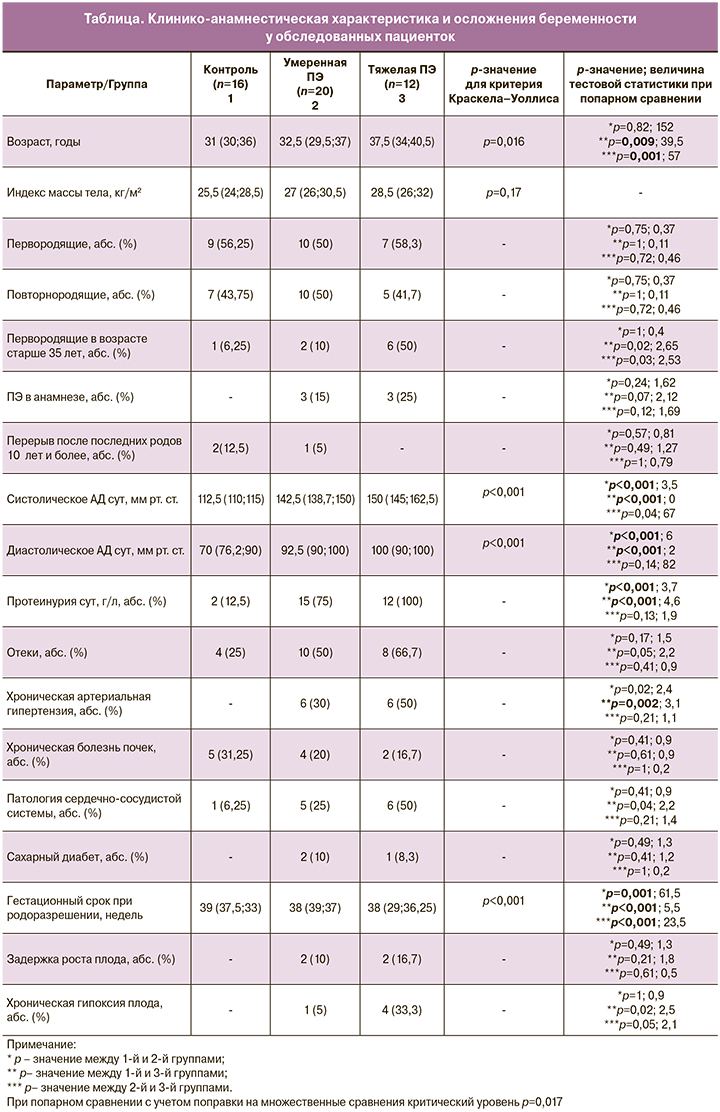
Возраст обследованных женщин варьировал от 18 до 45 лет и составил 31 (30;36), 32,5 (29,5;37), 37,5 (34;40,5) года (по группам соответственно). Срок беременности при родоразрешении составил 39 (37,5;33), 38 (39;37), 38 (29;36,25) недель (по группам соответственно). Анализ антропометрических данных не выявил статистически значимых различий между группами. При анализе связи ПЭ с основными общепринятыми факторами риска были выявлены следующие: возраст, наличие клинически значимой протеинурии, экстрагенитальная патология, среди которой наиболее часто встречалась патология сердечно-сосудистой системы. При изучении исхода родов для плода диагноз хронической гипоксии плода чаще встречался в группах с умеренной и тяжелой ПЭ, однако статистически значимых различий выявлено не было. Нам не удалось обнаружить связь ПЭ с такими общепринятыми факторами риска, как первая беременность, повторнородящие с ПЭ в анамнезе, перерыв после последних родов 10 и более лет, избыточная масса тела/ожирение, семейный анамнез, хронические заболевания почек, коллагенозы, сахарный диабет, антифосфолипидный синдром.
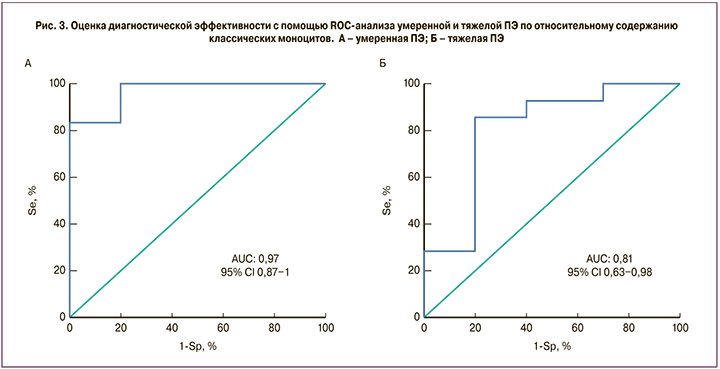
Содержание классических, промежуточных и неклассических субпопуляций моноцитов в процентах от общего количества моноцитов для контрольной группы, умеренной ПЭ и тяжелой ПЭ представлены на рис. 2. В группах пациентов с умеренной и тяжелой ПЭ наблюдалось снижение классических CD16-негативных моноцитов по сравнению с контрольной группой в периферической крови (рис. 2, А). Причем в группе с тяжелой ПЭ содержание классических моноцитов было ниже, чем в группе с умеренной ПЭ. Таким образом, было показано, что относительное содержание классических CD16-негативных моноцитов в периферической крови имеет обратную корреляцию с тяжестью ПЭ. Содержание классических моноцитов в контрольной группе составило 56,55 (45,3;12,6)%, у женщин с умеренной ПЭ – 40,65 (34,2;60,8)%, р=0,01, у женщин с тяжелой ПЭ – 17,4 (53,2;19,5)%, р=0,001 (рис. 2, А). При этом ROC-анализ показал хорошую диагностическую ценность при сравнении группы контроля с группой с умеренной ПЭ – AUC=0,81 (95% ДИ 0,63–0,98), чувствительность 86%, специфичность 80%, и отличную диагностическую ценность при сравнении группы контроля с группой с тяжелой ПЭ – AUC=0,96 (95% ДИ 0,87–1), чувствительность 83%, специфичность 100% (рис. 3). Содержание промежуточных и неклассических моноцитов в периферической крови было повышено в группах с умеренной и тяжелой ПЭ. В случае неклассических моноцитов их содержание в периферической крови составило: в контрольной группе – 12,65 (20,4; 22,7)%, у женщин с умеренной ПЭ – 16,05 (12,6; 16,7)%, с тяжелой ПЭ – 26,05 (8,9; 44,7)%; в случае промежуточных моноцитов – 31,45 (50,3; 39,2)%, 40,3 (32,2; 39)%, 49,2 (25; 56,6)% по группам соответственно. Однако статистически значимые различия наблюдались только при сравнении тяжелой ПЭ с контрольной группой в обеих субпопуляциях (неклассических и промежуточных) моноцитов (рис. 2, Б, В).

Существует несколько работ, в которых проводилось фенотипирование моноцитов при ПЭ. Так, B.N. Melgert и соавт. (2012) показали, что количество промежуточных моноцитов увеличивается, а классических моноцитов уменьшается при ПЭ, по сравнению со здоровой беременностью [12]. В данной работе не был использован моноцитарный маркер HLA-DR и не было разделения ПЭ на умеренную и тяжелую. В результате при ПЭ относительное содержание классических моноцитов было снижено на несколько процентов. В исследовании M.X. Tang и соавт. [13] были представлены результаты по промежуточным и неклассическим моноцитам, которые показали, что содержание промежуточных моноцитов коррелирует с тяжестью ПЭ, при этом классические моноциты не были описаны. Эти данные косвенно подтверждают наши результаты. Также в работе коллег из Великобритании E. Al-Ofi и соавт. [14] было продемонстрировано повышенное количество неклассических моноцитов у женщин с ПЭ по сравнению с физиологически протекающей беременностью. По-видимому, разноречивость полученных результатов может быть связана с использованием разных методов, а также этническими различиями беременных исследуемых групп. В нашем исследовании выявлено значительное снижение содержания классических CD16-негативных моноцитов при умеренной ПЭ – на 15,9% и при тяжелой ПЭ – на 55,1%. При этом обе субпопуляции CD16-положительных (неклассических и промежуточных) моноцитов увеличивались, но не было четкой направленности к одной из них. Данный факт может быть обусловлен наличием реакции организма беременной на полуаллогенный трансплантат (плод), обусловленный врожденным иммунитетом. В процессе физиологической беременности наблюдается иммунологическая толерантность, выражающаяся в отсутствии у матери иммунной реакции на развивающийся плод и плаценту. В случае ПЭ снижение классических CD16-негативных моноцитов, показанное в данной работе, подтверждает теорию о причине ПЭ как недостаточной толерантности иммунной системы матери к плоду [3, 15].
Заключение
Таким образом, полученные результаты указывают на перспективность исследований моноцитов на ранних этапах беременности для прогнозирования развития ПЭ.



