В настоящее время гипертензивные осложнения во время беременности, в частности преэклампсия (ПЭ), занимают 4-е место в структуре причин материнской смертности [1]. Ежегодно от ПЭ и ее осложнений в мире погибают 50 000 беременных. В России на ПЭ и эклампсию в структуре материнской смертности приходится 12,4% (2017 г.). В связи с этим актуальным является выделение пациенток группы риска в отношении ПЭ и проведение у них профилактических мероприятий.
В отечественном акушерстве за последние 20–30 лет предложены многочисленные методы прогнозирования ПЭ. Использовались как клинические данные (анамнез, наличие экстрагенитальных заболеваний и т.д.), так и лабораторные, связанные в первую очередь с особенностью системы кровообращения [1–3].
Клинические факторы риска ПЭ представлены в последних рекомендациях «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2016 г.).
Они представлены также в рекомендациях National Institute for Health and Care Excellence (NICE, 2019 г.) [4] и American College of Obstetricians and Gynecologists (ACOG, 2019 г.) [5]. Если в первых учитывалось наличие одного из них, то во втором факторы риска разделены на предикторы умеренного и высокого риска.
Использование клинических факторов риска для прогнозирования ПЭ не требует финансовых затрат, легко используемо. Однако только с их учетом частота ложноположительных результатов может достигать 64,2% [5]. Более того, внедрение их в клиническую практику не снизило частоту тяжелых форм ПЭ и ее значимость в структуре материнской смертности.
Для более точного выделения риска развития ПЭ фонд медицины плода (FMF) под руководством Kypros Nicolaides разработал схему пренатального скрининга на основе комплекса клинических данных, показателей среднего артериального давления, пульсационного индекса (ПИ) в маточных артериях (МА), уровня ассоциированного с беременностью плазменного протеина А (РАРР-А) и плацентарного фактора роста (PLGF) в материнской крови. Эта схема была апробирована на 60 000 беременных [6].
В настоящее время определение факторов риска ПЭ может осуществляться в рамках I пренатального скрининга в 11–14 недель беременности. При этом прогнозируется ранняя (наступившая до 34 недель) и поздняя (до 37 недель) ПЭ. Вычисление риска ПЭ осуществлялось автоматически, согласно программе Astraia с учетом данных о расе, курении, методах зачатия, возрасте пациентки, наличии хронической артериальной гипертензии (ХАГ), сахарного диабета I и II типов, антифосфолипидного синдрома и наследственных тромбофилий, в анамнезе преждевременных родов ≥ 24 недель, ПЭ в анамнезе матери пациентки, индекса массы тела, артериального давления (АД), биохимических показателей (РАРР-А, PLGF), ПИ в МА.
На основании выявленных факторов риска ПЭ в 11–14 недель были разработаны принципы ее профилактики [6]. Для этого проводилось рандомизированное плацебо-контролируемое исследование по изучению профилактического приема ацетилсалициловой кислоты – ASPRE (aspirin for evidence-based preeclampsia prevention trial). Исследование включало более 30 000 беременных в Великобритании, Бельгии, Италии, Испании, Греции, Израиле. Российская Федерация в исследовании не участвовала [7].
Одним из возможных механизмов действия ацетилсалициловой кислоты можно считать индукцию интерлейкина 3 (IL-3) – важного гуморального фактора роста и развития плаценты. Кроме того, имеются данные о влиянии ацетилсалициловой кислоты на процессы апоптоза в трофобласте, что может определять эффект этих препаратов для профилактики осложнений беременности, связанных с нарушением миграции цитотрофобласта [8]. На разных этапах исследователи рекомендовали различные дозы ацетилсалициловой кислоты – от 50 до 162 мг/сут [6]. Согласно результатам исследования, прием ацетилсалициловой кислоты в дозе 150 мг/сут вечером (перед сном), начатый впервые в 12–16 недель и продолженный до 36 недель является наиболее эффективным.
Повышение дозы до 150–162 мг/сут обусловлено меньшей резистентностью пациенток к высоким дозам ацетилсалициловой кислоты [9–11].
С 2011 г. в России действует система пренатального скрининга: в 11–14 недель гестации, наряду с традиционным ультразвуковым исследованием и комбинированным скринингом на хромосомные аномалии у плода, в отделении пренатального скрининга производился расчет риска развития ПЭ до 34 и 37 недель беременности по программе Astraia. Известны немногочисленные работы по результатам проводимого скрининга. Данные, приведенные М.В. Медведевым и соавт. (2018 г.), свидетельствовали о положительных результатах по снижению частоты ПЭ и задержки роста плода при внедрении программы Astraia в клиническую практику в Москве [12].
Цель исследования – провести анализ прогнозирования и профилактики ПЭ с использованием пренатального скрининга в условиях городского центра планирования семья и репродукции.
Материалы и методы
Проведен ретроспективный анализ историй 2374 пациенток, наблюдавшихся в 2017–2019 гг. во время беременности в кабинете пренатального скрининга на базе московского государственного бюджетного учреждения здравоохранения «Центр планирования семьи и репродукции департамента здравоохранения города Москвы».
С учетом рассчитанной программой Astraia вероятности развития ПЭ пациентки были определены в группы высокого и низкого риска в отношении данного заболевания. Пороговым значением для включения в группу высокого риска по ПЭ считали вероятность ≤1:100. Из 2374 пациенток, обследованных в 2017–2019 гг., в группу высокого риска были определены 209 (8,8%) человек, из которых у 21 (10,0%) развилась ПЭ.
Одновременно для сравнительной оценки значимости факторов риска нам удалось проследить 102 пациенток с низким риском ПЭ и 18 беременных с низким риском, у которых отмечена ПЭ тяжелой степени в разные сроки гестации.
Из 209 беременных группы риска 175 (83,7%) проводились профилактические мероприятия: 92 (52,6%) принимали ацетилсалициловую кислоту, из которых у 12 (13%) развилась ПЭ: умеренная – у 8 (66,7%), тяжелая форма – у 4 (33,3%).
Все пациентки, принимавшие ацетилсалициловую кислоту, подписали информированное согласие на ее прием в дозе 150 мг с 12-й по 36-ю неделю согласно приказу №572н.
55 пациенток (31,4%) получали дипиридамол1 (75 мг) – у 1 (1,8%) отмечалась умеренная ПЭ.
28 женщинам (16%) с учетом наследственной тромбофилии и явлений гиперкоагуляции назначался эноксапарин натрия (0,4 мг/сутки) одновременно с ацетилсалициловой кислотой в дозах 100 мг/сутки (n=16) или дипиридамолом в дозе 75 мг/сутки (n=12). У 4 (14,3%) развилась умеренная ПЭ.
От приема лекарственных препаратов отказались 34 беременные (16,3%), среди которых симптомы заболевания наблюдались у 4 (11,8%) – у всех развилась умеренная форма ПЭ.
Пациентки обследовались в женской консультации согласно приказу №572н.
Биохимические показатели (PAPP-A, PLGF) определялись на экспресс-анализаторе DELFIA Xpress компании Perkin Elmer. Ультразвуковые исследования с определением ПИ в МА проводились на ультразвуковых аппаратах Voluson E8 (GE) по правилам FMF2.
Статистическая обработка материалов выполнена с использованием пакетов прикладных программ SPSS Statistics 25, Exсel.
Различия между группами анализировались с помощью критерия χ2 Пирсона, который использовался для сравнения двух относительных показателей, характеризующих частоту определенного признака, имеющего два значения (клинические факторы, освещенные в табл. 1).
Критерий Фишера применялся для анализа четырехпольных таблиц в случае значений ожидаемого явления менее 5, что является ограничением для применения критерия χ2 Пирсона. Статистически значимыми считались данные при p<0,05.
Для сравнения непараметрических признаков использовался U-тест Манна–Уитни.
Для описания количественных данных (распределение всех представленных количественных данных отличалось от нормального) использовались показатели медианы с указанием квартилей в формате (Me; [Q1;Q3]). Риск развития ПЭ, вычисленный программой Astraia, указан в формате 1:n, означающий, что ПЭ может развиться у 1 пациентки из n человек.
В расчетах применялся ROC-анализ в отношении ПИ в МА и РАРР-А с целью показать зависимость доли верно классифицированных положительных примеров от доли неверно классифицированных отрицательных примеров. Площадь под ROC-кривой обозначена как AUC.
Результаты и обсуждение
Из 2374 обследованных в 2017–2019 гг. в группу риска в отношении ПЭ вошли 209 (8,8%) пациенток, у которых вероятность заболевания составила от 1:100 до 1:4.
При анализе (табл. 2) было определено, что только у 2 (1,0%) пациенток имелся риск ранней ПЭ, риск поздней формы был у 128 (61,2%). Пациенток с риском как раннего начала заболевания, так и позднего было 79 (37,8%).
Риск ранней формы заболевания с вероятностью 1:100–1:51 отмечался у 2, однако ПЭ ни у кого не развилась.
Риск поздней формы заболевания с вероятностью 1:100–1:51 был определен у 95 (45,5%); ПЭ отмечалась у 8 (8,4%), у 1 развилась ранняя ПЭ тяжелой степени. Большая вероятность прогнозирования (1:50–1:4) поздней ПЭ отмечалась у 33 (15,8%). Из них поздняя форма заболевания была у 2.
У пациенток с комбинированным риском ранней и поздней ПЭ вероятность развития 1:100–1:51 была у 43 (20,6%); после 37 недель ПЭ развилась у 3. Риски развития более 1:50 отмечались у 36 пациенток (17,2%), в дальнейшем у 2 была ранняя ПЭ, поздняя – у 6.
Анализ прогноза выявил, что значения частоты развития ПЭ в каждой группе составили от 1:17 до 1:5.
В общей сложности умеренная ПЭ была у 17 (81,0%), тяжелая – у 4 (19,0%).
Результаты исследования свидетельствовали о том, что частота ПЭ в общей группе риска составила 10,0% (n=21); при отсутствии профилактических мероприятий ПЭ отмечалась у 4 – 11,8% (у 4 умеренная степень); при их наличии развитие заболевания происходило у 17 – 9,7% (у 13 умеренная, у 4 тяжелая степень) (p=0,72). Частота ПЭ в общей популяции достигает 5–12%.
Представляет интерес характеристика клинических показателей, определяющих наличие или отсутствие риска ПЭ в 11–14 недель гестации и ее развития в последующем при проведении и отсутствии превентивных мероприятий (табл. 1).
Все обследованные пациентки относились к европеоидной расе. Ни у одной не было выявлено сахарного диабета I и II типов, преждевременных родов ≥24 недель; у ближайших родственников не было отмечено ПЭ в анамнезе.
Среди пациенток группы высокого риска 5 (2,4%) курили табачные изделия, при этом у всех развилась ПЭ. Среди пациенток с ПЭ при низком риске ее развития курила каждая 4 пациентка.
Согласно литературным данным, как у нас в стране, так и за рубежом (ACOG – 2019 г.) возраст 36–40 лет и старше является одним из факторов риска ПЭ. По данным U.S. Preventive Services Task Force (USPSTF, 2013 г.), в возрасте ≥35 лет и наличии хотя бы одного дополнительного клинического фактора риска рекомендовано отнести пациенток в группу высокого риска в отношении данного заболевания [5].
При анализе данных пациенток (в группах высокого и низкого риска заболевания, с наличием и отсутствием ПЭ) выявлено, что возраст 36–46 лет как в общей группе риска, так и при отсутствии его наблюдался у 19,1% и 18,6% соответственно. В то же время пациентки с ПЭ в 33,3–38% случаев были старше 36 лет, независимо от наличия или отсутствия риска заболевания в 11–14 недель. Статистически значимых отличий возраста пациенток, согласившихся на профилактическую терапию и отказавшихся, не выявлено (табл. 1).
Согласно многочисленным отечественным и зарубежным данным (NICE, ACOG), важным фактором риска ПЭ является экстрагенитальная патология. Как свидетельствуют представленные в табл. 2 данные, из многочисленных видов экстрагенитальной патологии, как для внесения в группу высокого риска заболевания, так и при наличии ПЭ нарушение жирового обмена (индекс массы тела >25 кг/м2) имело важное значение. Вне зависимости от наличия или отсутствия ПЭ в группе высокого риска доля пациенток с индексом массы тела ≥25 была в 2 раза больше, чем при низком риске (p<0,001). У беременных с ПЭ и низким риском ее развития нарушение жирового обмена отмечалось у половины обследованных; в то время как при низком риске и отсутствии ПЭ – всего у 16,7% (p=0,003). Обращает на себя внимание, что нарушение жирового обмена у пациенток с ПЭ, отказавшихся от превентивных мер (100%), встречалось чаще, чем у согласившихся (35,3%) (p=0,02).
Важным заболеванием, наличие которого позволяет включить пациентку в группу высокого риска в отношении ПЭ, является ХАГ [12].
Заболеваемость ХАГ в группе высокого риска (15,8%) была в 3–4 раза выше, чем в популяции среди беременных (4–5%).
У пациенток с высоким риском не отмечено существенной разницы частоты ХАГ у пациенток с развившейся в последующем ПЭ (19,0%) и при отсутствии заболевания (15,4%) (p=0,67). Относительно низкая частота ХАГ отмечена у пациенток с низким риском заболевания как с ПЭ (5,6%), так и без нее (9,5%).
Частота ХАГ не отличалась у пациенток, согласившихся и отказавшихся от профилактических мероприятий.
В группе высокого риска заболеваемость наследственной тромбофилией была в 5 раз выше, чем в группе с низким риском и отсутствием ПЭ (p<0,001). Обращает на себя внимание, что у пациенток группы высокого риска, согласившихся на превентивные мероприятия, частота наследственной тромбофилии была относительно высокой – 32,9%. Возможно, использование низкомолекулярного гепарина способствовало тому, что ПЭ развилась только у 1 (5,9%) пациентки. Подтверждением этого является то, что у пациенток с низким риском и наличием ПЭ данная патология встречалась в 7 раз чаще (6 – 33,3%), чем в группе с высоким риском (p=0,021). По всей видимости, отсутствие профилактических мероприятий в данной ситуации способствовало прогрессированию гемодинамических нарушений и развитию ПЭ.
Беременность пациенток групп высокого риска, достигнутая путем применения вспомогательных репродуктивных технологий, встречалась почти в 2 раза чаще, чем при низком риске заболевания (табл. 1).
Таким образом, проведенный анализ клинических факторов риска указывал на то, что их разнообразие приводит как к гипердиагностике, так и к недооценке возможности развития болезни. Анализ данных свидетельствовал о том, что прогнозирование ПЭ в 11–14 недель на основании анамнеза и экстрагенитальной патологии – сложная задача, менее эффективная без дополнительных исследований.
По алгоритму NICE [4], основанному только на анамнезе и частоте экстрагенитальных заболеваний, прогнозируется менее 40% ПЭ, по алгоритму ACOG – около 67%.
В большей мере возможно предвидеть развитие ПЭ на основании инструментальных и лабораторных методов исследования.
Значения систолического АД пациенток, вошедших в группу высокого риска (Мe=87 [83;93]), не отличались от значений таковых при низком риске (Мe=83 [80;88]), вне зависимости от исхода, наличия или отсутствия проведенных профилактических мер (p=0,91) (рис. 1). При индивидуальном анализе отмечено, что патологические значения систолического АД (>110 мм рт.ст.)3 были только у 9 пациенток (4,3%); у 1 (11,1%) из них развилась умеренная ПЭ. Чувствительность и специфичность данного показателя для прогнозирования ПЭ составили 55,0% и 60,4% соответственно. Можно предположить, что полученные результаты значения систолического АД связаны с тем, что все пациентки с артериальной гипертензией получали антигипертензивную терапию, на фоне которой цифры АД имели нормальные значения.

По данным O’Gorman et al. [13], алгоритм FMF прогнозирования ПЭ, включающий дополнительное исследование белков плазмы крови и данные допплерометрии МА в I триместре, выявляет >90% ранней ПЭ и 75% ПЭ до 37 недели при ~10% доле положительных результатов.
Особую значимость приобретает исследование протеома плазмы, имеющего значение в патогенезе ПЭ: РАРР-А, PLGF.
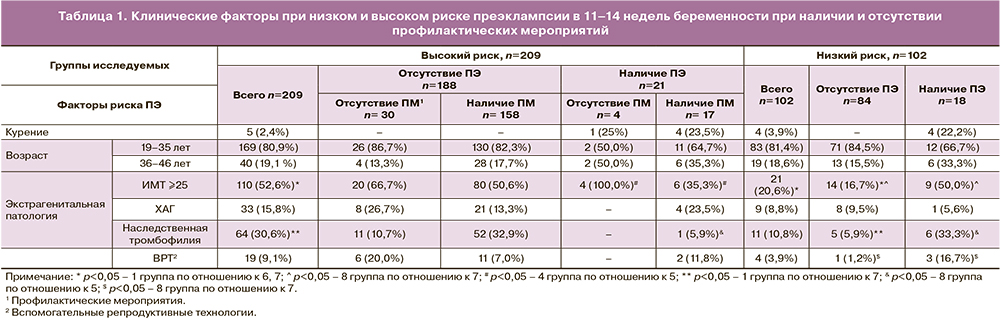
В нашем исследовании у пациенток, вошедших в группу высокого риска ПЭ, значения РАРР-А (Мe=0,910 [0,69;1,37]) не отличались от таковых при низком риске (Мe=0,896 [0,678;1,216]) (p=0,76). При индивидуальном анализе было определено, что в группе высокого риска низкие значения РАРРА-А <0,5 МоМ были лишь у 29 женщин (14,1%), в группе низкого риска – у 2 (11,1%). ПЭ развилась соответственно у 2 (6,9%) при высоком риске и у всех – при низком (рис. 2).
С целью определения диагностической значимости РАРР-А был проведен ROC-анализ (рис. 3). Площадь под кривой составила 0,430, что свидетельствовало о низкой прогностической значимости показателя: чувствительность 67%, специфичность 65%, что не отличалось от клинических данных.
 Следует отметить, что более ранние работы указывали на высокую значимость РАРР-А в прогнозировании ПЭ. Ряд исследователей [14] в своих работах показали сниженный уровень РАРР-А в 11–14 недель у беременных, у которых в III триместре развилась ПЭ различной степени тяжести. Был сделан вывод, что снижение уровня этого протеина на доклинической стадии развития ПЭ можно использовать как предиктор этого заболевания.
Следует отметить, что более ранние работы указывали на высокую значимость РАРР-А в прогнозировании ПЭ. Ряд исследователей [14] в своих работах показали сниженный уровень РАРР-А в 11–14 недель у беременных, у которых в III триместре развилась ПЭ различной степени тяжести. Был сделан вывод, что снижение уровня этого протеина на доклинической стадии развития ПЭ можно использовать как предиктор этого заболевания.
В последующем появились более сдержанные выводы о значимости этого белка для прогноза ПЭ: согласно данным K. Nicolaides [15], при использовании скрининга, основанного на данных анамне,за, экстрагенитальной патологии и ПИ в МА, выявляемость заболевания составила 68%, при добавлении в алгоритм РАРР-А показатель не изменился.
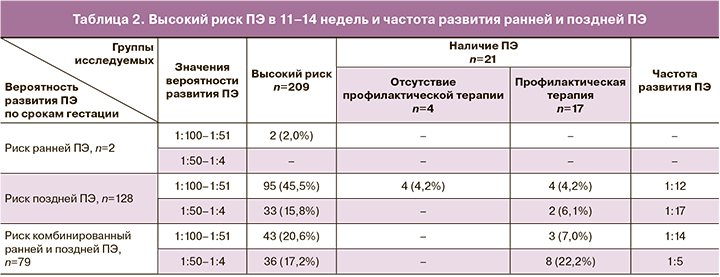
Исследование PLGF показало, что у пациенток с высоким риском (Мe=0,50 [0,3;0,72]) его значения ниже в 1,5 раза по сравнению с таковыми при низком риске (Мe=0,73 [0,572;0,972]) (p=0,81). Полученные нами данные подтверждают результаты исследования М.В. Медведева и соавт. [12] о том, что низкие показатели PLGF способствуют внесению пациенток в группу высокого риска по развитию ПЭ (рис. 4). При анализе же исходных показателей PLGF в 11–14 недель у пациенток группы высокого риска с ПЭ (Мe=0,51 [0,375;0,830]) и без (Мe=0,50 [0,298;0,720]) статистически значимых отличий не выявлено (p=0,67).
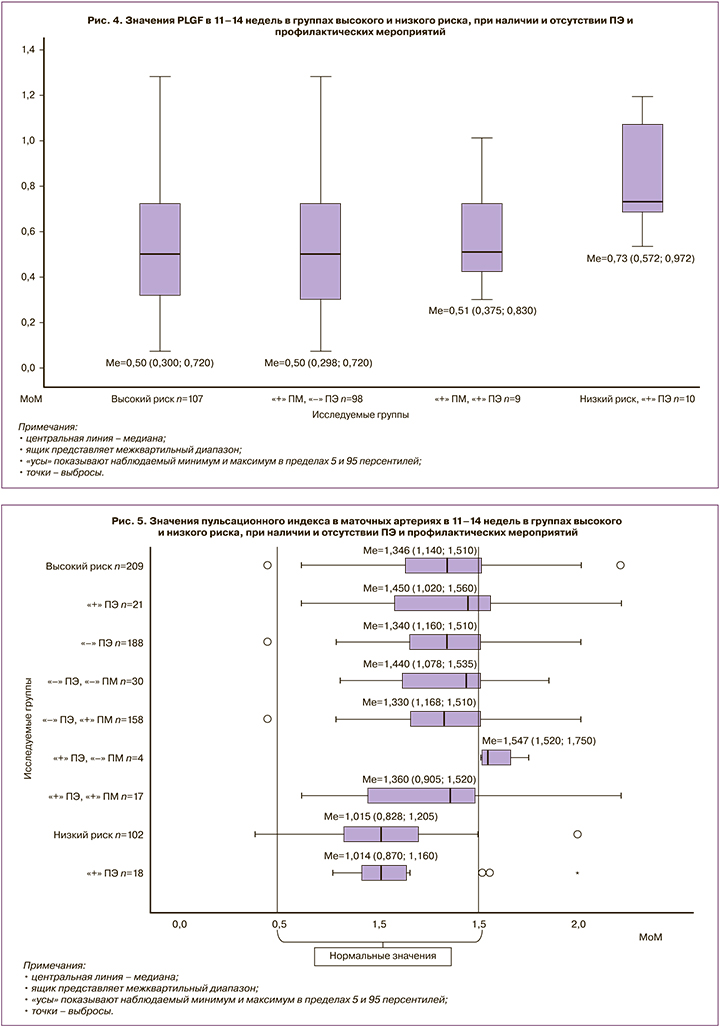
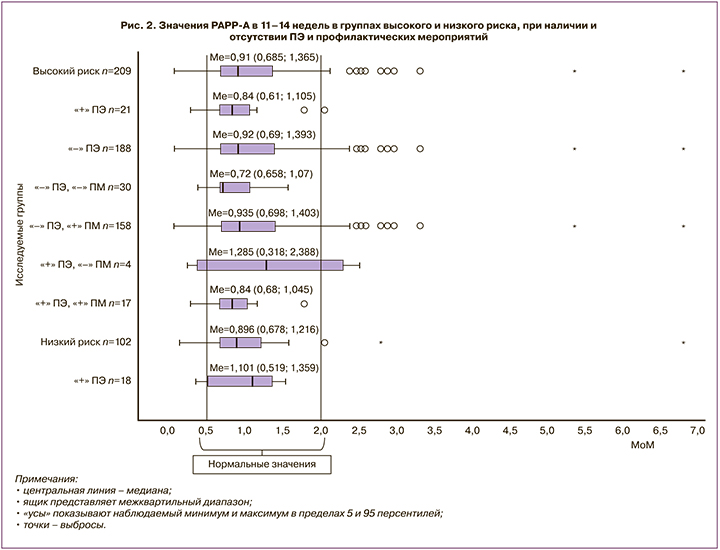
По данным L. Рооn, R. Napolitano et al. [16], численные значения ПИ в МА в I триместре гестации в группе пациенток с ранней и поздней ПЭ выше, чем у пациенток с физиологически протекающей беременностью (р<0,0001). Комбинированный скрининг ПЭ, включающий факторы риска со стороны матери и показатели допплерометрии в МА, имел более высокую чувствительность (80%) для ранней ПЭ, чем для поздней (45%), при частоте ложноположительного результата 10% [16].
Полученные нами данные свидетельствовали о том, что у пациенток с высоким риском ПЭ значения ПИ (Мe=1,346 [1,140;1,510]) были в 1,3 раза выше, чем при низком риске (Мe=1,015 [0,828;1,205]) (p=0,68), что свидетельствует об исходных нарушениях кровотока в МА, на фоне которых возможно развитие ПЭ (рис. 5).
Можно предположить, что низкие показатели ПИ в МА пациенток с низким риском ПЭ и ее развитием (Мe=1,014 [0,870;1,160]) послужили причиной внесения их в группу здоровых беременных.
У пациенток группы высокого риска с ПЭ показатели ПИ (Мe=1,450 [1,020;1,560]) статистически значимо не отличались от таковых при отсутствии заболевания (Мe=1,344 [1,160;1,510]).
При анализе ПИ отмечается значимость проведения профилактических мероприятий. У пациенток группы высокого риска с ПЭ, отказавшихся от превентивной терапии, исходные значения ПИ были самыми высокими (Мe=1,547 [1,520;1,750]). Возможно, проведение профилактических мероприятий у этих пациенток с высокими значениями ПИ могло бы предотвратить развитие ПЭ.
При определении диагностической ценности ПИ с помощью ROC-анализа было выявлено (рис. 3), что данный показатель имел среднюю прогностическую значимость (AUC=0,600, чувствительность 75%, специфичность 65%).
Следовательно, исследование показало, что при гемодинамических нарушениях в МА частота развития ПЭ составила 12,5%, что означает, что заболевание развилось у 1 пациентки из 8, тогда как при отсутствии таковых частота развития заболевания снижалась в 1,4 раза и составила 9,1% (1:11). Изменение же плазменных белков позволило выделить группу риска, в которой ПЭ развивается с вероятностью 6,7% (1:15), то есть значения ПИ в МА являлись более прогностически значимыми, чем показатели белковых маркеров.
Заключение
Таким образом, анализ литературных данных и проведенные исследования показали, что прогнозирование и профилактика ПЭ имеют важное значение. Критерии, предложенные для прогнозирования ПЭ в настоящее время, по нашим данным, не являются абсолютными и окончательно отработанными.
В силу полиморфности патогенеза и клинического течения ПЭ методы прогнозирования должны включать в себя, наряду с клиническими параметрами, комплекс показателей, отражающих начальные звенья развития заболевания: изменения формирования плаценты (РАРР-А, PLGF, sFlt-1), функцию сосудистой системы матки – в первую очередь ПИ, обладающий высокой специфичностью и чувствительностью как по литературным данным, так и по нашим исследованиям. При этом ПИ характеризует не только кровоток в матке, но и отражает параметры макрогемодинамики, в частности, жесткость сосудистой стенки, определяющую кровообращение в органе.
Методы профилактики ПЭ, несмотря на многочисленные исследования, окончательно не отработаны. По всей видимости, более целесообразен комплекс профилактической терапии с включением общегигиенических мероприятий, диеты, самоконтроля АД, лечения экстрагенитальной патологии по показаниям, персонализированного назначения лекарственных препаратов в зависимости от выявленных изменений после дополнительных исследований и оптимизации методов диагностики.



