В условиях роста количества бесплодных пар, которое составляет в мире около 9%, и значительного процента необъяснимого бесплодия среди них (от 8 до 20%) особенно важное значение приобретают развитие репродуктивной медицины и широкое применение новых технологий для повышения эффективности лечения бесплодия, включая вспомогательные репродуктивные технологии (ВРТ) [1]. Согласно данным Российской ассоциации репродукции человека, в российских центрах ВРТ за 2016 г. выполнено более 120 000 циклов ВРТ, т.е. 839 циклов на 1 млн населения [2]. При этом частота наступления беременности в программе экстракорпорального оплодотворения (ЭКО) достигала 34,8% в расчете на цикл, 38,7% – в расчете на перенос эмбрионов, а в программе переноса размороженных эмбрионов соответственно 38,5 и 40,0%.
Причины неудачных исходов в программах ВРТ, связанные с овариальной стимуляцией, качеством полученных эмбрионов, техникой переноса эмбрионов в полость матки, могут быть устранены в последующих программах ВРТ [3]. Однако приблизительно у 30% супружеских пар, получающих данное лечение, отмечаются повторные неудачи в циклах ВРТ [4]. Неудачные попытки применения ВРТ могут быть обусловлены имплантационными потерями, в частности, вследствие различной патологии эндометрия, снижения его рецептивности и неадекватного взаимодействия эмбриона с эндометрием [5, 6].
В качестве возможных причин необъяснимого бесплодия и неудач в программах ВРТ рассматриваются нарушения регуляции функционирования иммунной системы и повышенное образование аутоантител. При этом повторные неудачи в циклах ВРТ ассоциируются с присутствием аутоантител разной специфичности, таких как антитиреоидные, антифосфолипидные, антиспермальные, антиовариальные, антитела к зоне пеллюцида, антитрофобластические, антинуклеарные, антигладкомышечные, антиэндометриальные [1, 7]. Однако при исследовании влияния некоторых антител и/или общей активации иммунной системы на преимплантационный эмбрион, процесс имплантации или формирование плаценты были получены противоречивые данные.
Особо следует отметить сообщения об ассоциации антител к гонадотропным гормонам с овариальным аутоиммунитетом, эндометриозом и синдромом поликистозных яичников, приводящим к бесплодию и неудачам в программах ВРТ [8, 9]. Образование антител к гонадотропинам выявляется у женщин после применения препаратов менопаузальных гонадотропинов и человеческого хорионического гонадотропина (ХГЧ) для овариальной стимуляции и индукции овуляции. Предполагается, что антитела к гонадотропинам могут модифицировать ответ на гормональную терапию и иметь дополнительное значение в предикции исхода овариальной стимуляции [8].
Большой научный интерес представляют исследования гиперчувствительности к половым стероидным гормонам, которая может иметь кожные, респираторные и системные проявления, а также продукции поликлональных антител к стероидным гормонам у женщин с нарушениями репродуктивной функции [10–13].
Иммунологическая толерантность к стероидным гормонам может нарушаться при повышении уровня эндогенных гормонов, например, во время беременности или в лютеиновой фазе менструального цикла, а также под влиянием экзогенного воздействия гормональных препаратов, контрацептивов или эстрогенов окружающей среды [10]. Препараты прогестерона (ПГ) широко используются при бесплодии для поддержания функции желтого тела в естественных и индуцированных циклах, а также во время беременности для профилактики и лечения таких осложнений, как угрожающий выкидыш и угрожающие преждевременные роды [14, 15].
Сообщается о возникновении гиперчувствительности к ПГ у женщин после применения прогестиновых препаратов для контрацепции, лечения бесплодия и в программах ВРТ [12, 16]. С помощью кожных тестов гиперчувствительность к женским половым гормонам выявляется при предменструальном синдроме, привычном выкидыше и ассоциируется с неблагоприятными исходами беременности, ранними репродуктивными потерями и последующим вторичным бесплодием [10, 17, 18]. Применение десенсибилизирующей терапии эффективно облегчает симптомы предменструального синдрома, способствует наступлению беременности в программах ВРТ, повышает шансы успешного исхода беременности при привычном выкидыше [17, 19, 20].
Поликлональные антитела к половым стероидным гормонам и гонадотропинам найдены с помощью иммуноферментного анализа (ИФА) у женщин с предменструальным синдромом, бесплодием и привычным выкидышем [13]. У женщин с бесплодием и неудачными попытками ЭКО показана высокая частота выявления антител к гормонам не только в сыворотке крови, но и в фолликулярной жидкости [21]. Антитела к гормонам рассматриваются как возможный фактор риска неудачи в циклах ЭКО.
В связи с вышеизложенным цель исследования – изучить спектр аутоантител у женщин с бесплодием и их прогностическое значение в отношении исходов программ ВРТ.
Материалы и методы
В исследование были включены 65 женщин, обратившихся в «НМИЦ АГП им. В.И. Кулакова» Минздрава России для лечения бесплодия с применением программ ВРТ (группа 1), средний возраст женщин составлял 33,5 (3,9) года.
Критериями включения служили: нормальный кариотип супругов, возраст женщин 18–40 лет, индекс массы тела 18–29,9 кг/м2, нормальный ответ яичников на овариальную стимуляцию. Критерии исключения: наличие противопоказаний к ВРТ, патоспермия у мужчины, использование донорских гамет, суррогатное материнство, сниженный овариальный резерв, бедный ответ яичников на стимуляцию, развитие осложнений ВРТ.
Обследование женщин проводилось согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению». В программах ВРТ для стимуляции яичников и овуляции использовались препараты рекомбинантного фолликулостимулирующего гормона, комбинированный препарат фолликулостимулирующего и лютеинизирующего гормона, антагонисты гонадотропин-рилизинг-гормона и ХГЧ. Через 36 ч после введения ХГЧ в качестве триггера овуляции проводилась трансвагинальная пункция яичников.
По данным спермограммы у 26 (40%) партнеров наблюдалась нормозооспермия, у 24 (36,9%) была диагностирована тератозооспермия, у 15 (23,1%) – астенозооспермия. У 58 (89,2%) пар оплодотворение ооцитов осуществляли путем интрацитоплазматической инъекции сперматозоида в ооцит по показаниям в связи с субфертильной спермой мужа и низкой частотой оплодотворения в предыдущей программе ЭКО. Только у 7 (10,8%) пар для оплодотворения ооцитов применяли метод ЭКО.
На 5-е сутки после трансвагинальной пункции осуществлялись морфологическая оценка эмбрионов в соответствии с классификацией Gardner et al. [22] и перенос одной бластоцисты хорошего или отличного качества в полость матки. Поддержку посттрансферного периода проводили с использованием единого протокола. Наступление беременности подтверждали возрастанием уровня β-ХГЧ в сыворотке крови на 14-й день после переноса эмбриона и визуализацией плодного яйца в полости матки с помощью ультразвукового исследования на 21-й день после переноса эмбриона.
В группу сравнения (группа 2) были включены здоровые фертильные женщины (n=48), которые ранее не получали гормональных препаратов и контрацептивов, средний возраст 32,2 (3,8) года.
Иммунологические исследования включали определение с помощью ИФА спектра антифосфолипидных антител (аФЛ), антител к ламинину-1 и гормонам – к ХГЧ (аХГЧ), ПГ (аПГ), эстрадиолу (аЭ) в сыворотке (плазме) крови женщин. Исследование антител проводили перед началом овариальной стимуляции. Антитела классов M и G к кардиолипину (аКЛ), β2-гликопротеину-I (аβ2-ГП-I), фосфатидилсерину (аФС), фосфатидилэтаноламину (аФЭ), аннексину V (аАн V), комплексу фосфатидилсерин/протромбин (аФС/ПТ) и IgG-антитела к ламинину-1 определяли с использованием количественных иммуноферментных наборов (ORGENTEC Diagnostika и IBL International GmbH, Германия). Для определения антител к гормонам классов M и G применяли описанные ранее модификации ИФА, в которых использовались препараты ХГЧ, конъюгатов прогестерон 3-(O-карбокси-метил)оксим-БСА и β-эстрадиол 6-(O-карбокси-метил)оксим-БСА (Sigma-Aldrich, США) [23, 24]. Оптическую плотность (ОП) измеряли на фотометре MULTISKAN EX (Thermo Electron (Shanghai) Instrument Co., Китай).
Статистический анализ
Статистический анализ полученных данных проводили с использованием пакетов прикладных программ Microsoft Office Excel 2010 и MedCalc (v.12). Для оценки нормальности распределения значений в выборках применяли тест Колмогорова–Смирнова и W-критерий Шапиро–Уилка. При нормальном распределении количественные данные представляли как среднее арифметическое (М) и стандартное отклонение (SD) в формате М (SD), а в случае отклонения распределения от нормального – медианой (Me) с 95% доверительным интервалом (95% ДИ) и значениями 25-го и 75-го процентилей. Статистическую значимость различий частотных показателей в группах оценивали с использованием χ2-теста, непрерывных величин – с помощью U-теста Манна–Уитни. Наличие взаимосвязи между переменными определяли путем расчета коэффициента корреляции Спирмена. Для оценки диагностической значимости антител проводили ROC-анализ с построением ROC-кривой (Receiver Operating Characteristics). Различия считали статистически значимыми при уровне значимости P<0,05.
Результаты и обсуждение
Анализ клинико-анамнестических данных показал, что в исследуемой группе пациентки с вторичным бесплодием составляли большую часть – 58,5% (38 женщин), с первичным бесплодием – 27 женщин (41,3%) (P=0,05); при этом средняя длительность бесплодия составляла 6,0±3,5 года. Беременности наблюдались в анамнезе у 37 (56,9%) женщин. Обращает на себя внимание высокая частота внематочных беременностей (26,2%) и самопроизвольных выкидышей (33,8%); при этом только 15,4% беременностей завершились срочными родами. У более чем половины пациенток (56,9%) ранее были попытки ЭКО (от 1 до 8), у 43,1% женщин методы ВРТ применялись впервые. В 24,6% случаев отмечалось наступление беременности в цикле ЭКО.
Среди гинекологической патологии у женщин преобладали инфекционно-воспалительные заболевания органов малого таза (хронический сальпингооофорит (52,3%), хронический эндометрит (21,5%), полипы эндометрия (29,2%)). У части женщин были диагностированы наружный генитальный эндометриоз (20%), аденомиоз (10,8%), миома матки (12,3%) и синдром поликистозных яичников (16,9%), а также отмечались перенесенные операции на органах малого таза (тубэктомия (24,6%), миомэктомия (7,7%) или резекция эндометриоидной кисты яичников (13,8%)).
Среди соматических заболеваний наиболее часто отмечались хронические заболевания органов желудочно-кишечного тракта – у 12 (18,5%) и мочевыделительной системы – у 13 (20%) женщин, варикозное расширение вен нижних конечностей – у 17 (26,2%), аллергические заболевания – у 9 (13,8%), заболевания верхних дыхательных путей – у 9 (13,8%), эндокринной системы – у 7 (10,8%), тромбоэмболические осложнения в анамнезе, в основном в виде тромбоза вен нижних конечностей – у 3 (4,6%).
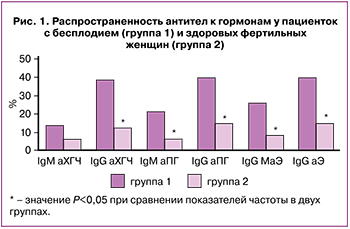 При исследовании спектра аутоантител аФЛ были обнаружены в сыворотке крови у 10 (15,4%) пациенток с бесплодием. Наиболее часто выявлялись аФЭ – у 7 (10,8%) пациенток, при этом IgM аФЭ – у 5 (7,7%), IgG аФЭм – у 2 (3,1%) пациенток. Другие аФЛ, такие как IgG аβ2-ГП-1, IgM аКЛ и IgG аФС/ПТ, обнаруживались у разных пациенток по одному случаю. Антитела к ФЭ были найдены значимо чаще аФЛ другой специфичности (P=0,03). IgG-антитела к ламинину-1 у пациенток не были обнаружены.
При исследовании спектра аутоантител аФЛ были обнаружены в сыворотке крови у 10 (15,4%) пациенток с бесплодием. Наиболее часто выявлялись аФЭ – у 7 (10,8%) пациенток, при этом IgM аФЭ – у 5 (7,7%), IgG аФЭм – у 2 (3,1%) пациенток. Другие аФЛ, такие как IgG аβ2-ГП-1, IgM аКЛ и IgG аФС/ПТ, обнаруживались у разных пациенток по одному случаю. Антитела к ФЭ были найдены значимо чаще аФЛ другой специфичности (P=0,03). IgG-антитела к ламинину-1 у пациенток не были обнаружены.
В отличие от аФЛ антитела к гормонам обнаруживались у пациенток с бесплодием с высокой частотой; при этом аХГЧ выявлялись у 31 (47,7%) пациентки, аПГ – у 33 (50,8%), аЭ – у 37 (56,9%), значимо чаще, чем аФЛ (P<0,001). У пациенток с бесплодием IgG-антитела к гормонам, IgM аПГ и аЭ обнаруживались чаще, чем у здоровых фертильных женщин (рис. 1), при этом IgG аХГЧ и аПГ выявлялись чаще, чем IgM (P=0,001; P=0,004).
Уровни антител к гормонам классов M и G были выше у пациенток с бесплодием по сравнению с фертильными женщинами (рис. 2). На рисунке 2 представлены медианные уровни антител, 95% доверительный интервал (ДИ), 25-й и 75-й процентили, минимальные и максимальные значения уровня антител в ед. ОП, значения P при сравнении двух групп.

Антитела к гормонам выявлялись у женщин как с первичным, так и c вторичным бесплодием: аХГЧ – у 14 (51,9%) и 17 (44,7%) пациенток, аПГ – у 14 (51,9%) и 19 (50%), аЭ – у 16 (59,3%) и 21 (55,3%) соответственно. При этом частота выявления антител к гормонам и их средние уровни у женщин с первичным и вторичным бесплодием не различались (P>0,05).
Частота и уровни аХГЧ у женщин с предшествующими попытками ВРТ и с первым циклом ВРТ значимо не различались. При этом у женщин с первой попыткой ВРТ медианные уровни IgG-антител к ПГ (0,317 [0,168;0,636] ед. ОП) и Э (0,424 [0,226; 0,884] ед. ОП) были выше, чем у женщин с повторными попытками ВРТ (соответственно 0,280 [0,140; 0,438] ед. ОП; 0,334 [0,200; 0,614] ед. ОП) (P=0,04; P=0,02), тогда как медианные уровни IgM-антител у этих женщин не различались.
Между уровнями IgM-антител к ПГ и Э у пациенток с бесплодием наблюдалась сильная прямая корреляционная связь (r=0,76), а между уровнями IgG-антител – прямая корреляционная связь средней силы (r=0,63) (P<0,001). Выраженной корреляционной связи между уровнями аХГЧ и антител к стероидным гормонам не было выявлено.
Результаты согласуются с полученными нами ранее данными о высокой частоте встречаемости антител к стероидным и гонадотропным гормонам у женщин с бесплодием в программах ЭКО [21]. Предполагается, что молекулы ПГ и эстрогены, имеющие малый размер, после связывания с белками тканей и плазмы крови приобретают свойства полноценных антигенов и могут вызывать развитие Th2-лимфоцитов, регулирующих синтез антител и аллергические реакции [13].
Повышенное образование антител к гормонам ассоциируется у женщин с использованием гормональных контрацептивов, а также гормональных препаратов при бесплодии для стимуляции овуляции и поддержания лютеиновой фазы. Высокие дозы гонадотропинов, применяемые для стимуляции яичников и индукции овуляции, и нефизиологические концентрации Э и ПГ в лютеиновой фазе индуцированного цикла, превышающие в 5–10 раз их уровень в спонтанном менструальном цикле, могут способствовать образованию антител к гормонам [8]. Предполагается, что превышение физиологического уровня гормонов выше критического значения может вызывать стимуляцию аутоиммунных реакций. При этом сами эстрогены способны оказывать стимулирующее действие на иммунную систему и усиливать гуморальный иммунный ответ [25].
Образованию антител у женщин, по-видимому, могут способствовать предшествующие медицинские аборты и самопроизвольные репродуктивные потери, которые сопровождаются резкими изменениями гормонального и иммунного статуса. Предполагается, что повышенный иммунный ответ на ПГ может нарушить физиологическую функцию гормона и вследствие этого привести к нарушениям лютеиновой фазы, имплантации и физиологического течения беременности. Эта гипотеза подтверждается данными о высоком риске развития дисменореи и гипоплазии эндометрия у женщин с привычным невынашиванием и повышенным уровнем аПГ [26].
Следует отметить, что у пациенток с бесплодием выявлен достаточно широкий спектр факторов риска образования антител к гормонам, к которым, кроме применения гормональных контрацептивов и гормональных препаратов, могут быть отнесены инфекционно-воспалительные заболевания органов малого таза, эндометриоз и синдром поликистозных яичников, оперативные вмешательства в малом тазу, а также внематочные беременности, самопроизвольные выкидыши, медицинские аборты, аллергические и аутоиммунные заболевания, частые инфекционные заболевания и носительство возбудителей вирусных инфекций.
У 20 (30,8%) пациенток в программе ВРТ наступила беременность. Частота наступления беременности у женщин, серопозитивных на IgM аПГ и аЭ (1 (7,1%) и 1 (6,3%)), была значимо ниже, чем у серонегативных женщин (19 (37,3%) и 19 (38,8%)) (P=0,03; P=0,02). У пациенток с отрицательным исходом в цикле ВРТ выявлялись более высокие уровни аПГ и аЭ класса M по сравнению с женщинами с положительным исходом, у которых беременность наступила (P<0,05) (рис. 4). Эти результаты согласуются с полученными ранее данными о высокой частоте встречаемости антител к гормонам у женщин с неэффективными попытками ЭКО в прошлом и высокой частоте неблагоприятных исходов в цикле ЭКО у серопозитивных женщин [21].
Ранее у женщин, серопозитивных на аХГЧ, была показана низкая частота наступления беременности в программах ЭКО, сравнимая с частотой, наблюдаемой у пациенток с аФЛ или антитрофобластическими антителами, и необходимость определения аХГЧ перед процедурой ЭКО [27]. Недавно опубликовано сообщение об эффективности применения комбинированной терапии, включающей мембранный плазмаферез, глюкокортикоиды и внутривенные иммуноглобулины, для ведения пациенток с повторными неудачами в программах ЭКО, серопозитивных на аХГЧ [28].
По данным ROC-анализа, определение IgM-аПГ и аЭ характеризовалось наиболее высокими значениями чувствительности, специфичности, площади под кривой (AUC), положительной прогностической значимости (таблица), точность тестов составляла 67,7 и 69,2% соответственно.
 Построенные ROC-кривые позволяли дифференцировать женщин по исходам в цикле ВРТ на основе определения уровня антител класса M к ПГ и Э перед началом стимуляции яичников (рис. 5). При этом по значениям AUC качество модели соответствовало среднему. Следует отметить, что в подгруппе пациенток с первой попыткой ВРТ значения AUC для IgM аПГ и аЭ составляли соответственно 0,722 [0,522; 0,874] и 0,725 [0,525; 0,875] (P=0,03; P=0,03), а качество модели соответствовало хорошему. Точность теста при одновременном определении данных антител достигала 71,4%. По-видимому, IgM аПГ и аЭ представляют факторы риска неблагоприятного исхода в программах ВРТ у женщин с бесплодием, а их определение может быть использовано для прогнозирования исходов программ ВРТ, в том числе у женщин с первой попыткой.
Построенные ROC-кривые позволяли дифференцировать женщин по исходам в цикле ВРТ на основе определения уровня антител класса M к ПГ и Э перед началом стимуляции яичников (рис. 5). При этом по значениям AUC качество модели соответствовало среднему. Следует отметить, что в подгруппе пациенток с первой попыткой ВРТ значения AUC для IgM аПГ и аЭ составляли соответственно 0,722 [0,522; 0,874] и 0,725 [0,525; 0,875] (P=0,03; P=0,03), а качество модели соответствовало хорошему. Точность теста при одновременном определении данных антител достигала 71,4%. По-видимому, IgM аПГ и аЭ представляют факторы риска неблагоприятного исхода в программах ВРТ у женщин с бесплодием, а их определение может быть использовано для прогнозирования исходов программ ВРТ, в том числе у женщин с первой попыткой.
Наличие антител к гормонам класса M может быть проявлением сенсибилизации женщин к этим гормонам, которая часто выявляется у пациенток с бесплодием и привычным выкидышем с помощью кожных тестов. При этом, хотя большинство кожных реакций опосредуются IgE, предполагается образование поликлональных антител разных изотипов, как и в случае большинства аутоиммунных состояний [13]. Отмечается, что проведение десенсибилизации уменьшает клинические проявления, улучшает исходы в программах ВРТ и течение беременности [17, 20]. Описаны протоколы десенсибилизации с интравагинальным, внутримышечным и пероральным введением прогестагенов [19].
Как известно, продукция ПГ запускает морфологические и физиологические изменения в эндометрии, обеспечивая рецептивность эндометрия и подходящее окружение эмбриона в период имплантации, которая начинается с репозиции и фиксации бластоцисты [29]. Важно отметить, что именно под влиянием стероидных гормонов обеспечивается восприимчивость эндометрия в период «окна имплантации». При этом ПГ играет ключевую роль в этом процессе, блокируя пролиферативное действие эстрогена на эпителиальные клетки матки, а также индуцируя гены, обеспечивающие нормальный ответ рефрактерного эндометрия и прикрепление эмбриона. ПГ обеспечивает децидуализацию эндометрия для нормальной имплантации эмбриона, содействует инвазии вневорсинчатого трофобласта в децидуальную ткань путем ингибирования его апоптоза; действует как регулятор инвазии трофобласта, контролируя активность матриксных металлопротеиназ [30].
В связи с важным значением стероидных гормонов в период имплантации можно предположить, что антитела, способные связываться с данными гормонами, могут помешать осуществлению их физиологической функции и, как следствие, привести к нарушению рецептивности эндометрия и имплантации. Эта гипотеза подтверждается более низкой частотой наступления беременности у серопозитивных женщин. Показано, что течение беременности у пациенток с привычным выкидышем и повышенным уровнем аПГ часто осложняется гипоплазией хориона и плацентарной недостаточностью [26]. По мнению В.М. Сидельниковой, механизм прерывания беременности при наличии аПГ может быть связан с формированием неполноценной первой волны инвазии трофобласта, что клинически проявляется гипоплазией хориона в сроках 5–6 недель беременности [14].
Необходимы дальнейшие исследования для оценки патогенетического значения антител к гормонам, оптимизации тактики подготовки серопозитивных женщин к программам ВРТ и повышения их эффективности на основе снижения активности аутоиммунного процесса.
Заключение
Таким образом, у пациенток с бесплодием, получающих лечение с применением ВРТ, отмечается широкий спектр аутоантител, включающий антитела к гонадотропным и стероидным гормонам, и более высокая частота выявления антител, чем у фертильных женщин. При этом у пациенток, позитивных на IgM аПГ и аЭ, наблюдается более низкая частота имплантации и клинической беременности, а при неудачных попытках ВРТ выявляется более высокий уровень данных антител. По-видимому, антитела к стероидным гормонам являются факторами риска неудачных исходов ВРТ, выявление повышенного уровня антител у женщин перед стимуляцией яичников имеет значение для прогнозирования исходов программ ВРТ и выбора тактики подготовки и ведения женщин с учетом активности аутоиммунного процесса.



