Артериальная гипертензия беременных (АГБ) является формой повышенного артериального давления при беременности. АГБ также носит название преэклампсии. Это наиболее распространенное медицинское состояние, встречающееся в течение беременности у 9,4–10,4% беременных. АГБ наиболее часто фиксируется у молодых женщин во время первой беременности. У будущих матерей с гипертензией выше предрасположенность к осложнениям, среди которых наиболее часто встречается отслойка плаценты, диссеминированное внутрисосудистое свертывание, внутримозговое кровоизлияние, печеночная недостаточность, острая почечная недостаточность. Эти потенциально неблагоприятные воздействия ставят под угрозу здоровье матери и плода [1]. АГБ – патология беременности, характеризующаяся гипертензией и протеинурией после 20-й недели беременности, которая определяется наличием систолического артериального давления выше 140 мм рт. ст. или диастолическим давлением выше 90 мм рт. ст. Основным патологическим изменением при АГБ является систематический спазм малых артерий и такие клинические проявления, как гипертензия, отеки, протеинурия. Национальная Образовательная Программа по Высокому Артериальному Давлению от NHLBI подразделяет гипертонические расстройства на следующие категории: хроническая гипертензия, гипертензия беременных, преэклампсия-эклампсия и преэклампсия на фоне хронической гипертензии.[2]. Хотя врачи на протяжении многих лет диагностировали АГБ, они крайне мало знали о ее патогенезе и профилактике [3]. Общепринятой является точка зрения, что АГБ развивается под влиянием нескольких факторов. В последние годы, с развитием молекулярной биологии в акушерстве сделаны большие шаги в изучении этиологии АГБ.
Ранние исследования показали, что к факторам, от которых зависит риск возникновения АГБ, относятся возраст беременной, психологическое состояние во время беременности, семейная история гипертонии, уровень доходов, вес, количество беременностей [4–6]. Знание наиболее весомых факторов риска может быть полезным для определения пациентов, у которых могут развиться гипертонические расстройства. К тому же, адекватный дородовый уход способствует снижению уровня смертности. Патофизиология АГБ до конца не ясна. Многие специалисты полагают, что плацента играет центральную роль в патогенезе АГБ, главным образом, преэклампсии, поскольку извлечение плаценты является единственным надежным способом излечения заболевания [2, 7]. Таким образом, многие исследователи сосредотачиваются на изменениях в материнских кровеносных сосудах, которые доставляют кровь к плаценте [2]. Плацента подвергается значительной васкуляризации для обеспечения кровообращения между матерью и плодом при нормальном протекании беременности. Васкуляризация плаценты включает в себя образование сосудов, их развитие и ремоделирование материнских спиральных артерий [8]. Для этого процесса необходим тонкий баланс ангиогенных и антиангиогенных факторов. Нарушение баланса ангиогенных и антиангиогенных факторов при АГБ, в частности, при преэклампсии, возможно, является причиной ненормальной васкуляризации плаценты и развития заболевания. В большинстве случаев ангиогенные процессы инициируются факторами роста: сосудисто-эндотелиальный фактор роста (VEGF), фактор роста фибробластов (FGFb) и плацентарный фактор роста (PlGF). PlGF синтезируется, главным образом, в плаценте и потенциально обладает ангиогенным эффектом. При нормально протекающей беременности уровень PlGF растет до 32 недели, с последующим спадом. При беременности, отягощенной преэклампсией, вне зависимости от наличия внутриутробной задержки развития плода, уровень PlGF значительно ниже [9, 10].
Исследователи, изучающие патогенез АГБ, сосредоточены на нарушении баланса ангиогенных и антиангиогенных факторов. У больных с преэклампсией уровень растворимой FMS-подобной тирозинкиназы-1(sFlt-1), которая связывает VEGF и PlGF, растет; это приводит к уменьшению концентрации биоактивных форм этих факторов роста. Это изменение гомеостаза приводит к плацентарной и системной эндотелиальной дисфункциям, что индуцирует появление клинических симптомов заболевания. Оценка уровня sFLt-1, PlGF и других ангиогенных факторов в материнской перифирической крови для предсказания развития и диагностики преэклампсии была целью исследований в последние годы [11–13]. К сожалению, все еще получено мало информации об уровнях факторов роста при других формах гипертонии при беременности или их предсказательных возможностях [14–17]. Кроме того, ряд соединений, таких как интерлейкины 8, 10 [18, 19], фактор некроза опухоли (TNF) [20, 21], факторы перекисного окисления липидов [22], sFlt-1 [23] и продукты деградации фибронектина, связаны с АГБ [24].
Хотя основные причины АГБ еще не известны, наиболее обоснованная гипотеза утверждает возникновение плацентарной ишемии/гипоксии из-за неполного ремоделирования спиральных артерий в маточно-плацентарные сосуды, что приводит к ухудшению кровотока в плаценте. Плацентарная ишемия приводит к высвобождению sFlt-1, ангиотензина II-1 рецептора антител (AT1-AA), TNF-α и интерлейкина 6, которые вызывают эндотелиальную дисфункцию, характеризующуюся возрастанием уровней эндотелина (ET), активных форм кислорода и ростом восприимчивости сосудов к ангиотензину II. Семейство эндотелинов (ET-1, ET-2, and ET-3) включает в себя три изоформы соединения, каждое из которых состоит из 21 аминокислоты. ET-1 наиболее распространенный член семейства [24]. ET-1 принимает участие в развитии гипертонии при преэклампсии. За последние годы была выяснена роль соединения в индуцировании окислительного стресса и стресса эндоплазматического ретикулума при преэклампсии; каждый из этих процессов вносит вклад в многие клинические проявления заболевания. В плазме крови здоровых беременных женщин концентрация ET-1 лежит в диапазоне 5–10 пг/мл, в то время как в крови беременных с преэклампсией концентрация вырастает до 20–50 пг/мл [25]. Сильное сосудорасширяющее соединение NO, синтезирующееся в присутствии L-аргинина окисляется одной из трех изоформ NO-синтазы, кодируемой как минимум тремя различными генами. Эндотелиальная NOS (eNOS) изоформа является основным участником сосудистой гемодинамической регуляции [26]. Сообщалось о том, что синтез NO определяется множественными посттрансляционными модификациями. При преэклампсии системное сосудистое сопротивление значительно увеличивается, что приводит к нарушению маточно-плацентарной перфузии и росту артериального давления. Данные об экспрессии eNOS в плаценте при преэклампсии противоречивы. В то время как некоторые ученые говорят о снижении уровня экспрессии [27–29], другие не регистрируют изменений [30] или даже говорят о повышении уровня фермента [31]. Непрямым доказательством значительной роли NO является благотворный эффект приема L-аргинина женщинами с преэклампсией, что проявилось в благополучном родоразрешении женщин из группы, где осуществлялось лечение. Это может быть связано с увеличением синтеза NO из-за увеличения количества субстрата [32]. Эти исследования показывают, что исследование метаболитов может позволить построить эффективную стратегию для изучения метаболических факторов риска, связанных с АГБ. Однако, многие из метаболитов связаны с метаболизмом крупных молекул, таких как пептиды или протеины, немногие из них были связаны с непептидными малыми молекулами, которые были дифференцировано метаболизированы в плаценте женщин с АГБ. Мы применили методы метаболомики для исследования непептидных молекул-метаболитов, дифференцированных АГБ, что и явилось целью данного исследования.
Материалы и методы
Образцы: Было отобрано 29 плацент, из которых 14 были от женщин с АГБ и 15 – с нормальным течением беременности. В соответствии с национальным этическим регулированием было получено информированное согласие беременных. Проект исследования был согласован с госпитальным комитетом по этике. Для исследования связи уровня кровяного давления с АГБ, пациенты с АГБ были разделены на три подгруппы в зависимости от уровня кровяного давления с требуемым уровнем статистической значимости различий p<0,01. АГБ1 представляет группу пациентов с незначительным повышением артериального давления в диапазоне 140–159/95–100 мм рт ст., АГБ2 представляет группу пациентов с умеренным повышением артериального давления в диапазоне 160–179/105–125 мм рт ст., АГБ3 представляет группу пациентов с сильным повышением артериального давления выше 180/100 мм рт ст. Подробная информация о плацентах, полученная от пациентов с АГБ и здоровых родильниц с нормальным артериальным давлением приведена в таблице 1.

2) Процедура сбора образцов: непосредственно сразу после получения плаценты ткань промывалась холодной дистиллированной водой для удаления крови с поверхности плаценты, на расстоянии 2 см от края плаценты вырезался образец ткани размером 1×1 cм2, погруженный в плацентарную мембрану и помещался в жидкий азот не менее, чем на 30 минут. После заморозки образец можно хранить при -80°C до использования.
3) Экстракция непептидных малых молекул: 150 мг ткани плаценты, замороженной в жидком азоте гомогенизировали, затем добавляли 0,6 мл метанола при 4°C в и перемещали в пробирку Эппендорф (EP). Пробирку центрифугировали при 4°C в течение 15 минут с ускорением 3000 g. Верхний слой переносился в новую EP пробирку для лиофилизации.
4) ВЭЖХ-МС анализ (высокоэффективная жидкостная хроматография-масс спектрометрия): лиофилизированный экстракт перерастворяется в 100 мкл смеси вода/ацетонитрил 95/5, взбалтывается и центрифугируется 15 минут с ускорением 13000 g. Надосадочную жидкость переносят в 2 миллилитровую хроматографическую виалу с винтовой крышкой и помещают в автоматический пробоотборник при 4°C. 15мкл каждого образца анализируются на ВЭЖХ-системе (UltiMate3000, DIONEX), соединенной с microTOF-Q II масс-спектрометром (https://www.bruker.com, Bruker, Germany). Хроматографическое разделение производилось на ВЭЖХ колонке С18 Agilent 3,5 мкм с потоком 0,25 мл/мин. В колонку вводилось 15 мкл образца. Центроидные и точные данные масс-спектра регистрировались в диапазоне 50–1000 m/z в режиме положительных ионов с периодом сканирования 0,2 с.
5) Идентификация соединений.
Идентификация малых молекул-биомаркеров проводилось с использованием жидкостной тандемной хромато-масс спектрометрии (ВЭЖХ-МС/МС) при помощи квадруполь-время-пролетного масс-спектрометра (micrOTOF-Q II, Bruker, USA). Среднее значение m/z и время удерживания каждого биомаркера, определялись с использованием XCMS – анализа (платформы с интуитивным графическим интерфейсом, которая позволяет легко загружать и обрабатывать ЖХ/МС данные для нецелевого метаболомного профилирования https://xcmsonline.scripps.edu) с энергией фрагментации в 10эВ, 20эВ и 40эВ. Для анализа спектров фрагментации использовали Bruker Compass DataAnalysis 4.0 на основе целевого МС/МС анализа и алгоритмов генерации соединений. Результат сравнивали с базой данных МС/МС METLIN (METabolite LINk, http://metlin.scripps.edu) [33].
5) Обработка и анализ данных: файлы формата .raw, полученные в ходе ВЭЖХ – МС анализа конвертировались в NetCDF формат с использованием программы конвертирования данных, входящей в пакет Data analysis software (Bruker). Обработка и деконволюция данных проводилась с использованием XCMS пакета, запущенного на языке R 2.6.0. На основе попарного сравнения данных были построены смешанные линейные модели с использованием статистического языка R v 2.60, реализованного в пакете R NLME. Внутрипарные корреляции рассматривались как погрешности модели. Межгрупповые различия оценивались на основе F-критерия Фишера. Множественная проверка гипотезы проводилась с использованием функций пакета R multicomp.
Результаты
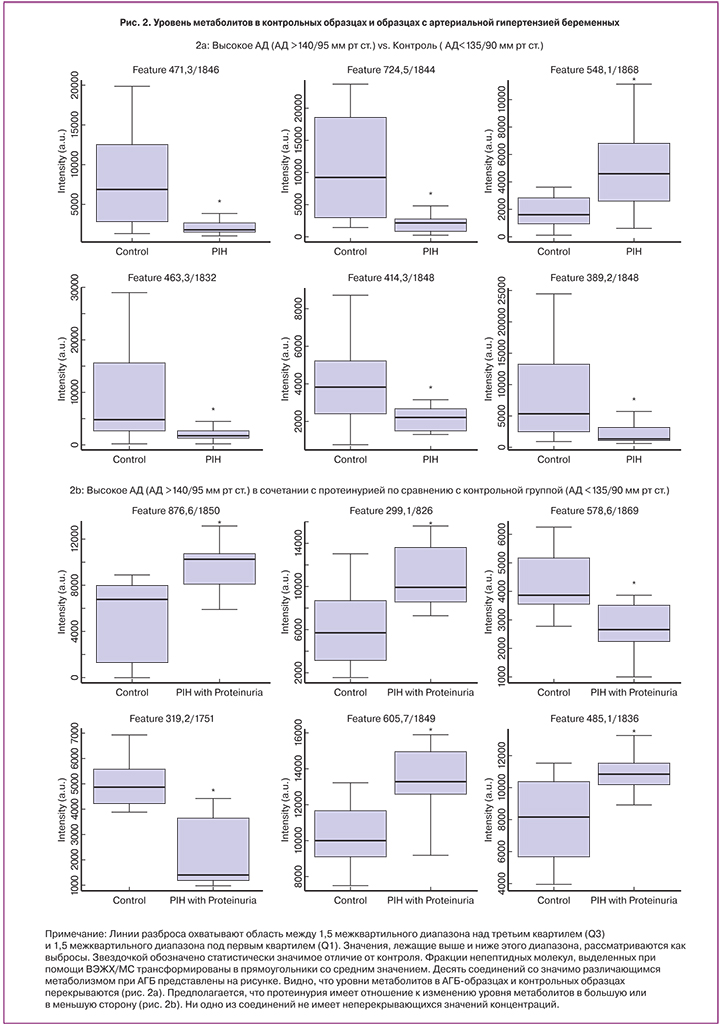
Пятьсот тридцать семь соединений, определенных по изоэлектрической точке (ИТ) и молекулярной массе (ММ), были обнаружены и подтвердили наличие статистической разницы уровней в плаценте больных и в плаценте женщин контрольной группы с вероятностью неразличимости групп p<0,05 (рис. 1). 84 соединения были определены как общие для групп АГБ1, АГБ2, АГБ3, 10 соединений являются общими только для групп АГБ1 и АГБ2, 123 являются общими только для групп АГБ2 и АГБ3, 6 общими для групп АГБ1 и АГБ3. Уникальными для АГБ1 являются 150 соединений, для АГБ2 — 50 соединений, для АГБ3 – 114 соединений. При АГБ1, по сравнению с контрольной группой уровень 113 соединений достоверно снижен, 37 – достоверно повышен; при АГБ2 значимое понижение уровня наблюдается для 259 соединений, значимое повышение – для 8 соединений; в группе АГБ3 – значимое понижение для 311 соединений, значимое повышение – для 16 соединений. Для поиска дифференциально метаболизируемых соединений было проанализировано две группы с АГБ против группы контроля. Как показано на рисунке 2, 10 соединений со статистически значимым различием (p<0,05) были найдены по заданным параметрам. Уровни малых молекул, идентифицированных при помощи ВЭЖХ-МС, не имеют значимых различий в группах АГБ и контроля (рис. 2а), что не удовлетворяет нашим критериям использования их, как биомаркеров АГБ. Аналогичные результаты были при сравнении образцов от пациентов с протеинурией с группой контроля (рис. 2b, рис. 3).
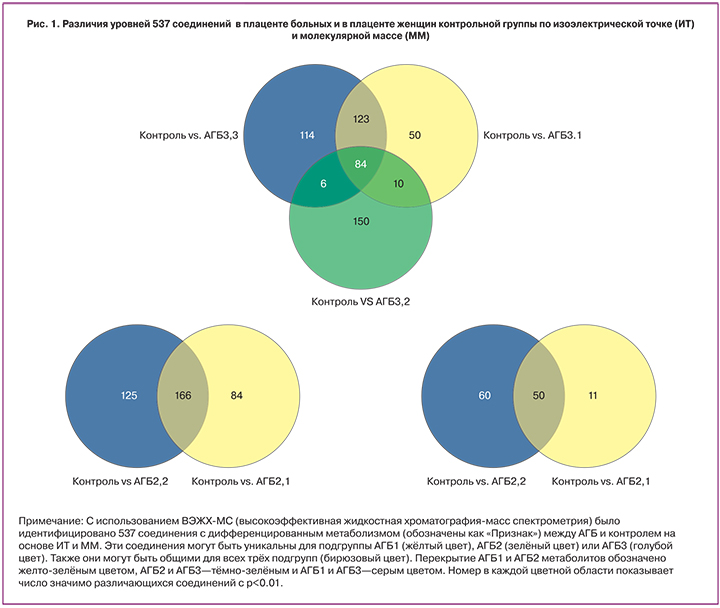
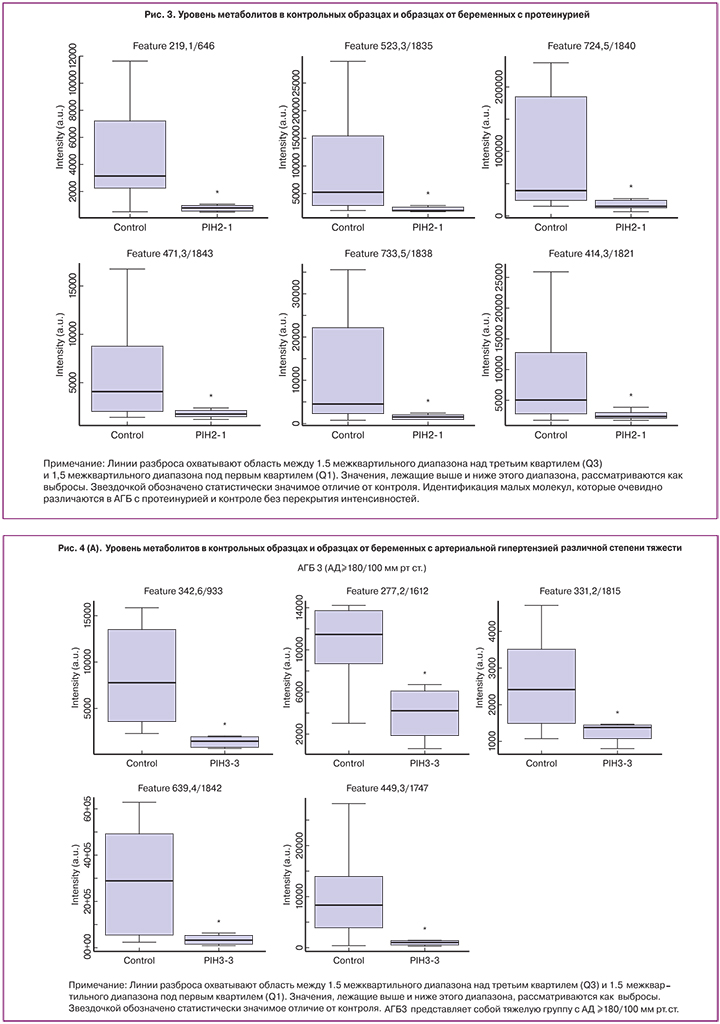
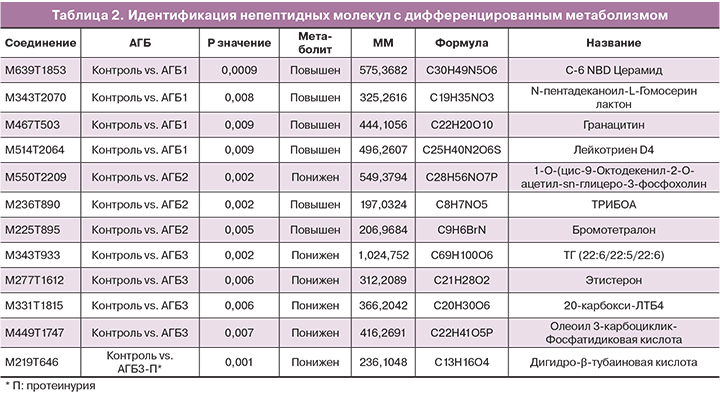
Как показано на рисунке 4, при выборе более строгого условия p<0,01 и деления группы АГБ на три подгруппы для анализа, стало возможным деление непептидных соединений между АГБ и контрольной группой без перекрытия. 12 соединений были дополнительно исследованы для идентификации их элементного состава и структуры. Идентификация была проведена успешно для 6 соединений, чей уровень возрастал в образцах АГБ. К ним относятся C-6 NBD Церамид, N-пентадеканоил-L-гомосерин лактон, Гранатицин и Лейкотриен D4 в АГБ1 и Бромотетралон в АГБ2 (табл. 2). Также были идентифицированы 6 соединений, чей уровень снижался в образцах с АГБ, одно из АГБ2 и 5 из АГБ3.
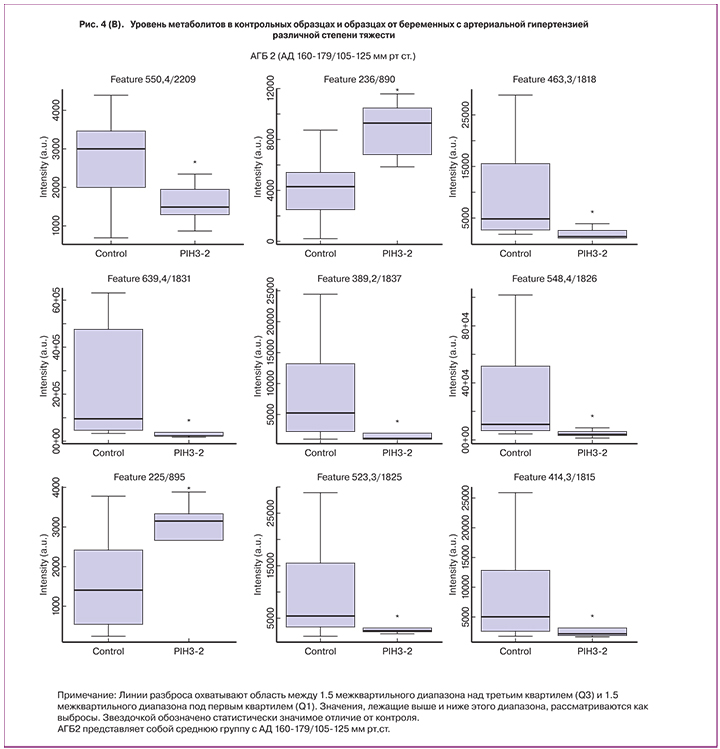
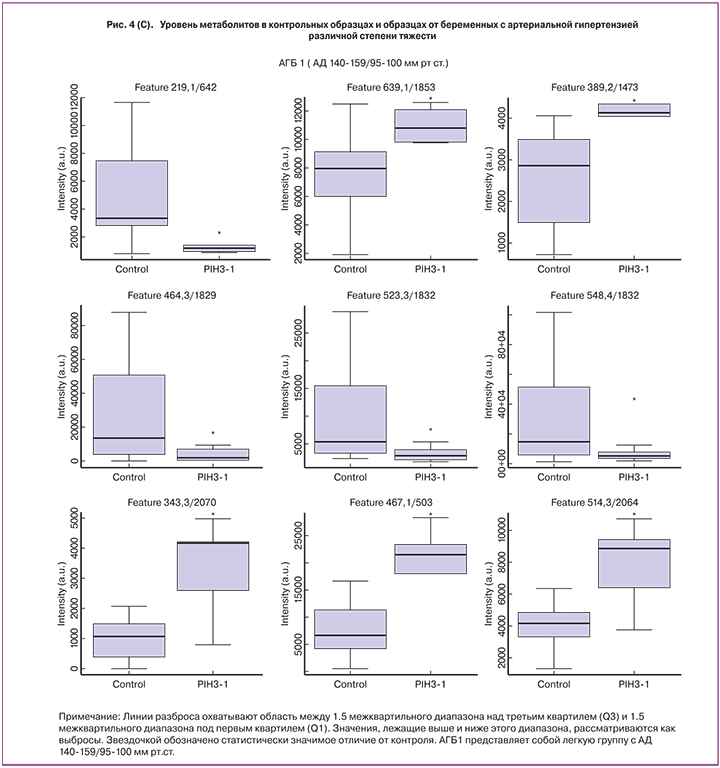
Обсуждение результатов
Метаболомика занимается исследованием химических процессов с участием метаболитов и представлена совокупностью всех метаболитов биологической клетки, ткани, органа или организма, которые являются конечным продуктом клеточных процессов [34, 35]. Биомаркеры относятся к биологическим характеристикам, которые поддаются объективному измерению и оцениванию, как индикаторы нормальных или патологических биологических процессов, а также фармакологических откликов на терапевтическое вмешательство. Биомаркеры широко используются в клинической практике для диагностики, оценки тяжести состояния и отклика на лечение для ряда заболеваний. В исследованиях с участием пациентов, метаболомика применялась для определения биомаркеров для диагностики или предсказания развития заболевания, а также оценки эффективности/токсичности препарата, с целью использования для изучения патофизиологии заболевания или терапевтической применимости лекарства [36]. В случае АГБ метаболические методы являются потенциально полезным инструментом для скрининга, особенно для диагностики преэклампсии. Например, благодаря газовой хромато-масс-спектрометрии высокого разрешения с использованием квадруполь-время-пролетного масс-спектрометра на основе 87 образцов плазмы крови женщин с преэклампсией и 87 образцов плазмы крови контрольной группы Kenny L et al. разработали метаболическую модель для различения преэклампсии от нормально протекающей беременности по трем метаболитам с чувствительностью 100% и специфичностью 98% [37]. Также, используя высокоэффективную жидкостную хромато-масс спектрометрию, они сравнили 60 образцов плазмы крови женщин с преэклампсией на поздней стадии беременности и 60 образцов плазмы крови из контрольной группы и обнаружили 14 наиболее часто встречающихся метаболитов и подтвердили их связь с преэклампсией [38]. Аналогично, Xuemei Lou et al. сравнили 51 женщину с тяжелой преэклампсией с 45 женщинами с нормально протекающей беременностью с использованием высокоэффективной жидкостной тандемной масс-спектрометрии на 3200 Q-trap, и обнаружили 16 биомаркеров, которые лучше описывают метаболомные особенности преэклампсии тяжелой степени [39]. Эти исследования показывают перспективность метаболомных методов, как инструмента для скрининга преэклампсии и могут стать в будущем основным методом мониторинга преэклампсии на основе целевых биохимических маркеров.
Церамиды являются важным биоактивным малым молекулярным соединением. Церамиды оказывают влияние на сигнальный путь Akt/eNOS [40–41]. В Akt/eNOS сигнальном пути церамиды контролируют функции эндотелиальных клеток. Эндотелиальные клетки играют важную роль в формировании иммунитета, их дисфункция из-за патологии клеток может привести к преждевременным родам. Кроме того, церамиды управляют процессами лизосомной аутофагии и апоптоза [42–43]. Программируемый апоптоз и аутофагия играют важную роль в случае преждевременных родов. Исследования на животных показали, что церамиды могут влиять на сократительную способность матки беременных крыс [44]. Доказана релевантность фосфохолина к ангиотензину [45]. Ангиотензин играет важную роль в развитии АГБ. Исследования показали, что фосфохолин-трансфераза играет важную роль в патологическом действии С-реактивного белка при преэклампсии посредством активации рецептора нейрокинина 3 и является плаценто-специфичным ферментом посттрансляционно модифицирующим нейрокинин B [46].
Заключение
Таким образом, мы применили метаболомный подход к изучению малых непептидных молекул, которые отличаются в АГБ и контрольных образцах. Насколько нам известно, это первый отчет о непептидных молекулах, которые дифференциально метаболизируются при АГБ. Доказана перспективность дальнейшего целевого исследования соединений, характерных для АГБ и возможность использования метаболомного профиля для скрининга АГБ. Это сделает возможным диагностику АГБ и преэклампсии по непептидным биомаркерам.



