При наличии различных видов патозооспермии (олигозооспермии (ОЗС), астенозооспермии (АЗС), тератозооспермии (ТЗС)) у мужчин увеличивается риск анеуплоидии хромосом у полученных эмбрионов вследствие анеуплоидии хромосом сперматозоидов [1–4]. Следствием этого является более низкая частота наступления беременности и более высокая частота самопроизвольных выкидышей по сравнению с парами, в которых у мужчин отмечаются нормальные параметры спермограммы [5]. Также повышенный уровень анеуплоидии хромосом сперматозоидов увеличивает риск развития хромосомной патологии у детей [6].
Благодаря внедрению в клиническую практику преимплантационного генетического скрининга (ПГС) при проведении ЭКО появилась возможность диагностики генетических нарушений будущего ребенка до переноса эмбриона в полость матки.
Материал для проведения генетического исследования получают путем биопсии бластомеров 3-дневного эмбриона [7], аспирации первого и второго полярного тельца оплодотворенных ооцитов [8] или биопсии клеток трофоэктодермы бластоцисты [9].
Методы, позволяющие провести генетическое исследование на эмбриональном этапе, включают молекулярно-цитогенетический метод – флюоресцентную in situ гибридизацию (FISH-метод) и сравнительную геномную гибридизацию. В клинической практике в большей степени накоплены данные о применении FISH-диагностики для ПГС [10].

FISH-метод позволяет определять анеуплоидии ограниченного числа хромосом, с которыми связаны наиболее часто встречающиеся врожденные заболевания (хромосомы 13, 15, 16, 17, 18, 21, 22, X и Y), а также обладает недостаточно высокой чувствительностью за счет возможного мозаицизма исследуемых эмбрионов [11]. В этом случае, несмотря на проведение ПГС, существует вероятность переноса в полость матки анеуплоидных эмбрионов. Кроме того, за счет недостаточно высокой специфичности и, соответственно, относительно высокого уровня ложноположительных результатов возможна выбраковка нормальных эуплоидных эмбрионов, что снижает число эмбрионов, годных для переноса [11]. Вследствие низкой точности ПГС методом FISH в ряде стран женщинам группы риска по анеуплоидии у потомства рекомендуется пренатальная диагностика путем амниоцентеза или биопсии хориона, несмотря на проведение ПГС. И наконец, ПГС является дорогостоящей процедурой, которая увеличивает стоимость ЭКО в среднем на 80 000 рублей.
В настоящее время данные по эффективности ПГС противоречивы. Согласно данным Кохрановского систематического обзора, нет убедительных доказательств в пользу эффективности ПГС для увеличения уровня живорождения [12]. Данные по применению ПГС у мужчин с нарушениями сперматогенеза также противоречивы [13, 14].
В связи с этим мы провели исследование, целью которого было сравнение клинико-экономической эффективности ЭКО с последующей пренатальной генетической диагностикой и ЭКО с ПГС методом FISH для предотвращения рождения детей с анеуплоидиями у пар с различными видами патозооспермии у мужчин.
Материал и методы исследования
Авторами была создана модель принятия решений (TreeAge Pro Inc), в которой было проведено сравнение 2 стратегий: рутинного ЭКО и ЭКО с ПГС методом FISH у бесплодных пар с патозооспермией у мужчин для определения минимальной стоимости одного живорождения на одного пациента, проходящего вышеуказанное лечение бесплодия. Модель была создана таким образом, что в каждом цикле каждой бесплодной пары могли возникнуть следующие возможные ситуации: (1) было получено достаточно эмбрионов для переноса и эмбрионов для криоконсервации; (2) было получено достаточно эмбрионов для переноса; (3) не было подходящих эмбрионов для переноса. Допущением модели была возможность применения одного цикла ЭКО со свежими эмбрионами и одного цикла ЭКО с размороженными эмбрионами для достижения живорождения в случае, если в предыдущем цикле беременность не возникла, или произошел самопроизвольный выкидыш (с/в), или было произведено искусственное прерывание беременности по причине анеуплоидии у плода. Также допущением модели было, что в циклах ЭКО/ПГС не проводилась криоконсервация эмбрионов.

Данные по вероятности наступления беременности, с/в, доле циклов с достаточным числом эмбрионов для переноса и криоконсервации, или отсутствием эмбрионов для переноса, вероятности генетической пренатальной диагностики путем амниоцентеза, выявления анеуплоидии после проведения амниоцентеза в группах ЭКО и ЭКО/ПГС в общей популяции бесплодных пар были получены из данных Российской ассоциации репродукции человека (РАРЧ, 2007–2011 гг.) и данных литературы [4, 15–17]. Данные по вероятности наступления беременности, с/в, доле циклов с достаточным числом эмбрионов для переноса, или отсутствием эмбрионов для переноса в группах ЭКО и ЭКО/ПГС у пар с патозооспермией были получены из результатов собственных проведенных исследований [4, 18] (табл. 1).
 Понятие «патозооспермия» включало патологию сперматогенеза в виде ТЗС (доля патологических форм сперматозоидов более 96%) и/или АЗС (общая подвижность сперматозоидов менее 40% и подвижность сперматозоидов с прогрессивным движением менее 32%) и/или ОЗС (общая концентрация сперматозоидов в 1 мл спермы менее 15 000 000) (ВОЗ, 2010) [19]. Исходы циклов ЭКО (вероятность наступления беременности и с/в) включали исходы циклов ЭКО со свежими эмбрионами, исключая циклы с ПГС и циклы с донорскими эмбрионами, и рассчитывались на число проведенных пункций яичников по данным РАРЧ 2007–2011 гг. Исходы ЭКО с размороженными эмбрионами рассчитывались на число начатых криоциклов. Исходы ЭКО с ПГС учитывались отдельно. Доля циклов с достаточным числом эмбрионов для переноса рассчитывалась путем отношения числа переносов к числу пункций в свежих циклах ЭКО/ИКСИ или отношения числа переносов к числу начатых циклов с размороженными эмбрионами. Соответственно, доля циклов с отсутствием эмбрионов для переноса рассчитывалась путем вычитания доли циклов с наличием эмбрионов из единицы. Данные по исходам беременности у пар с патозооспермией у мужчин были получены из результатов проведенных ранее исследований [4, 18].
Понятие «патозооспермия» включало патологию сперматогенеза в виде ТЗС (доля патологических форм сперматозоидов более 96%) и/или АЗС (общая подвижность сперматозоидов менее 40% и подвижность сперматозоидов с прогрессивным движением менее 32%) и/или ОЗС (общая концентрация сперматозоидов в 1 мл спермы менее 15 000 000) (ВОЗ, 2010) [19]. Исходы циклов ЭКО (вероятность наступления беременности и с/в) включали исходы циклов ЭКО со свежими эмбрионами, исключая циклы с ПГС и циклы с донорскими эмбрионами, и рассчитывались на число проведенных пункций яичников по данным РАРЧ 2007–2011 гг. Исходы ЭКО с размороженными эмбрионами рассчитывались на число начатых криоциклов. Исходы ЭКО с ПГС учитывались отдельно. Доля циклов с достаточным числом эмбрионов для переноса рассчитывалась путем отношения числа переносов к числу пункций в свежих циклах ЭКО/ИКСИ или отношения числа переносов к числу начатых циклов с размороженными эмбрионами. Соответственно, доля циклов с отсутствием эмбрионов для переноса рассчитывалась путем вычитания доли циклов с наличием эмбрионов из единицы. Данные по исходам беременности у пар с патозооспермией у мужчин были получены из результатов проведенных ранее исследований [4, 18].
В анализе были учтены только прямые затраты на проведение ЭКО и ЭКО/ПГС. Под затратами понималась непосредственная стоимость медицинских услуг, а также стоимость койко-дней при проведении различных лечебных процедур в условиях стационара. Стоимость ЭКО в свежем цикле, выскабливания полости матки в 1-м триместре и прерывания беременности во 2-м триместре беременности была рассчитана по тарифам обязательного медицинского страхования (ОМС) за 2013 г. [20, 21].
Стоимость ЭКО в криоцикле, амниоцентеза и пренатального генетического скрининга была рассчитана как средняя стоимость на данный вид медицинской услуги в государственных центрах ВРТ Москвы (табл. 2).
Мы предположили, что всем женщинам с с/в будет проведено выскабливание полости матки. Также мы предположили, что всем женщинам, которые не прошли ПГС, будет проведен пренатальный генетический скрининг путем амниоцентеза. Так как вероятность потери беременности после амниоцентеза мала и составляет около 0,06%, мы не учитывали риск потери беременности после амниоцентеза в нашей модели [22]. Также для облегчения модели мы не включили в нее пренатальный генетический скрининг путем биопсии хориона, предположив, что скрининг всегда проводится путем амниоцентеза. Если во время пренатального генетического скрининга выявлялась анеуплоидия плода, мы предположили, что этим женщинам будет проведено прерывание беременности во 2-м триместре.
Длительность госпитализации по различным видам медицинских услуг определялась в соответствии с утвержденными Минздравом России стандартами оказания медицинской помощи [21, 23]. Средние нормативы финансовых затрат на единицу объема медицинской помощи на 2013 г. составляют: на 1 пациенто-день лечения в условиях дневных стационаров за счет средств ОМС – 570 руб.; на 1 койко-день в медицинских организациях, оказывающих медицинскую помощь в стационарных условиях, за счет средств ОМС – 1756,2 руб. [24].
Устойчивость созданной модели была проверена путем анализа чувствительности с учетом размаха вероятностей и стоимости процедур от средних показателей (табл. 1 и 2). В дополнение был проведен анализ Монте-Карло, при котором все величины вероятностей были одновременно изменены случайным образом, и имитационное моделирование было повторено 51 905 раз (общее число циклов ВРТ в России в 2011 г. по данным РАРЧ). Для оценки влияния патозооспермии на изменение модели мы повторили анализ с показателями для этой группы пациентов (табл. 1). В этом случае был также проведен анализ чувствительности и имитационное моделирование Монте-Карло для 20 762 пар (40% всех пар), так как мужской фактор, по данным литературы, занимает 40–50% в структуре бесплодия [3].
Результаты исследования
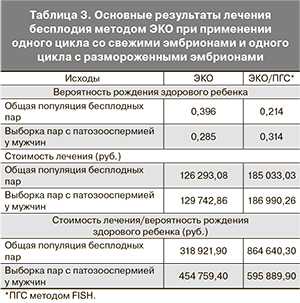
В нашей аналитической модели для пар, страдающих бесплодием, вероятность иметь здорового ребенка при применении одного цикла ЭКО со свежими эмбрионами и одного цикла ЭКО с размороженными эмбрионами составила 39,6% по сравнению с 21,4% для пар при применении одного цикла ЭКО/ПГС (рис. 1). При этом вероятность родить ребенка с анеуплоидией составила 4,4% в циклах ЭКО и всего 1% в циклах ЭКО/ПГС.
Средняя стоимость лечения методом ЭКО составила 126 293,08 руб. по сравнению со 185 033,03 руб. при лечении методом ЭКО/ПГС. При этом средняя стоимость лечения методом ЭКО в расчете на одного здорового ребенка составила 318 250,70 руб., при лечении методом ЭКО/ПГС – 864 303,90 руб. (табл. 3). Показатель приращения затрат (инкрементный показатель соотношения стоимости и эффективности – ICER) на проведение ЭКО и ЭКО/ПГС составил 3214,19 руб.
Для того чтобы оценить влияние полученных данных на эффективность лечения бесплодия методом ЭКО в рамках отечественного здравоохранения мы провели анализ на гипотетической когорте, состоящей из 51 905 пар (число циклов ЭКО в 2011 г. в России по данным РАРЧ). Оказалось, что использование ЭКО со свежими или размороженными эмбрионами в последующем цикле проводит к рождению 20 554 здоровых детей по сравнению с 11 107 здоровыми детьми при лечении бесплодия методом ЭКО/ПГС.
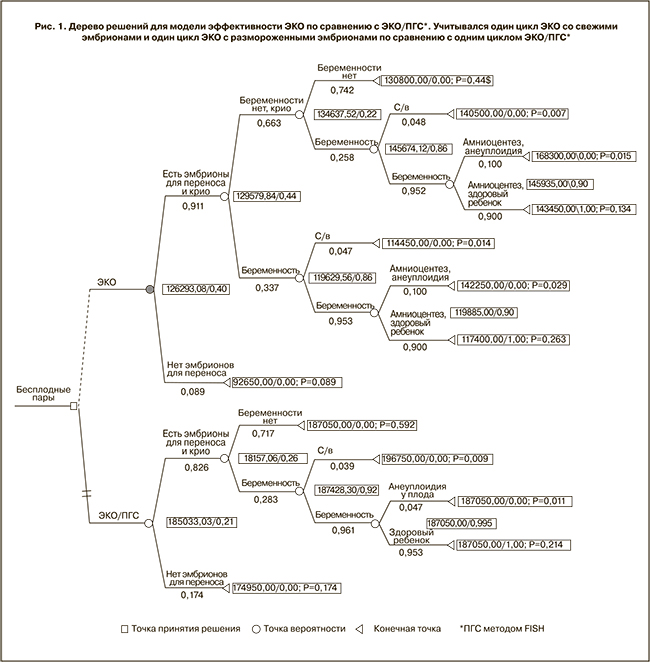
При применении одностороннего анализа чувствительности для каждой из включенных в модель величин модель была чувствительна к изменению вероятности наличия эмбрионов при ЭКО, наступления беременности при применении ЭКО и ЭКО/ПГС, с/в при ЭКО и рождения здорового ребенка при ЭКО (табл. 4).
Во всех остальных случаях ЭКО оставалась доминирующей стратегией стоимости лечения бесплодия в расчете на одного здорового ребенка. Если бы вероятность наступления беременности при применении ЭКО/ПГС возросла до 52,4% по сравнению с исходной вероятностью 28,3%, то ЭКО/ПГС стала бы доминирующей стратегией по эффективности лечения бесплодия в расчете на одного здорового ребенка. Также ЭКО/ПГС стала бы доминирующей стратегией, если бы ее стоимость снизилась до 115 142 руб. по сравнению с исходными 187 050 руб. (рис. 2).
При проведении двустороннего анализа чувствительности по взаимному влиянию различных критериев на эффективность лечения бесплодия было выявлено, что при их большей значимости отмечается меньшая разница в их влиянии на достижение равной вероятности исходов, и наоборот. В предполагаемом диапазоне наступления беременности в циклах ЭКО и ЭКО/ПГС от 0 до 100% для достижения одинаковой клинико-экономической эффективности этих методик вероятности наступления беременности при применении ЭКО и ЭКО/ПГС должны соответственно составлять 93 и 97% или 6 и 33%, что маловероятно.
При применении симуляционного моделирования Монте-Карло с проведением 51 905 повторов было выявлено, что ЭКО является более клинико-экономически выгодной процедурой для рождения эуплоидного (здорового) ребенка по сравнению с ЭКО/ПГС в 99% повторов (р<0,001).
После проведения клинико-экономического анализа для общей популяции пар, страдающих бесплодием, мы провели аналогичный анализ для пар с патозооспермией у мужчин. В нашей аналитической модели для пар с патозооспермией у мужчин вероятность иметь здорового ребенка при применении одного цикла ЭКО со свежими эмбрионами и одного цикла ЭКО с размороженными эмбрионами составила 28,5% по сравнению с 31,4% для пар при применении одного цикла ЭКО/ПГС (рис. 3). При этом вероятность родить ребенка с анеуплоидией составила 3,2% в циклах ЭКО и 1,5% в циклах ЭКО/ПГС.
Средняя стоимость лечения методом ЭКО составила при этом 129 742,86 руб. по сравнению со 186 990,26 руб. при лечении методом ЭКО/ПГС. При этом средняя стоимость лечения методом ЭКО в расчете на одного здорового ребенка составила 454 759,40 руб., при лечении методом ЭКО/ПГС – 595 889,90 руб. (табл. 3). Таким образом, в этой группе пациентов стоимость лечения бесплодия методом ЭКО или ЭКО/ПГС в расчете на рождение одного здорового ребенка отличалась всего на 23% в отличие от общей популяции пар с бесплодием, у которых дельта в цене составляла 63%. Показатель приращения затрат (ICER) на проведение ЭКО и ЭКО/ПГС составил 20 124,62 руб.
Анализ на гипотетической когорте, состоящей из 20 762 пар с патозооспермией у мужчин (40% циклов ЭКО в 2011 г. в России по данным РАРЧ) показал, что использование ЭКО со свежими или размороженными эмбрионами в последующем цикле проводит к рождению 5923 здоровых детей по сравнению с 6515 здоровыми детьми при лечении бесплодия методом ЭКО/ПГС. При применении симуляционного моделирования Монте-Карло с проведением 20 762 повторов было выявлено, что ЭКО является более клинико-экономически выгодной процедурой для рождения эуплоидного (здорового) ребенка по сравнению с ЭКО/ПГС всего лишь в 70% повторов (р<0,05).
При применении одностороннего анализа чувствительности для каждой из включенных в модель величин модель была чувствительна к изменению вероятности наличия эмбрионов при ЭКО/ПГС, наступления беременности при применении ЭКО и ЭКО/ПГС, с/в при ЭКО/ПГС и рождения здорового ребенка при ЭКО и ЭКО/ПГС (табл. 5).

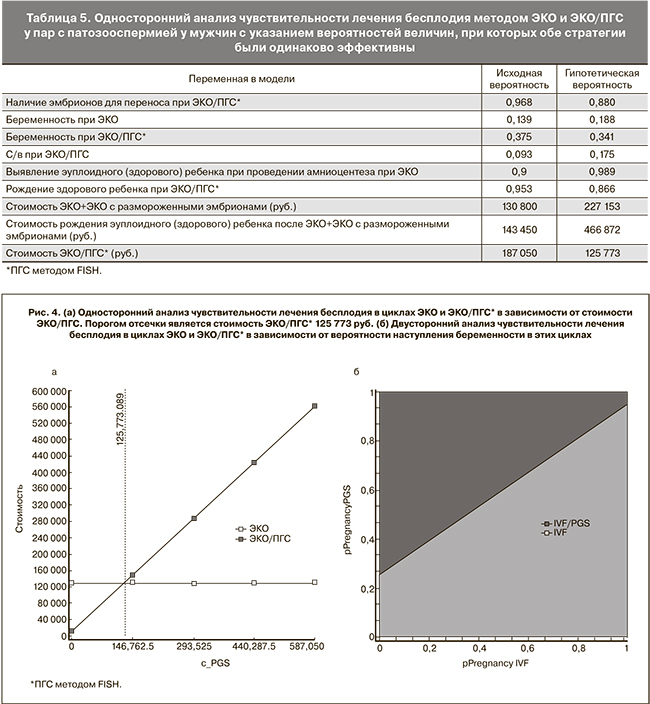
Поскольку в когорте пар с патозооспермией у мужчин вероятность рождения здорового ребенка была выше при проведении ЭКО/ПГС по сравнению с ЭКО, то ЭКО стала бы доминирующей стратегией, если бы вероятность наступления беременности возросла до 18,8% по сравнению с исходной вероятностью 13,9%, или вероятность наступления беременности при ЭКО/ПГС снизилась до 34,1% по сравнению с исходной вероятностью 37,5%. Однако ЭКО/ПГС по-прежнему является более дорогостоящей процедурой и стала бы доминирующей стратегией, если бы ее стоимость снизилась до 125 773 руб. по сравнению с исходными 187 050 руб. (рис. 4).
Обсуждение
Наше исследование является первым, в котором была применена аналитическая модель принятия решений по выбору более клинико-экономически выгодной стратегии – ЭКО или ЭКО/ПГС – для диагностики анеуплоидии и рождения здорового потомства у бесплодных пар с патозооспермией у мужчин.
Вначале мы провели анализ клинико-экономической обоснованности применения ЭКО/ПГС методом FISH в общей популяции бесплодных пар. Было выявлено, что применение ПГС методом FISH является менее эффективной и более затратной стратегией для достижения рождения здорового ребенка. Это подтверждают результаты, полученные зарубежными коллегами [11, 12]. Данный анализ также является первым подобным исследованием, проведенным с использованием данных российской популяции пар, страдающих бесплодием (РАРЧ, 2007–2011) [18]. Модель, созданная в ходе проведения этой части исследования, была устойчива для колебаний вероятностей и цен при проведении одностороннего анализа чувствительности. Было выявлено, что для достижения схожей с ЭКО эффективности вероятность наступления беременности при проведении ЭКО/ПГС должна быть в 2 раза выше, а стоимость ЭКО/ПГС должна уменьшиться на 73 000 руб., что составляет стоимость ПГС. В дополнение к анализу чувствительности был проведен симуляционный анализ Монте-Карло, который, при случайном изменении всех включенных в модель показателей относительно ожидаемых значений, выявил, что ЭКО без применения ПГС было предпочтительным методом в 99% случаев, что доказывает устойчивость созданной модели. Однако при проведении двустороннего анализа чувствительности было выявлено, что если вероятность наступления беременности при лечении бесплодия методами ВРТ будет очень высокой (95±2%), то эффективность обеих методик (ЭКО и ЭКО/ПГС) станет приблизительно равной, несмотря на разницу в цене. Однако достижение подобной эффективности маловероятно в клинической практике.
Увеличение эффективности ПГС можно добиться по меньшей мере двумя способами. Как было указано выше, проведение ПГС методом FISH отличается достаточно высоким уровнем ложноположительных и особенно ложноотрицательных результатов за счет биопсии только одного или двух бластомеров и, следовательно, сохранения вероятности наличия анеуплоидии в оставшихся клетках эмбриона, а также за счет анализа ограниченного числа хромосом и невозможности исключения анеуплоидии в других, не подвергнутых тестированию хромосомах. Проведение ПГС методом сравнительной геномной гибридизации с исследованием всех хромосом, возможно, позволит достичь большей его эффективности. Необходимо проведение исследований по сравнению эффективности вышеуказанных методик. Кроме того, совершенствование методов замораживания эмбрионов после ПГС (витрификация эмбрионов) позволит увеличить вероятность наступления беременности у пар, прошедших скрининг.
После проведения анализа типа затраты – эффективность ЭКО/ПГС у популяции бесплодных пар в целом мы повторили подобный анализ на когорте пар с патозооспермией у мужчин. В этой группе пациентов эффективность лечения бесплодия при помощи ЭКО/ПГС методом FISH была несколько выше по сравнению с ЭКО в плане рождения здорового потомства: 31,4% при применении ПГС и 28,5% без применения ПГС. Но при этом за счет более высокой стоимости лечения методом ЭКО/ПГС ЭКО по-прежнему оставалось преобладающей стратегией лечения бесплодия в этой группе больных. Однако следует отметить, что стоимость лечения бесплодия методом ЭКО или ЭКО/ПГС в расчете на рождение одного здорового ребенка отличалась всего на 23%, в отличие от общей популяции пар с бесплодием, у которых дельта в цене составляла 63%. Применение симуляционного анализа Монте-Карло также показало, что ЭКО было преобладающей стратегией лишь в 70% случаев, что делает данную модель менее устойчивой по сравнению с предыдущей моделью. Односторонний анализ чувствительности показал, что для увеличения клинико-экономической эффективности ПГС по сравнению с ЭКО надо снизить ее стоимость до 125 773 руб. по сравнению с исходными 187 050 руб.
Мы рассчитали и провели сравнение показателей приращения затрат (ICER) на проведение ЭКО и ЭКО/ПГС в общей популяции бесплодных пар и выборке пар с патозооспермией у мужчин. В первом случае ICER составил (-)3214,19 руб., во втором 20 124,62 руб. Анализ CER показал, что для достижения дополнительного 1% эффективности (то есть 1% рождения здоровых детей) при применении ЭКО/ПГС в группе пациентов с патозооспермией требуется 20 124,62 руб. дополнительных вложений, тогда как в общей популяции пациентов ICER имеет отрицательное значение. Это значит, что в этом случае невозможно достичь повышения эффективности ЭКО/ПГС за счет дополнительных затрат.
В нашей модели точность ПГС была определена приблизительно, так как данные по чувствительности и специфичности ПГС достоверно не известны. Проведение исследований высокого качества с использованием человеческих эмбрионов невозможно ввиду возникающих этических проблем. Поэтому вероятность ложноположительного результата ПГС (диагностирование анеуплоидии у нормальных эуплоидных эмбрионов), которая в нашей модели была определена переменной «отсутствие эмбрионов для переноса при проведении ЭКО/ПГС», может быть ниже, если ложноположительный уровень ПГС на самом деле ниже. То же самое касается ложноотрицательного результата, который в нашей модели определен как «отсутствие беременности», «самопроизвольный выкидыш» и «рождение ребенка с анеуплоидией». В случае более низкого ложноотрицательного уровня ПГС вероятность вышеуказанных состояний будет ниже.
Ограничением нашего исследования была ошибка выборки, основанная на неравноценном подборе пациентов для сравнения ЭКО и ЭКО/ПГС в общей популяции пациентов с бесплодием и пациентов с патозооспермией. В первом случае использовались данные национального регистра за 5 лет, в который были включены более 50 000 бесплодных пар ежегодно. При этом в этой популяции присутствовали пациенты с патозооспермией. Во втором случае нами были использованы собственные данные, полученные на небольшой когорте пар с патозооспермией у мужчин, проходивших лечение на базе одного центра ВРТ. Кроме того, стоимость различных процедур, включенных в стандарт лечения бесплодия методом ЭКО, учитывалась из различных каналов финансирования (ОМС и платные услуги), так как не все включенные в исследование методики финансируются по каналу ОМС. Для снижения влияния возможной ошибки исследования на полученные данные нами был проведен симуляционный анализ Монте-Карло на 51 905 и 20 762 гипотетических бесплодных парах, что приблизительно соответствуют числу пролеченных в 2011 г. больных по данным РАРЧ [18]. В первом случае анализ показал большую устойчивость модели, тогда как в случае пациентов с патозооспермией устойчивость модели была не столь велика.
Наши данные подтверждают имеющиеся научные сведения о недостаточной клинико-экономической эффективности рутинного применения ПГС методом FISH в клинике ВРТ [12]. ЭКО остается более клинико-экономически целесообразной методикой лечения бесплодия в общей популяции бесплодных пар. Тем не менее, у пар с патозооспермией у мужчин ЭКО с применением ПГС методом FISH может быть более выгодной методикой в случае снижения стоимости ПГС. Необходимо проведение дополнительных исследований по изучению эффективности ПГС в этой группе пациентов.



