Синдром поликистозных яичников (СПКЯ) относится к числу наиболее распространенных эндокринных нарушений у женщин репродуктивного возраста. Он представляет собой набор характеристик, основные из которых: гиперандрогения (клиническая или биохимическая), олиго/ановуляции, увеличение объема яичников и другие эхографические признаки поликистозных яичников (ПКЯ). В зависимости от сочетания различных клинико- лабораторных признаков выделяют разные формы или фенотипы СПКЯ – А, В, С и D. Первые два фенотипа считаются «классическими» и более изученными. Мнения экспертов о принадлежности фенотипов С и D к СПКЯ расходятся. В частности, ряд экспертов Международного общества гиперандрогенных состояний и СПКЯ ставит под сомнение причастность неандрогенного фенотипа D к СПКЯ, с их точки зрения наличие гиперандрогении (ГА) является основополагающим для диагностики СПКЯ [1]. Однако до настоящего времени подобная форма СПКЯ все же признается большинством исследователей и заслуживает особого внимания и дальнейшего изучения. Известно, что избыточное воздействие андрогенов может осуществляться за счет повышения функциональной активности андрогенного рецептора (АР) даже при нормальном уровне андрогенов в сыворотке крови, как это наблюдается при так называемом идиопатическом гирсутизме, андрогенной алопеции и других патоло- гических состояниях [2, 3]. Возможно, аналогичные механизмы задействованы и в генезе СПКЯ.
На сегодняшний день известно, что ген АР локализуется на хромосоме Х (Хq11.2-q12) в относительной близости от области ее инактивации (Хq13). Учитывая этот факт, внимание исследователей было обращено на изучение представленности неслучайной инактивации хромосомы Х у пациенток с СПКЯ. Исследование на моно- и дизиготных близнецах с разными фенотипами СПКЯ показало, что многообразие форм может быть обусловлено различной экспрессией Х-сцепленных генов [4]. В 2006 г. T.E. Hickey с группой ученых изучали неслучайную инактивацию хромосомы Х среди сестер [5]. Сестры с одинаковым CAG-генотипом и одинаковой представленностью инактивации хромосомы Х имели в 30 раз чаще схожие проявления заболевания (фенотип СПКЯ), чем сестры с одинаковым генотипом, но разной представленностью инактивации хромосомы Х [5]. Это косвенно указывает на участие неслучайной инактивации хромосомы Х в патогенезе СПКЯ.
Исследований по изучению полиморфизма гена АР и неслучайной инактивации хромосомы Х при разных фенотипах СПКЯ в доступной нам литературе не найдено. Это представляет научный интерес и послужило основанием для данного исследования.
Цель исследования – изучение представленности неслучайной инактивации хромосомы Х, полиморфизма гена АР по CАG-повторам у пациенток с различными фенотипами СПКЯ.
Материали методы исследования
Объект исследования – 120 женщин репродуктивного возраста: основную группу составили 56 паци-нток с СПКЯ, группу контроля – 64 здоровые жен- щины с регулярным менструальным циклом. Средний возраст по группам – 27,3±5,74 и 25,6±4,28 года, индекс массы тела (ИМТ) – 24,2±5,4 кг/м² и
22,4±0,11 кг/м² соответственно. Нарушения менструального цикла по типу олигоменореи выявлены у 45 (84,9%) пациенток основной группы, по типу аменореи – у 3 (5,7%). Жалобы на отсутствие беременности предъявляли 13 (24,5%) женщин. Диагноз СПКЯ и определение фенотипов проводилось в соответствии с Роттердамскими критериями [6]. Пациентки были разделены на три подгруппы, соответствующие 3 фенотипам (пациентки с фенотипом С отсутствовали): I подгруппа (фенотип А) — 28 женщин с «классическим» СПКЯ: с олиго-аменореей, ГА, эхографическими признаками ПКЯ, II подгруппа (фенотип В) — 17 женщин, с олиго-аменореей и ГА без эхографических признаков ПКЯ, III подгруппа (фенотип D) — 11 женщин без клинико-лабораторных признаков ГА, с олиго-аменореей и ПКЯ. По возрасту и ИМТ существенных различий между группами не выявлено.
Определялся уровень антимюллерова гормона (АМГ), лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола (Е2), тестостерона общего (Тобщ), тестостерона свободного (Тсв), андростендиона (А), тестостерон-эстроген-связывающего глобулина (ТЭСГ), 17-оксипрогестерона (17-ОП), дегидроэпианд- ростерона-сульфат (ДГЭА-С). Исследования проводили с использованием наборов «DРС» (США), «Immunotech» (Чехия), «DBC» (Канада), «DSL» (США) на приборе Immulite (США). Индекс свободных андрогенов (ИСА) рассчитывался по формуле Тобщ х 100% / ТЭСГ. УЗИ органов малого таза проводилось трансвагинальным датчиком на аппарате фирмы Aloka-SSD 650 (Япония). Объем яичников определяли по формуле 0,523×l1×l2×l3 см3.
Выявление неслучайной инактивации хромосомы Х (XCI) осуществлялось с помощью методов, основанных на определении дифференциального метилирования активной и неактивной хромосомы Х. Маркерами инактивации служили полиморфизмы Х-сцепленных генов. Для определения XCI был использован метод анализа полиморфизма CAG-повтора в первом экзоне гена АР, с использованием метилчувствительной полимеразной цепной реакции (ПЦР). Определение полиморфизма гена АР с подсчетом количества CAG-повторов в 1 экзоне осуществлялось с помощью фрагментного анализа продуктов ПЦР. Выделение ДНК из образцов периферической крови пациенток проводили с помощью набора DNAprep100 («Dnalab», Россия). Продукты ампли- фикации подвергались детекции на генетическом анализаторе ABI 3130 Genetic Analyzer («Applied Biosystems», США). Для оценки информативности анализируемого локуса проводили определение доли гетерозигот в исследуемой выборке. Анализу подлежали только гетерозиготные варианты гена. За критическое значение было принято число повторов, равное 22. Помимо определения частоты распространения аллелей гена АР, была исследована частота SBM (simple biallelic mean), показателя среднего биаллельного значения – среднее арифметическое количества CAG-повторов обоих алеллей и SBM<22 – среднее арифметическое количества CAG-повторов обоих аллелей; частота VNTR(CAG) обоих коротких аллелей гена (n<22/<22) – показатель вариабельного числа тандемных повторов (variable number tandem repeats). Статистический анализ экспериментальных данных проводился с использованием ПСП Statistica 8.0, GraphPad InStat v.3.06, GraphPad Prism 5, MedCalc и программы Excel. Достоверность различий средних оценивали с помощью t-теста или методом Mann– Whitney. При сравнении частотных показателей для оценки достоверности использовали критерий χ2 (с поправкой Йейтса для таблиц 2×2) или точный критерий Fisher. Для выявления и оценки связей между исследуемыми показателями применялся непараметрический корреляционный анализ по методу Spearman и регрессионный анализ.
Результаты исследования
Оценка гормонального статуса показала достовер- ное увеличение сывороточного уровня Тобщ, Тсв, А в подгруппах с фенотипами А и В по сравнению с фенотипом D и контрольной группой при отсутствии существенных различий между последними (табл. 1). Несмотря на отсутствие различий по уровню Тобщ и Тсв между фенотипам А и В, при фенотипе А уровень андрогенов оказался достоверно более высоким. Наиболее высокие значения АМГ были выявлены при фенотипе А, уровень АМГ при других фенотипах превышал контрольные значения примерно в 3 раза. Средний уровень ЛГ в подгруп- пах с различными фенотипами СПКЯ существенно не различался, но превышал контрольные показатели приблизительно в 2 раза. Средние значения ТЭСГ оказались ниже в группе пациенток с СПКЯ, чем в группе контроля (р<0,05). Статистически значимых различий по данному показателю между разными фенотипами СПКЯ не выявлено. Учитывая отсутствие биохимической ГА при фенотипе D, показатели ИСА в этой группе оказались в 1,7 раза ниже, чем при андрогенных фенотипах (табл. 1).
Таблица 1. Средние значения гормональных показателей у пациенток с различными фенотипами СПКЯ и в контрольной группе.
Для генетического исследования были отобраны 56 образцов ДНК больных СПКЯ, информативность ДНК-маркера (доля гетерозигот в исследуемой выборке) составила 94,3% (53/56). Длина CAG-повтора варьировала от 7 до 30 CAG- тринуклеотидов. Контрольная группа была представлена 64 образцами ДНК, информативность составила 87,5% (56/64). Минимальная длина CAG-повтора равна 15, максимальная – 34.
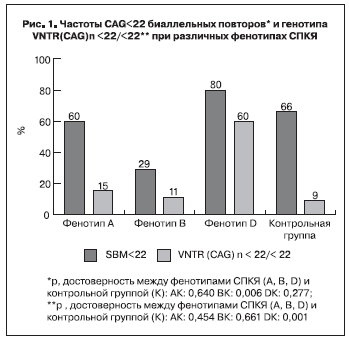
Для определения взаимосвязи длины CAG- повтора гена АР с формированием клинического фенотипа СПКЯ проводился сравнительный анализ длины аллелей между подгруппами с фенотипами А, В и D и группой контроля. По показателю SBM не выявлено достоверных различий – 22,18±2,35, 22,5±2,42, 20,45±3,49, 21,42±2,26 соответственно (р<0,1). Частота выявления средней суммы аллелей CAG-нуклеотидов <22 (SBM<22) при фенотипе Д составила 80%. Это значительно выше, чем при 2 других фенотипах (рис. 1). Генотипы с обоими короткими аллелями (VNTR(CAG)n<22/<22) при фенотипе D встречались в 60% случаев, что в 5–6 раз чаще, чем при фенотипах А, В и среди здоровых женщин, между последними достоверной разницы не установлено.
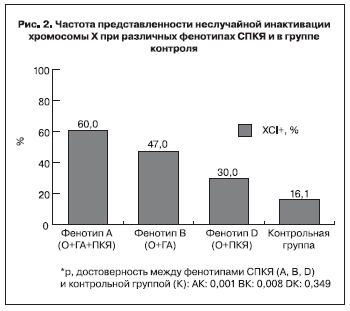
Представленность ХСI в группах пациенток с фенотипом А, В и D составила 64% (16/25), 50% (8/16) и 33% (3/9) соответственно (рис. 2). Частота неслучайной инактивации при фенотипе D достоверно от группы контроля не отличалась (р=0,349) (рис. 2).
Обсуждение
В 2003 г. на конференции, организованной Европейским обществом репродукции человека и эмбриологии (ESHRE) и Американским обществом репродуктивной Медицины (ASRM), были предложены новые критерии диагностики СПКЯ [6], согласно которым для установления диагноза достаточно двух из трех признаков СПКЯ. Основываясь на этих критериях, стало возможно выделить четыре фенотипа СПКЯ: фенотип А: сочетание клинической и/или биохимической ГА, хронической ановуляции (О) и ПКЯ (ГА+О+ПКЯ); фенотип В – клиническая и/или биохимическая ГА, хроническая ановуляция без эхографических признаков ПКЯ (ГА+О); фенотип С – ГА и эхографические признаки ПКЯ при овуляторных циклах (ГА+ПКЯ); фенотип D – хроническая ановуляция в сочетании с эхографическими признаками ПКЯ при отсутствии лабораторных и клинических признаков ГА (О+ПКЯ). Независимо от этнических особенностей с наибольшей частотой в популяции встречается классический фенотип А – 58,1–73,6%, распространенность фенотипов В, С и D составляет
7,5–14,3%, 5,5–13,2% и 13,3–16,3% соответственно [7–9]. Среди больных, отобранных в исследование, также доминировал фенотип А (50%), частота фенотипов В и D составила 30,3 и 19,7%, пациенток с фенотипом С не было.
В результате проведенного гормонального исследования не выявлено достоверных различий по уровням гонадотропинов, АМГ, Е2, ТЭСГ между фенотипами СПКЯ. Как и следовало ожидать, уровень Тобщ, Тсв, А, ДГЭА-С при андрогенных фенотипах был в 2 раза и более выше, чем при фенотипе D и в контрольной группе. Несмотря на отсутствие значимых различий между разными формами СПКЯ, отмечена тенденция к возрастанию среднего уровня АМГ, ЛГ, Тобщ и Тсв при фенотипе А по сравнению с В. В литературе имеются данные о достоверно более высоком содержании ЛГ, ЛГ/ФСГ, 17-ОП при классическом фенотипе СПКЯ [10, 11].
Возникновение ГА при СПКЯ традиционно связывают с избыточной продукцией и повышенной концентрацией андрогенов в сыворотке крови, вопрос о формировании неандрогенного фенотипа Д остается неясным. В связи с этим было проведено молекулярно-генетическое исследование гена АР. Первый экзон гена кодирует N-концевой домен (участок транскрипции и активации) и содержит различное количество триплетов цитозин-аденин-гуанин (CAG), которые формируют полиглутаминовую цепь [12]. Количество CAG- повторов варьирует от 8 до 35 и составляет в среднем для европиоидной расы 22 CAG-повтора, для афроамериканцев – 20 [12, 13]. Ранее проведенными исследованиями показано, что у женщин короткие аллели ассоциируются с гирсутизмом [14], с ранним пубархе, ГА яичникового генеза [15], а также с андрогензависимыми дермопатиями [13]. В некоторых работах обнаружена более частая встречаемость короткого аллеля у больных с СПКЯ, чем у здоровых женщин [9, 16].
Согласно полученным результатам при андрогенных фенотипах чаще встречались длинные аллели АР, при неандрогенном – короткие. Так частота распространения генотипов с обоими короткими аллелями гена АР (VNTR(CAG) n<22/<22) среди пациенток с фенотипом D составила 60%, это в 5–6 раз выше, чем при фенотипах А, В и среди здоровых женщин. Кроме того, не выявлено достоверных различий по показателю SBM<22 между фенотипом D и группой контроля. При неандрогенном фенотипе D средний уровень Тобщ примерно в 2 раза ниже, чем в группе пациенток с длинными аллелями – фенотип А и В. Это дает основание предположить, что укороченная форма АР обладает большим сродством к андрогенам. В связи с этим избыточное воздействие андрогенов возможно и при их нормальной концентрации. Схожую точку зрения высказывают авторы одной из публикаций, посвященной полиморфизму гена АР и ановуляторному бесплодию у пациенток с СПКЯ [17], в которой они представили данные о взаимосвязи коротких аллелей гена АР с нормальным уровнем Тобщ. Это позволяет рассматривать неандрогенный фенотип как один из вариантов СПКЯ.
Гетерогенность СПКЯ сопряжена и с другими молекулярно-генетическими особенностями. Так, неслучайная инактивация хромосомы Х почти в 2 раза чаще выявлялась при фенотипах А (61%), В (47%), чем при D (30%), при котором не установлено отличий с контрольной группой. В исследовании N.A. Shah выявлено частое сочетание неслучайной инактивации Х-хромосомы с более длинными CAG-повторами АР [18]. Подобная закономерность прослеживается и в нашем исследовании при андрогенных фенотипах СПКЯ. Это дает основание предположить, что нарушение нормального процесса инактивации Х-хромосомы приводит к недостаточному или аномальному функционированию генов, задействованных в формировании и развитии фолликулярного пула яичников. Вероятно, наличие неслучайной инактивации взаимосвязано с более выраженной клинической манифестацией СПКЯ, а возможно, и с более неблагоприятными прогнозом для восстановления и реализации репродуктивной функции. Проведение долгосрочных исследований на больших выборках может подтвердить или опровергнуть это предположение.
Неслучайная инактивация Х-хромосомы нередко выявляется при ряде других нарушений репродуктивной функции, к которым относят преждевременную недостаточность яичников и бедный ответ на стимуляцию овуляции [19]. В этой связи можно предполагать, что неслучайная инактивация Х-хромосомы является маркером заболеваний репродуктивной системы, обусловленных нарушениями фолликулогенеза.
Выводы
1. У каждой второй пациентки СПКЯ выявлена неслучайная инактивация хромосомы Х, с более высокой частотой представленности при андрогенных фенотипах СПКЯ. Неслучайную инактивациию хромосомы Х, вероятно, можно рассматривать как фактор риска овуляторной дисфункции, нарушения ритма менструаций и бесплодия.
2. Частота гомозигот по коротким аллелям АР среди пациенток с фенотипом D в 5–6 раз выше, чем при фенотипах А и В.
3. Укорочение CAG-повтора АР (<22), косвенно свидетельствующее об увеличении его функциональной активности, вероятно, играет роль в формировании фенотипа D, для которого характерен нормальный уровень андрогенов в сыворотке крови.



