Миома матки, а также ее сочетание с аденомиозом – это наиболее частые гиперпластические процессы миометрия, встречающиеся у 20–30% женщин детородного возраста. Клиническая картина манифестации этих заболеваний включает прежде всего повышение объема менструальной кровопотери, и, как следствие, развитие железодефицитной анемии [1–3]. Как и миома матки, аденомиоз также изолированно приводит к увеличению размеров матки, менометроррагии. Эти доброкачественные процессы могут сопровождаться болями, нарушением функции смежных органов, ургентными негравидарными кровотечениями, бесплодием и самопроизвольным абортом [4].
До введения в лечебную практику принципов предоперационной подготовки анемизированных пациенток тактикой «выбора» была гистерэктомия с гемотрансфузией [5–7]. Многие исследования доказали эффективность предоперационной подготовки больных препаратами, вызывающими временную аменорею [4, 8–10]. Возможной альтернативой представляется эмболизация маточных сосудов, в то же время являясь достаточно спорной методикой при необходимости сохранения репродуктивной функции [11]. Однако по окончании лечения происходит возобновление роста узлов и развитие железистой ткани аденомиоза, что ограничивает универсальное использование существующих гормональных средств в качестве радикального метода лечения [12, 13]. Появление на клинической практике препарата эсмия предоставляет возможность оценить целесообразность, эффективность и безопасность его применения при подготовке анемизированных пациенток к органосберегающим операциям при сочетании миомы матки и аденомиоза [14], что и явилось целью данного исследования.
Материал и методы исследования
В исследовании участвовали 45 женщин, нуждавшихся в органосберегающих операциях с множественной миомой матки и/или аденомиозом. Все женщины отмечали повышенный объем менструальной кровопотери и у всех женщин было снижение уровня гемоглобина ниже 105 г/л. При этом уровень гемоглобина выше 90 г/л выявлен у 23 (51,1%), 70–90 г/л у 14 (31,1%), ниже 70 г/л – у 8 (17,8%) из планируемых на операцию женщин.
В течение 2–3 месяцев, предшествовавших оперативному лечению, все пациентки принимали препарат эсмия по 1 таблетке в сутки в соответствии с рекомендованной схемой. До начала медикаментозного и хирургического лечения проводилось ультразвуковое исследование (УЗИ) внутренних гениталий с целью измерения исходных размеров матки, узлов миомы, толщины стенок матки при аденомиозе. Их объемы вычислялись встроенным в УЗИ-аппараты программным обеспечением. Одновременно проводили контроль уровня концентрации гемоглобина, эстрадиола, прогестерона, фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) в плазме крови. Длительность курса зависела от степени роста уровня гемоглобина. Так, при достижении уровня 110 г/л планировали оперативное лечение. Прием препарата эсмия не прекращали до дня операции. Таким образом, у 27 женщин длительность курса оказалась приблизительно равной 2 упаковкам, у 18 – трем упаковкам, то есть около 80–90 суток. Определение уровня гормонов в крови представляло интерес для сравнения с таковыми при применении препаратов агонистов гонадотропин-рилизинг гормона по результатам исследований других авторов [2, 15–17]. Такое сравнение позволяет косвенно оценивать возможность развития тех или иных побочных эффектов при применении гормональных препаратов различных групп.
Для сравнения средних значений применялся критерий Стьюдента. Для анализа использовали статистический пакет StatSoft STATISTICA 10.
Результаты исследования
Средний возраст обследованных женщин составил 35,7±6,0 года. У всех пациенток перед операцией была выявлена анемия, с целью ликвидации которой, а также для достижения того или иного морфологического эффекта назначен препарат эсмия (улипристал) курсами по 60–90 суток. При достижении уровня гемоглобина 110 г/л планировали оперативное лечение. Важно, что прием препарата рекомендовали до дня операции, не прерывая и не останавливая курс. Ни в одном случае не развились побочные эффекты, требовавшие прекращения приема препарата.
Показаниями для операции были: солитарный узел миомы, как правило, интрамуральный, не менее 6 см в диаметре – 13 (28,9%); множественная миома матки с наличием узлов миомы различной локализации – 18 (40%), из них почти половина (44,4%) в сочетании с аденомиозом – 8; и изолированный аденомиоз – 14 (31,1%). Частота лапароскопического доступа при миомэктомии составила в нашем исследовании 31,1%. Доля операций по Osada – с радикальным иссечением пораженного аденомиозом миометрия составила во всей выборке 48,9%. Все такие операции были выполнены минилапаротомным доступом с временным пережатием магистральных сосудов. Надо отметить, что временное клиппирование внутренних подвздошных артерий при минилапаротомии применимо при небольших размерах матки – при наличии технического доступа из раны к бифуркации подвздошных артерий. В большинстве наших наблюдений размеры матки превышали 10–11 недель и технически более простым и оправданным методом мы считали наложение временного турникета на перешеек после двусторонней фенестрации широких связок с одновременным наложением съемных сосудистых клипс на воронко-тазовые связки. Такой метод выполним практически при любом размере тела матки. Считая методику временного турникетирования крайне целесообразной при миомэктомии и особенно при операции по Osada, мы минимизируем интраоперационную кровопотерю вне зависимости от технической «сложности» при удалении узлов миомы или иссечении пораженного миометрия.
Размеры тела матки у оперированных женщин на момент операции при солитарных узлах были не более 8–9 недель беременности (33,3%), при множественной миоме матки и аденомиозе превышали 10–11 недель. Операция по Osada выполнялась нами у 10 женщин при размерах матки более 11–13 недель и у 12 пациенток – при размерах более 13 недель. При этом у 4 размеры матки превышали 18–19 недель. Во всех случаях мы наблюдали уменьшение размеров узлов миомы, выраженное в различной степени. Наиболее заметный эффект получен при солитарных (единичных) узлах миомы. Так среднее снижение объема узла в течение не менее 60 суток приема эсмии составило 32±8%. Это было достоверно выше, чем при множественных узлах, где уменьшение объема узлов отмечено не у всех, а у 77,8% женщин (p<0,05). Степень уменьшения также была менее выражена и составила 24±5% (p<0,01). Степень уменьшения в случаях множественных узлов считали по изменению размеров двух наибольших по размеру узлов, поскольку измерить объем тела матки часто не представлялось возможным ввиду геометрически неправильных форм. Интересный эффект получен у пациенток с изолированным аденомиозом. Во-первых, изменение объема тела матки было статистически достоверно и составило от 24 до 29% (p<0,05); но и во время операции нами отмечено четкое «ограничение» зоны железистой инвазии от интактного эндометрия, что позволяло наиболее полно иссечь пораженный миометрий, а далее сформировать швами матку, прошивая здоровые ткани. Такой подход позволяет повысить эффективность операции по Osada с позиции нормализации менструальной кровопотери – в течение первого полугодия наблюдения уровень ее уменьшился на 12–15%, что является одним из лучших показателей в сравнении с результатами лечения других авторов [10, 18, 19].
Необходимость и задача предоперационной подготовки при операциях на ткани миометрия обусловлена и заключается не только в физическом уменьшении размеров узлов и суммарно тела матки, но и в нормализации уровня гемоглобина, что снижает потребность в гемотрансфузии. При симптомной миоме матки и аденомиозе только достижение гормональной аменореи или эмболизация маточных сосудов позволяют нормализовать уровень гемоглобина. Прием препаратов железа и даже антифибринолитиков, или их сочетание, не приводят к ликвидации анемии у этих больных. Медикаментозная подготовка препаратом эсмия в ряде случаев позволяет выполнить органосберегающий объем операции тогда, когда сделать это без нее технически невозможно. В одном наблюдении узел миомы около 20 см в диаметре замещал весь перешеек и влагалищную часть шейки так, что длина канала от наружного зева до дна матки составила около 24 см. После трехмесячного курса эсмии диаметр узла уменьшился до 14 см. Нами в этой ситуации выполнена трахелэктомия и реимплантация перешейка в купол влагалища.
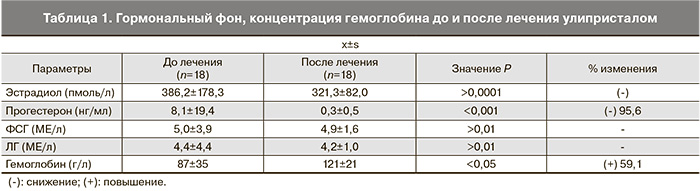
У 18 женщин нам удалось проследить параметры гормонального фона до и после назначения улипристала. Уже через 45–50 суток непрерывного приема улипристала отмечалось значимое снижение концентрации прогестерона в периферической крови. Отсутствие изменения концентрации ЛГ и ФСГ, а также значимого снижения уровня эстрадиола обусловливают отсутствие таких побочных эффектов, какие свойственны агонистам гонадотропин-рилизинг гормона (табл. 1).
Результирующая аменорея привела к значительному и быстрому росту концентрации гемоглобина почти на 60% во всей выборке; ни в одном случае не было рецидивов эпизодов метроррагии на фоне приема препарата перед операцией.
Лечение хорошо переносили все пациентки, ни в одном случае не возникло необходимости прерывать курс. Во время лечения у одной пациентки отмечались легкие «приливы», не связанные со снижением уровня эстрадиола, а у четырех – незначительные периодические головные боли. В двух случаях отмечена усталость, у одной – головокружение.
Таким образом, применение улипристала целесообразно при подготовке анемизированных больных с миомой матки и аденомиозом к органосберегающим операциям. В 88% наблюдений ликвидация анемии наблюдается уже через 45–60 суток после начала приема. Это позволяет обезопасить проведение множественной миомэктомии и/или операции по Osada при диффузном аденомиозе, множественной миоме матки за счет восстановления предоперационного уровня гемоглобина до нормальных показателей (в наших наблюдениях с 87 до 121 г/л, p<0,05). Отличительной особенностью такого рода гормонального неоадъювантного лечения является сохранение уровня эстрадиола в крови на обычном уровне, то есть отсутствие системной гипоэстрогении обусловливает хорошую переносимость препарата.
Обсуждение
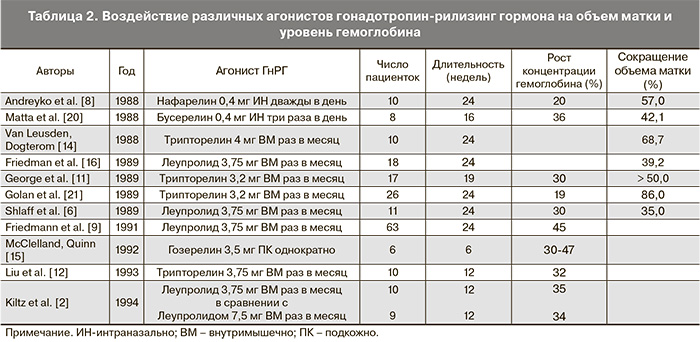
После первого опубликованного отчета о применении агонистов гонадотропин-рилизинг гормона в 1983 г. в лечении миомы матки вопрос гормонотерапии как единственного метода терапии сохранил свою актуальность и по настоящее время [6, 14, 16]. Зачастую отказ от операции или наличие строгих противопоказаний заставляют врачей искать пути «сдерживания» роста узлов. В то же время симптомное течение аденомиоза и миомы матки обусловливает развитие анемии у 40–50% женщин. Снижение гемоглобина ниже 85–90 г/л не является благоприятствующим фактором для хирургического органосберегающего лечения, которое, как правило, приводит к большей интраоперационной кровопотере в сравнении с гистерэктомией. Следовательно, вопросы подготовки больных к операции, которая заключается в снижении кровоснабжения узлов миомы, отграничении зоны железистой инвазии при аденомиозе и ликвидации анемии являются основными задачами. Терапевтический эффект агонистов гонадотропин-рилизинг гормона обусловлен подавлением деятельности гипофиза и в последующем яичников и снижением концентрации эстрогенов. Такая искусственная менопауза, однако, носит обратимый характер, и после прекращения лечения рост миомы и рецидив менометроррагии наблюдается у большинства пациенток [10, 19–21]. Применение препарата другой группы – улипристала позволяет достичь этих же целей, с минимальным количеством побочных эффектов и хорошей переносимостью.
Сокращение объема матки на 24–29% нами достигнуто при назначении 2–3-месячного курса, что сопоставимо с действием агонистов гонадотропин-рилизинг гормона (табл. 2). Лечение в течение трех месяцев для достижения значительного сокращения объемов матки и миомы до хирургического вмешательства оказалось достаточным.
Значимое повышение концентрации гемоглобина и ликвидация анемии наблюдались у всех пациенток, что помогало избежать необходимости интраоперационной трансфузии крови и ее препаратов. Сокращение размера матки и массы миомы облегчает проведение хирургических манипуляций, тем самым способствуя выбору в пользу органосберегающего лечения или, возможно, вагинального или лапароскопического доступа. Уменьшение кровопотери во время операции имеет важное значение при проведении абдоминальной миомэктомии или операции по Osada для восстановления репродуктивной функции [15, 17].



