Работа выполнена при поддержке Государственного комитета № 16.522.12.2009 от 29.09.2011 г.
Рак шейки матки (РШМ) продолжает занимать второе место среди злокачественных опухолей репродуктивной системы у женщин после рака молочных желез. По данным Международного агентства по изучению рака, ежегодно в мире регистрируются 470 000 новых случаев РШМ, 233 000 заканчиваются смертельным исходом (15% приходится на женщин от 20 до 34 лет). Значительная вариабельность заболеваемости и смертности от РШМ отмечается не только в различных странах мира, но и в различных регионах одной и той же страны [1]. Почти в 100% случаях РШМ, подтвержденного гистологическими методами исследования, выявляются высокоонкогенные типы вируса папилломы человека (ВПЧ) [2]. После инфицирования ВПЧ цервикальная интраэпителиальная неоплазия (СIN) высокой степени развивается уже через 3 года у 27% женщин [3]. Наиболее опасным фактором прогрессии является длительная персистенция ВПЧ (более 2 лет) [4].
Известно около 120 типов ВПЧ, примерно 40 из них инфицируют аногенитальную область [5, 6]. По данным Европейского отделения Международного общества по изучению инфекций в акушерстве и гинекологии I-IDSOG-EUROPE, ВПЧ подразделяются на следующие группы онкологического риска: высокого (16, 18, 31, 33, 35, 39, 45, 46, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82-й типы) и низкого (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81-й) [7].
В различных регионах мира спектр генотипов ВПЧ варьирует. В Европе наиболее распространенными типами ВПЧ у женщин с CIN и РШМ считаются 16-й (61,6%) и 18-й (7%), в Китае – 16-й (33,3%) и 58-й (23,8%), в Мексике – 58-й (28,5%), 16-й (25,7%) и 18-й (13,3%), в Южной Бразилии – 16-й (34,7%), 58-й (13,8%) и 33-й (13,8%) типы [8–12]. Мета-анализ, включающий 14 исследований, показал, что высокоонкогенными в Японии являются ВПЧ 16, 18, 31, 33, 35, 52, 58-го типов. N. Munoz и соавт. (2004) сообщили, что в Юго-Восточной Азии ВПЧ 16-го и 18-го типов при РШМ выявлялись в 73,5%, в Северной Африке – в 76,9% , в Европе – в 71,5%. В Юго-Восточной Азии ВПЧ 52-го и 58-го типов были обнаружены в 6,1% случаях РШМ, в Северной Африке – в 1,5%, в Европе – в 1,1% [13]. В Японии ВПЧ 16-го и 18-го типов встречались реже (58,8%), более распространены ВПЧ 52-го и 58-го типов (13,7%).
Таким образом, ВПЧ 52-го и 58-го типов в последнее время часто выявляются в ряде стран при CIN и РШМ, однако их значение в развитии предраковых заболеваний шейки матки в популяции женщин России не изучено.
Целью настоящего исследования стало изучение распространенности и роли различных типов ВПЧ, в том числе ВПЧ 52-го и 58-го типов в развитии CIN и РШМ.
Материал и методы исследования
В проспективное исследование были включены 548 женщин с патологией шейки матки, средний возраст 31,4±0,8 года. Критерии включения: женщины в возрасте от 18 до 60 лет, предраковые заболевания шейки матки и РШМ, подтвержденные морфологическими методами диагностики. Критерии исключения: беременность, отсутствие возможного следования протоколу. Длительность наблюдения за пациентами составила 15,8±6 месяцев. Комплексное обследование женщин включало сбор жалоб, анамнез, гинекологический статус (наличие патологических процессов аногенитальной области, слизистой влагалища и шейки матки, наличие или отсутствие остроконечных кондилом и др.), расширенную кольпоскопию, молекулярно-биологические методы диагностики, цитологическое исследование, биопсию шейки матки (по показаниям) с последующим гистологическим исследованием биопсийного материала.
Молекулярно-биологические методы исследования включали проведение метода мультиплексной полимеразной цепной реакции с детекцией результатов в режиме реального времени для определения 21 типа ВПЧ (6, 11, 16, 18, 26, 31, 33, 35, 39, 44 (55), 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82-й) с определением вирусной нагрузки (наборы ЗАО «НПФ ДНК-технология», Россия). При оценке кольпоскопической картины применяли единую Международную кольпоскопическую классификацию, одобренную на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011). Использовалась новая цитологическая система Бетесда (TBS-Terminology Bethesda System), предложенная Национальным институтом по изучению рака США [3, 6]. Клиническое значение имеют три вида препаратов: 1) нормальные мазки, без цитологических изменений, клетки негативные в отношении интраэпителиального поражения или злокачественности (NILM – Negative for intraepithelial lesion or malignancy); 2) «непонятные» мазки, не позволяющие исследователю точно ответить на вопрос о характере поражения, но в тоже время не являющиеся нормой (ASC-US – Atypical squamous cells of undetermined significance, плоскоклеточная атипия неопределенной значимости); 3) предраки (SIL – Squamous Intraepitelial Lesions, плосколеточные интраэпителиальные поражения) низкой (LSIL- Low-Grade Squamous Intraepitelial Lesions) и высокой (HSIL – High-Grade Squamous Intraepitelial Lesions) степени выраженности.
Гистологические образцы классифицировали следующим образом: легкая дисплазия (CIN I), умеренная дисплазия (CIN II), тяжелая дисплазия (CIN III) и РШМ.
В процессе статистической обработки данных применены методы описательной статистики, корреляционный анализ, расчеты проводились на базе прикладных программ Microsoft Excel и STATISTICA 6.0. При оценке вирусной нагрузки в качестве меры центральной тенденции определяли медиану, в качестве интервальной оценки – межквартильный размах. Достоверность межгрупповых различий определяли с помощью критерия Манна–Уитни.
Результаты исследования и обсуждение
По полученным результатам пациентки были разделены на 2 группы: 1-я группа – ВПЧ- негативные женщины – 165 (30,%) и 2-я группа – ВПЧ- позитивные женщины – 383 (69,9%) (рис. 1).
 ВПЧ 16-го типа выявлялся в 143 случаях (37,3%), ВПЧ 58-го – в 60 случаях (15,7%), ВПЧ 31-го – в 53 случаях (13,8%), ВПЧ 52-го – в 42 случаях (11%), ВПЧ 33-го – в 38 случаях (9,9%), ВПЧ 44(55)-го – в 35 случаях (9,1%), ВПЧ 18-го – в 33 случаях (8,6%), ВПЧ 45-го – в 28 случаях (7,3%), ВПЧ 51-го – в 26 случаях (6,8%), ВПЧ 56-го – в 25 случаях (6,5%), ВПЧ 66-го – в 24 случаях (6,3%). Другие типы ВПЧ встречались менее чем в 5,7% случаях (рис. 2 см на вклейке).
ВПЧ 16-го типа выявлялся в 143 случаях (37,3%), ВПЧ 58-го – в 60 случаях (15,7%), ВПЧ 31-го – в 53 случаях (13,8%), ВПЧ 52-го – в 42 случаях (11%), ВПЧ 33-го – в 38 случаях (9,9%), ВПЧ 44(55)-го – в 35 случаях (9,1%), ВПЧ 18-го – в 33 случаях (8,6%), ВПЧ 45-го – в 28 случаях (7,3%), ВПЧ 51-го – в 26 случаях (6,8%), ВПЧ 56-го – в 25 случаях (6,5%), ВПЧ 66-го – в 24 случаях (6,3%). Другие типы ВПЧ встречались менее чем в 5,7% случаях (рис. 2 см на вклейке).
В 114 образцах (29,8%) выявлено несколько типов ВПЧ. Результаты показали, что часто встречающимися типами ВПЧ были 16, 58, 31, 52, 33, 44(55)-й. Полученные нами данные отличаются от представленных ранее, согласно которым наиболее распространенными типами ВПЧ считались 16, 18, 33, 45, 31-й типы [8]. Результаты наших исследований совпадают с данными S.Paesi, E.S. Pretto, F.Barea и соавт. (2009), где получена высокая распространенность ВПЧ 52-го и 58-го типов у женщин с предраковыми заболеваниями шейки матки [9]. Таким образом, регионами с высоким уровнем распространенности ВПЧ 52-го и 58-го типов можно также считать Россию, наряду с Китаем, Японией, Западной Африкой, Бразилией [9–12].
Анализ распространенности ВПЧ 52-го и 58-го типов в зависимости от возраста пациенток в нашем исследовании показал, что данные типы ВПЧ чаще выявляются у молодых женщин до 35 лет (88%), у женщин старшего возраста – в 12% случаев. В то же время, по данным K. Takehara и соавт. (2011), ВПЧ 52-го и 58-го типов чаще выявлялись у женщин старшего возраста [14].
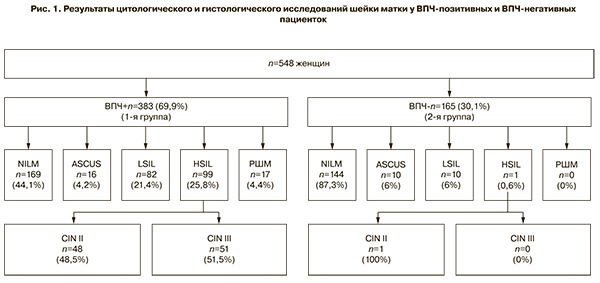
Для оценки вирусной нагрузки ВПЧ-позитивные женщины были разделены на 4 группы: I группа – 169 (44,1%) женщин с NILM, II группа – 82 (21,4%) с LSIL, III группа – 99 (25,8%) с HSIL, IV группа – 17 (4,4%) с РШМ. Вирусная нагрузка составила: I группа – 3,9 (2,7–5,7) lg копий вируса в образце, II группа – 5,0 (4,3–6,5) lg копий вируса в образце, III группа – 5,9 (4,6–6,6) lg копий вируса в образце, IV группа – 6,7 (6,2–7,8) lg копий вируса в образце (рис. 3). В среднем в образце содержалось около 100 000 клеток (4,5–5,5 lg).
Полученные результаты показывают, что величина вирусной нагрузки ассоциируется со степенью тяжести поражения шейки матки – у пациенток с HSIL и РШМ отмечено достоверное повышение вирусной нагрузки (p<0,01) по сравнению с группой NILM. Проведены многочисленные исследования в мире, в том числе и в России, которые также показывают прямую корреляционную зависимость между увеличением вирусной нагрузки, CIN и начальной стадией РШМ [15–19]. По-видимому, большое число копий генома ВПЧ увеличивает вероятность интеграции вирусной ДНК в геном хозяина и, как следствие, развития заболевания. По мере прогрессирования РШМ вирусная нагрузка снижается [20, 21].
Вместе с тем в проведенном нами исследовании диапазоны значения величины вирусной нагрузки во всех группах перекрываются, поэтому данный показатель не может быть использован как единственный маркер неблагоприятного прогноза течения ВПЧ и должен рассматриваться в комплексе с другими методами диагностики патологии шейки матки (цитология, расширенная кольпоскопия). Некоторые исследователи полагают, что клинически значимой является вирусная нагрузка более 5,0 lg на 100 000 клеток, в связи с чем были введены понятия «порог клинической значимости» – вирусная нагрузка ниже этого значения ассоциирована с регрессией ВПЧ-инфекции; нагрузка выше данного порога обозначается как «клинически значимая» [16, 18].
У ВПЧ-позитивных женщин при цитологическом исследовании выявлено: NILM – 169 (44,1%), АSCUS – 16 (4,2%), LSIL – 82 (21,4%), HSIL – 99 (25,8%), РШМ – 17 (4,4%) (рис. 1).
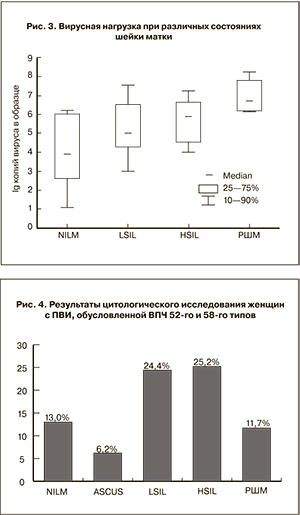
При NILM ВПЧ 52-го и 58-го типов встречались у 22 женщин (13%), при АSCUS – у 1 (6,2%), при LSIL – у 20 (24,4%), при HSIL – у 25 (25,2%), при РШМ – у 2 (11,7%) (рис. 4). Эти данные могут указывать на высокоонкогенный потенциал ВПЧ 52-го и 58-го типов.
Сравнительная характеристика результатов цитологии, обусловленных воздействием на шейку матки ВПЧ 52-го и 58-го типов с наиболее часто встречающимся типом – ВПЧ 16, представлена на рис. 5.
При проведении расширенной кольпоскопии ВПЧ- позитивным женщинам были обнаружены следующие изменения: адекватная кольпоскопическая картина – 285 (74,4%), неадекватная – 98 (25,5%). Нормальная кольпоскопическая картина (эктопия шейки матки, наботовы кисты) выявлена у 85 (22,2%), из них на фоне ВПЧ 52-го и 58-го типов – 16 (18,8%); зона трансформации (ЗТ) со слабовыраженными изменениями – 104 (27,1%)/26 (25%); ЗТ с выраженными изменениями – 95 (24,8%)/21(22,1%); экзофитные кондиломы шейки матки – 13 (3,4%)/2 (15,4%); эктропион шейки матки – 12 (3,1%)/ 2 (16,7%); эндометриоз шейки матки – 10 (2,6%)/3 (30%); полип цервикального канала – 2 (0,5%)/1 (50%); гипертрофия и рубцовая деформация шейки матки – 23 (6%)/5 (21,7%). У 66 женщин (17,2%) выявлены остроконечные кондиломы вульвы и влагалища, из них обусловленные генотипами ВПЧ 52-го и 58-го – 19 (28,8%).
Пациенткам с LSIL и HSIL при наличии ЗТ со слабовыраженными и выраженными изменениями выполнена биопсия шейки матки. При гистологическом исследовании биопсийного материала CIN была диагностирована у 145 ВПЧ- позитивных женщин. Представляла интерес встречаемость ВПЧ 52-го и 58-го типов у пациенток с подтвержденной CIN. CIN I наблюдалась у 46 (31,7%) пациенток, у 11 (23,9%) из них выявлялись ВПЧ 52-го и 58-го типов; CIN II – у 48 (33,1%) пациенток, у 12 (25%) из них выявлялись ВПЧ 52-го и 58-го типов; CIN III – у 51 (35,2%) пациенток, у 13 (25,5%) из них выявлялись ВПЧ 52-го и 58-го типов (рис. 1).
Комплексный анализ результатов расширенной кольпоскопии и гистологического исследования биоптатов шейки матки демонстрируют существенную роль ВПЧ 52-го и 58-го типов в развитии патологии шейки матки.
В целом, результаты исследования показали, что ВПЧ 52-го и 58-го типов оказались более распространенными, по сравнению с представленными ранее данными. Указанные типы ВПЧ являются причиной аномальной цитологии у 22,4% пациенток и требуют тщательного наблюдения и своевременного лечения.
Заключение
ВПЧ 52-го и 58-го типов («азиатские» типы) чаще выявляются у молодых женщин в возрасте до 35 лет, обладают высокоонкогенным потенциалом и требует своевременной диагностики, мониторинга и лечения. Величина вирусной нагрузки ассоциируется со степенью тяжести поражения шейки матки, но показатель не может быть использован как единственный маркер неблагоприятного прогноза течения ВПЧ и должен рассматриваться в комплексе с другими методами диагностики патологии шейки матки. Таким образом, CIN и РШМ могут быть ассоциированы с другими типами ВПЧ, в связи с чем мы считаем целесообразным помимо стандартных типов (ВПЧ 16, 18) определять ВПЧ 52-го и 58-го типов.



