По данным ВОЗ (2016 г.) около 40 млн человек в мире проживает с ВИЧ-инфекцией. В Российской Федерации общее число ВИЧ-инфицированных составляет 1 008 675 человек. Среди серопозитивных по ВИЧ-инфекции преобладают мужчины (62%), однако в последнее время отмечается «феминизация» эпидемии. К концу 2016 г. около 400 000 женщин в России имели диагноз ВИЧ-инфекция. Большинство (80%) ВИЧ-инфицированных находятся в возрасте 15–49 лет, многие планируют рождение ребенка [1, 2]. Разработка и внедрение в клиническую практику антиретровирусной терапии (АРВТ) наряду с увеличением продолжительности и качества жизни позволяет пациентам с ВИЧ-инфекцией реализовать репродуктивную функцию. Более того, при сохраненной фертильности у обоих супругов существует возможность самостоятельного зачатия [3]. Однако результаты большинства исследований показывают снижение фертильности у женщин с ВИЧ-инфекцией [1, 4, 5]. По данным Parsons и соавт. (2000) частота встречаемости бесплодия среди пациенток с ВИЧ-инфекцией на 37% больше, чем у серонегативных по ВИЧ женщин [6]. Патофизиология снижения фертильности в данной группе больных не изучена. Обсуждается роль инфекций, передающихся половым путем (ИППП), и как результат, воспалительных заболеваний органов малого таза, которые в 10 раз чаще регистрируются среди пациенток с ВИЧ-инфекцией, в сравнении с сексуально активными серонегативными по ВИЧ женщинами такого же возраста [7]. Другие исследователи снижение фертильности связывают с негативным влиянием некоторых препаратов в схемах АРВТ на липидный обмен и резистентность к инсулину, что оказывает воздействие на фолликулогенез и процесс овуляции [8, 9].
Использование вспомогательных репродуктивных технологий (ВРТ) является одной из возможностей реализации репродуктивной функции у ВИЧ-серопозитивных женщин, а также мерой профилактики инфицирования здорового партнера в дискордантных по ВИЧ парах. Однако исследования по изучению особенностей проведения овариальной стимуляции, способа оплодотворения (экстракорпоральное оплодотворение (ЭКО), интрацитоплазматическая инъекция сперматозоида в ооцит (ИКСИ)), а также эффективности циклов ВРТ в данной группе больных немногочисленны и противоречивы. В ряде работ показано, что для стимуляции суперовуляции у пациенток с ВИЧ-инфекцией потребовались более высокие дозы гонадотропинов [1, 5, 10]. Напротив, Martinet и соавт. (2006) пришли к выводу, что нет различий в овариальном ответе на гонадотропную стимуляцию между серопозитивными и серонегативными по ВИЧ женщинами в программе ЭКО [11].
Хотя рецепторы ВИЧ не экспрессируются на ооцитах, в фолликулярной жидкости вирус содержится у 100% пациенток с определяемой и у 60% пациенток с неопределяемой вирусной нагрузкой в плазме крови [12]. Это означает, что теоретически вирусные частицы могут быть занесены в ооцит в процессе проведения ИКСИ, однако практическое значение подобного инфицирования неизвестно, так как на практике таких случаев пока не зарегистрировано. С учетом теоретически возможного риска отдельные авторы полагают, что для женщин с ВИЧ-инфекцией использование внутриматочной инсеминации и ЭКО представляется более безопасным, чем применение ИКСИ [13]. Другие специалисты не разделяют таких взглядов и при лечении бесплодия у ВИЧ-инфицированных женщин используют все существующие методы ВРТ, в том числе ИКСИ [14].
По разным данным, частота наступления беременности в циклах ВРТ у ВИЧ-инфицированных пациенток колеблется от 6,7 до 24,1%, что существенно ниже по сравнению с женщинами без ВИЧ-инфекции [1, 5, 15]. С другой стороны, при использовании у пациенток с ВИЧ-инфекцией ооцитов донора частота наступления беременности сопоставима с эффективностью программ ЭКО у женщин без ВИЧ-инфекции [5, 10].
Таким образом, отсутствие однозначных данных об особенностях реализации репродуктивной функции в программах ВРТ у женщин с бесплодием и ВИЧ-инфекцией послужило основанием для проведения настоящего исследования.
Цель исследования: оценить клинико-лабораторные характеристики и эффективность программ ВРТ у пациенток с ВИЧ-инфекцией.
Материал и методы исследования
На базе 1-го гинекологического отделения ФГБУ НЦАГиП им. академика В.И. Кулакова проведено проспективное исследование случай-контроль у 94 пациенток, которые обратились для проведения программ ВРТ. Основную группу исследования составили 38 женщин с ВИЧ-инфекцией, контрольную группу – 56 серонегативных по ВИЧ пациенток. В основной группе проведено 74 цикла ЭКО, в том числе 44 стимулированных и 30 криоциклов. В контрольной группе – 59 и 30 циклов соответственно. Критерии включения в основную группу: наличие ВИЧ-инфекции, 3-я субклиническая, 4а, 4б, 4в стадии, фаза ремиссии; прием АРВТ, неопределяемая вирусная нагрузка в 2 последовательных исследованиях, сделанных с интервалом не менее 3 мес. Критерии не включения: ВИЧ-инфекция у обоих супругов, наличие противопоказаний к проведению ВРТ. Критерии включения в группу контроля: ВИЧ-серонегативный статус обоих супругов, селективный перенос одного эмбриона.
Стимуляцию суперовуляции проводили в длинных протоколах и протоколах с антагонистами гонадотропин-рилизинг гормона (антГнРГ) с использованием препаратов рекомбинантного фолликулостимулирующего гормона и человеческого менопаузального гонадотропина. Протокол с антГнРГ начинали со 2–4-го дня менструального цикла, длинный протокол – с предварительной десенситизации гипоталамо-гипофизарно-яичниковой системы на 21–23-й день менструального цикла путем введения агониста ГнРГ в дозе 0,1 мг ежедневно. Введение гонадотропинов начиналось при условии отсутствия кист яичников и толщине эндометрия не более 4 мм. Подбор стартовой дозы индуктора в обоих протоколах проводился исходя из параметров овариального резерва (возраст, уровень АМГ, ФСГ, количество антральных фолликулов и ответ на предыдущую стимуляцию). Доза гонадотропинов изменялась в соответствии с ответом яичников на стимуляцию. В протоколах с антГнРГ для предотвращения паразитарного пика эндогенного ЛГ при достижении фолликулами диаметра 14–15 мм начиналось введение препарата антГнРГ в дозе 0,25 мг/сутки подкожно. Для финального созревания ооцитов назначали овуляторную дозу хорионического гонадотропина человека (ХГЧ) 10 000 МЕ при визуализации трех и более фолликулов ≥17 мм в диаметре и толщине эндометрия ≥8 мм. Аспирацию ооцитов осуществляли через 35–36 часов после введения триггера овуляции. Оценка качества полученных ооцитов по степени зрелости осуществлялась на основании общепринятых критериев. При нормальных результатах спермограммы по критериям ВОЗ проводилось оплодотворение методом ЭКО. Оценка качества эмбрионов осуществлялась на основании совокупности следующих параметров: скорость дробления эмбрионов, симметричность бластомеров, степень цитоплазматической фрагментации (<10%, 10–30%, >30%), мультинуклеарность бластомеров. Перенос одного эмбриона проводили на 3–5-е сутки культивирования, оставшиеся эмбрионы 1–2-й степени качества были криоконсервированы. Поддержку посттрансферного периода осуществляли с помощью вагинального введения микронизированного прогестерона в суточной дозе 600 мг со следующего дня после пункции. При подготовке эндометрия в криоциклах использовали препараты натуральных эстрогенов и микронизированного прогестерона.
Проводилась оценка стартовой и суммарной дозы гонадотропинов, длительности стимуляции яичников до введения ХГЧ; числа полученных и зрелых ооцитов; частоты оплодотворения, качества эмбрионов. Эффективность лечения оценивали по показателям частоты наступления беременности на перенос эмбриона. Биохимическая беременность была диагностирована на 12–14-й день после переноса эмбриона при концентрации β-субъединицы ХГЧ в сыворотке крови >20 МЕ/л. Клиническую беременность подтверждали при визуализации в полости матки плодного яйца, содержащего живой эмбрион через 4–5 недель после переноса.
Статус пациенток по ВИЧ-инфекции оценивали на основании данных о стадии и фазе заболевания, уровне вирусной нагрузки, CD3+, CD4+, CD8+ лимфоцитов, иммунореактивного индекса и длительности АРВТ.
Статистическая обработка данных выполнена на индивидуальном компьютере с использованием программы IPM SРSS Statistics, версия 21.
При нормальном характере распределения данных результаты представлены как среднее ± стандартная ошибка среднего (М±m). При распределении данных, отличных от нормального (значение теста Колмогорова–Смирнова менее 0,05) количественные показатели представлены в виде Ме (L-H), где Ме – медиана, L – 25 (нижний) квартиль, H – 75 (верхний) квартиль. Для сравнения непараметрических данных применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 – для таблиц сопряженности признаков 2*2 (для сравнения частот встречаемости признаков в анализируемых группах). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Результаты исследования
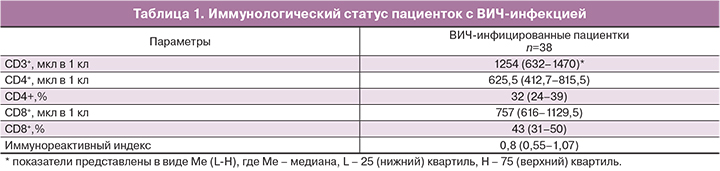
«Стаж» ВИЧ-инфекции составил 10 лет (медиана, интерквартильный интервал (ИИ) 6–13 лет), преобладала 3-я субклиническая стадия заболевания (68,4%). Пациентки со стадией заболевания 4а (23,6%), 4б (5,3%) и 4в (2,6%) находились в фазе ремиссии. Все пациентки получали комбинированную АРВТ, из них 37 женщин принимали препараты группы нуклеозидных ингибиторов обратной транскриптазы в сочетании с ингибиторами протеазы, 1 пациентка – нуклеозидный ингибитор обратной транскриптазы+не нуклеозидный ингибитор обратной транскриптазы. Медиана продолжительности приема препаратов составила 4 года (2–6,2 года). Вирусная нагрузка в крови была неопределяемая в 100% случаев. Иммунологический статус ВИЧ-серопозитивных пациенток представлен в табл. 1.
У 10 (26,3%) ВИЧ-серопозитивных женщин выявлен сопутствующий гепатит С, у 9 (24,3%) – гепатит С диагностирован у супруга.
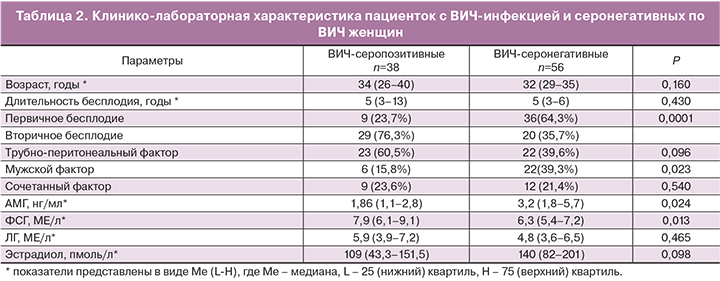
Анализ клинико-анамнестических данных показал, что пациентки обеих групп были сопоставимы по возрасту (медиана 34 и 32 года; р=0,160) и длительности бесплодия (5 и 5 лет; р=0,430) (табл. 2).
Трубно-перитонеальный (39,5 и 30,4%, р=0,467) и сочетанный (23,6 и 21,4%; р=0,540) факторы бесплодия встречались одинаково часто в обеих группах, однако в группе без ВИЧ-инфекции статистически значимо чаще наблюдался мужской фактор (15,8 и 39,3%; р=0,023). В группе ВИЧ-инфицированных пациенток преобладало вторичное бесплодие (76,3 и 35,7%; р=0,0001). Следует отметить, что искусственный аборт в анамнезе был у каждой второй пациентки с ВИЧ-инфекцией (47,3%) и у каждой седьмой серонегативной по ВИЧ женщины (14,2%; р=0,0001). Внематочная беременность также статистически значимо чаще встречалась в основной группе по сравнению с группой контроля (31,5 и 16,1%; р=0,049). Неразвивающаяся беременность наблюдалась одинаково часто (13,1 и 8,9%; р=0,436). Роды в анамнезе были только у 4 ВИЧ-серонегативных пациенток (7,1%).
Нарушений менструального цикла как у ВИЧ-инфицированных, так и в контрольной группе выявлено не было. Индекс массы тела у женщин с ВИЧ-инфекцией был статистически значимо ниже по сравнению с пациентками без ВИЧ-инфекции (Ме 21,7 и 23,9; р=0,027). Обращает на себя внимание более раннее начало половой жизни у женщин в основной группе (16,7±0,2 и 18,5±0,3; р=0,0001).
В структуре гинекологических заболеваний у женщин с ВИЧ-инфекцией наиболее часто встречались патология шейки матки (28,9%) и хронический сальпингоофорит (28,9%), что было сопоставимо с контрольной группой. Однако осложненные формы воспалительных заболеваний придатков матки наблюдались только в основной группе (7,9%). ИППП (сифилис, хламидиоз) в анамнезе были у 11 (28,9%) женщин с ВИЧ-инфекцией и у 3 (5,3%) без ВИЧ-инфекции (р=0,001).
Оперативные вмешательства на органах малого таза были выполнены у 27 (71%) ВИЧ-инфицированных женщин и у 31 пациентки (55,4%) в группе контроля (р=0,036). В структуре объема операций в обеих группах преобладала тубэктомия, причем чаще она проведена в группе женщин с ВИЧ-инфекцией (47,3 и 30,4%; р=0,046). Частота резекции яичников была сопоставима в обеих группах (13,1 и 14,2%; р=0,429).
Концентрация АМГ была существенно ниже (1,86 и 3,2 нг/мл; р=0,024), а уровни ФСГ статистически значимо выше (7,9 и 6,3 МЕ/л; р=0,013) в группе ВИЧ-инфицированных женщин по сравнению с серонегативными по ВИЧ пациентками.
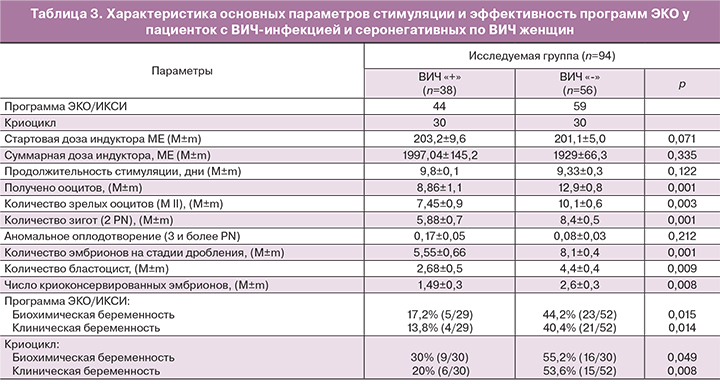
Анализ параметров стимулированного цикла не выявил существенной разницы в стартовой, суммарной дозах гонадотропинов и длительности стимуляции в обеих группах (табл. 3). Тем не менее, у пациенток с ВИЧ-инфекцией было получено меньшее количество ооцитов (8,86±1,1 и 12,9±0,8; р=0,001), зрелых ооцитов (7,45±0,9 и 10,1±0,6; р=0,003), зигот (5,88±0,7 и 8,4±0,001; р=0,001), эмбрионов на стадии дробления (5,55±0,6 и 8,1±0,4; р=0,001) и бластоцист (2,68±0,5 и 4,4±0,4; р=0,009) по сравнению с контрольной группой. В основной группе пациенток в 2 (5,3%) случаях ооциты не были получены, в 1 (2,6%) полученный ооцит не оплодотворился.
Оплодотворение методом ИКСИ проводилось одинаково часто в обеих группах (68,2 и 59,3%; р=0,213). Селективный перенос одного эмбриона проводился в 100% случаев. В основной группе перенос на 3-и сутки культивирования выполнен в 9 (31,1%) случаях, на 5-е – в 20 (68,9%, р=0,345), в группе контроля в 11 (21,2%) и 41 (78,8%, р=0,654) случаях соответственно.
В 15 из 44 (34,1%) стимулированных циклов в группе ВИЧ-инфицированных женщин не было переноса эмбрионов, из них в 7 (46,6%) случаях в связи с риском развития синдрома гиперстимуляции яичников (СГЯ), в 3 (20%) – необходимостью для последующей криоконсервации, в 2 (13,3%) – с плохим качеством полученных эмбрионов. В группе серонегативных женщин отмена переноса наблюдалась в 7 (11,8%) случаях в связи с риском развития СГЯ.
Выявлена более низкая частота биохимической и клинической беременности у пациенток с ВИЧ-инфекцией по сравнению с серонегативными по ВИЧ женщинами, как в стимулированных циклах ВРТ (17,2 и 44,2%, р=0,015; 13,8 и 40,4%, р=0,014), так и в криоциклах (30 и 55,2%, р=0,049; 20 и 53,6%; р=0,008).
Обсуждение
Увеличение продолжительности и улучшение качества жизни лиц, живущих с ВИЧ, феминизация и выход эпидемии из уязвимых групп населения в общую популяцию обосновывает необходимость изучения особенностей фертильности и реализации репродуктивной функции, в том числе с использованием ВРТ, у данной категории супружеских пар. Большинство исследований свидетельствует о снижении фертильности у женщин с ВИЧ-инфекцией. В нашей работе показанием для проведения ЭКО стало бесплодие в 100% случаев, то есть циклов ВРТ по эпидемиологическим показаниям для профилактики инфицирования супруга в данном исследовании не было.
Пациентки с ВИЧ-инфекцией имели длительный «стаж» заболевания (медиана 10 лет, ИИ 6–13 лет) и в 100% случаев принимали препараты АРВТ (медиана 4 года, ИИ 2–6,2 года). Уровни CD4+ лимфоцитов (медиана 625,5 мкл в 1 кл, ИИ 412,7–815,5) в крови и неопределяемая вирусная нагрузка перед проведением программы ЭКО свидетельствовали о «благополучном» состоянии иммунной системы, несмотря на наличие ВИЧ-инфекции.
Трубно-перитонеальный (39,5 и 30,4%, р=0,467) и сочетанный (23,6 и 21,4%; р=0,540) факторы бесплодия встречались одинаково часто в обеих группах, однако у женщин без ВИЧ-инфекции статистически значимо чаще наблюдался мужской фактор (15,8 и 39,3%; р=0,023). Наши результаты согласуются с данными других исследователей. Так, в работе Santulli и соавт (2011) показано, что патозооспермия в дискордантных супружеских парах с ВИЧ-инфекцией у женщины встречалась существенно реже, чем в контрольной группе (37,3 и 57,1%; р=0,016) [16].
Высокая частота встречаемости ИППП (28,9 и 5,3%; р=0,001) и осложненных форм воспалительных заболеваний придатков матки (7,9%) у женщин с ВИЧ-инфекцией по сравнению с серонегативными по ВИЧ женщинами обусловливает большую частоту внематочной беременности (31,5 и 16,1%; р=0,049) в данной группе больных. Большинство исследований подтверждают, что внематочная беременность у пациенток с ВИЧ-инфекцией встречается чаще, чем у неинфицированных женщин [17].
Нарушений менструального цикла у ВИЧ-инфицированных женщин в нашем исследовании выявлено не было. Вопрос о влиянии ВИЧ-инфекции на менструальный цикл остается спорным. В ранних исследованиях сообщалось о более частых нарушениях менструального цикла у женщин с ВИЧ-инфекцией, включая олигоменорею и аменорею неизвестной этиологии [9, 18]. В отличие от этих ранних результатов, Santulli и соавт. (2011) не выявили нарушений менструального цикла у ВИЧ-серопозитивных женщин [16]. Большинство авторов считают, что при оптимальном иммунном статусе нарушения регулярности менструального цикла наблюдаются реже, что отражает улучшение общего состояния здоровья пациентов с ВИЧ-инфекцией при широком доступе к АРВТ [16, 19]. В нашем исследовании пациентки с ВИЧ-инфекцией имели сохранный иммунный статус. Возможно, с этим связано отсутствие у них нарушений менструального цикла.
Одним из факторов, которые, как известно, негативно влияют на исход циклов ВРТ, является высокий индекс массы тела (ИМТ) пациентки. В нашей работе ИМТ у женщин с ВИЧ-инфекцией был статистически значимо ниже, по сравнению с пациентками без ВИЧ-инфекции (медиана 21,7 и 23,9; р=0,027). В литературе представлены противоречивые данные. Так, в исследовании Santulli и соавт. (2011) показано, что ВИЧ-инфицированные женщины имели более высокий ИМТ, чем ВИЧ-серонегативные пациентки (24,2 и 22,9, р=0,032) [16].
Nurudeen и соавт (2013), напротив, отмечали аналогичный ИМТ у ВИЧ-инфицированных и женщин без ВИЧ-инфекции [20].
Концентрация АМГ у женщин с ВИЧ-инфекцией была существенно ниже (1,86 и 3,2 нг/мл; р=0,024), а уровни ФСГ статистически значимо выше (7,9 и 6,3 МЕ/л; р=0,013) по сравнению с серонегативными по ВИЧ пациентками. При этом обе группы были сопоставимы по возрасту (34 и 32 года; р=0,160) и частоте оперативных вмешательств на яичниках (13,1 и 14,2%; р=0,429). В настоящее время нет единого мнения, что ВИЧ-инфекция влияет на овариальный резерв. Так, исследования Ohl и соавт. (2010) показали, что концентрация ФСГ у женщин с ВИЧ-инфекцией была на 37% выше, чем в конт-рольной группе, а уровни ингибина В и АМГ – на 57 и 23% ниже [21]. Число антральных фолликулов также было значительно ниже в исследуемой группе. Данные других исследований свидетельствуют о том, что пациентки с ВИЧ-инфекцией имеют нормальные параметры овариального резерва [16, 20, 22–24].
Анализ параметров стимулированного цикла не выявил существенной разницы в стартовой, суммарной дозах гонадотропинов и длительности стимуляции в обеих группах. В ряде работ, напротив, показано, что для стимуляции суперовуляции ВИЧ-серопозитивных женщин потребовались более высокие дозы гонадотропинов, что авторы объясняют возможной овариальной резистентностью, обусловленной негативными эффектами АРВТ на яичники [1, 5, 10, 25]. С другой стороны, Martinet и соавт. (2006) отмечает нормальную реакцию яичников на стимуляцию у ВИЧ-инфицированных без иммунодефицита [11].
У пациенток с ВИЧ-инфекцией было получено меньшее количество ооцитов (8,86±1,1 и 12,9±0,8; р=0,001), зрелых ооцитов (7,45±0,9 и 10,1±0,6; р=0,003), зигот (5,88±0,7 и 8,4±0,001; р=0,001), эмбрионов на стадии дробления (5,55±0,6 и 8,1±0,4; р=0,001) и бластоцист (2,68±0,5 и 4,4±0,4; р=0,009) по сравнению с контрольной группой. Меньшее количество полученных ооцитов у женщин с ВИЧ-инфекцией можно объяснить исходно более низким уровнем АМГ. В основной группе исследования наблюдалась высокая частота отмены лечебных циклов ЭКО/ИКСИ (13,1%) (отсутствие ооцитов, признаков оплодотворения, качество эмбрионов). В группе контроля отмена цикла была только в связи с риском развития СГЯ. По данным литературы частота отмены цикла у женщин с ВИЧ-инфекцией по сравнению с контролем составила 15,2 и 4,9% (р<0,05), что авторы связывают с неблагоприятным воздействием АРВТ на качество ооцитов [1].
Выявлена более низкая частота биохимической и клинической беременности у пациенток с ВИЧ-инфекцией по сравнению с серонегативными по ВИЧ женщинами, как в стимулированных циклах ВРТ (17,2 и 44,2%, р=0,015; 13,8 и 40,4%, р=0,014), так и в криоциклах (30 и 55,2%, р=0,049; 20 и 53,6%; р=0,008). Полученные нами данные согласуются с результатами ряда других авторов [5, 10, 14]. Напротив, в исследованиях Martinet и соавт. (2006), Santulli и соавт. (2011), Nurudeen и соавт. (2013), Prisant и соавт. (2010) показано, что частота клинической беременности у женщин с ВИЧ-инфекцией была сопоставима с контрольной группой серонегативных по ВИЧ пациенток [11, 16, 20, 24, 26, 27]. Причина низкой эффективности ВРТ остается до конца неясной. Обсуждается возможное негативное влияние АРВТ на митохондриальный потенциал ооцитов. Существует взаимосвязь между числом копий митохондриальной ДНК (мтДНК), продукцией АТФ митохондриями и качеством ооцитов, а также потенциалом развития эмбрионов. При этом показано, что ооциты с меньшим количеством копий мтДНК имеют более низкую частоту оплодотворения [28]. Негативное влияние АРВТ на ооцит подтверждается исследованиями Coll и соавт. (2006), Stora и соавт. (2016), в которых показано, что при использовании у женщин с ВИЧ-инфекцией собственных ооцитов наблюдалось снижение частоты наступления беременности, тогда как при использовании ооцитов донора этот показатель сопоставим с эффективностью программ ЭКО у женщин без ВИЧ-инфекции [5, 10].
Заключение
Таким образом, репродуктивный возраст женщин с ВИЧ-инфекцией, благополучный иммунный статус на фоне приема препаратов АРВТ позволяет им планировать беременность. Методы ВРТ обеспечивают реализацию репродуктивной функции у пациенток с ВИЧ-инфекцией, в том числе для профилактики инфицирования здорового партнера. Бесплодие у женщин с ВИЧ-инфекцией наиболее часто обусловлено трубно-перитонеальным фактором, что связано с большей частотой встречаемости ИППП, осложненных форм воспалительных заболеваний придатков матки, оперативных вмешательств на органах малого таза, внематочной беременности. В программе ЭКО/ИКСИ у женщин с ВИЧ-инфекцией отмечена более высокая частота отмены цикла, меньшее число полученных ооцитов, низкая частота наступления беременности. Необходимы дальнейшие проспективные исследования случай-контроль для понимания специфических эффектов, оказываемых ВИЧ и/или АРВТ на овариальный ответ, качество ооцитов, исходы программ ВРТ. Требуется разработка персонифицированного подхода к реализации репродуктивной функции у женщин с ВИЧ-инфекцией в программах ВРТ.



