Известно, что задержка роста и развития является универсальной реакцией плода на плацентарную дисфункцию. Перинатальная смертность при задержке развития в 3–4 раза выше таковой в популяции с нормальным развитием [1]. Встречаемость данного осложнения беременности составляет 3–22% и зависит от этнической принадлежности и региона проживания беременных [2, 3]. Задержке развития плода (ЗРП) часто сопутствует гипоксия, являющаяся причиной перинатальных повреждений центральной нервной системы (ЦНС): от минимальных мозговых дисфункций до детского церебрального паралича [4].
Согласно теории «альфы и омеги», развитие плода в условиях декомпенсированного плацентарного кровообращения является причиной развития в постнатальной жизни ряда заболеваний: гипертонической болезни, ишемической болезни сердца (ИБС), метаболического синдрома, а также ряда неврологических заболеваний [5, 6]. Тяжесть неблагоприятных постнатальных исходов, наблюдающихся в этих случаях, коррелирует со степенью недоношенности и незрелости новорожденных, родившихся в результате досрочного родоразрешения, осуществленного в интересах плода [1].
Ведущим методом антенатальной диагностики задержки роста и развития плода является ультразвуковой. Задача ультразвуковой фетометрии – выявление темпов роста плода, в том числе его замедления или прекращения. При этом долгое время считали, что важную роль в диагностическом алгоритме ЗРП играют фетометрические параметры, которые должны быть снижены в разной или равнозначной степени ниже 10 перцентиля по отношению к таковым, характерным для данного срока гестации [7, 8]. Задержка роста и развития плода обусловлена в большинстве случаев расстройствами плацентарного кровообращения. Пренатальный диагноз между ЗРП и конституционально малыми плодами (так называемыми «малыми к сроку гестации» – small for gestational age) редко представляет сложности в тех случаях, когда у плодов, задержавшихся в росте, имеются расстройства плацентарного кровообращения. Однако, как показали исследования последних лет, при задержке роста допплерометрических нарушений плацентарного кровотока может и не наблюдаться [9].
Для диагностики такой «скрытой» задержки роста и развития нужны дополнительные функциональные маркеры, характеризующие зрелость ЦНС плода, высокочувствительной к кислородной недостаточности. Одним из тестов, характеризующих координационную и интеграционную функции ЦНС плода, считают цикл активность–покой, который формируется на протяжении всего онтогенеза плода человека [10]. Отсутствие циклической организации поведения плода к 34/35 неделе, а также укорочение в цикле продолжительности спокойного состояния считают признаком, свидетельствующим о задержке функционального созревания ЦНС [11]. При этом в литературе отсутствуют данные об особенностях становления цикла активность–покой у плодов, имеющих разную степень задержки роста и развития.
Цель работы – изучить и сопоставить в III триместре беременности параметры цикла активность–покой у плодов, имеющих разную степень задержки роста, при наличии и отсутствии расстройств плацентарного кровообращения.
Материалы и методы
Анализ цикла активность–покой проведен у 43 плодов женщин в 34/35 недель беременности – срок формирования в физиологических условиях цикла активность–покой у плода при одноплодной беременности.
Критерии включения в исследование: одноплодная беременность, 34/35 недель гестации, фетометрические показатели или предполагаемая масса плода ниже 10 перцентиля для данного срока беременности. После родов степень тяжести гипотрофии оценивали согласно центильным таблицам Дементьевой Г.М. и соавт. (1984) [12].
По данным ретроспективной оценки беременные были разделены на 2 группы: 1-я группа (n=33) – пациентки, имевшие нарушения гемодинамики в функциональной системе мать–плацента–плод; 2-я группа (n=10) – беременные, не имевшие нарушений плацентарного кровотока. Степень гемодинамических нарушений в магистральных артериях функциональной системы мать–плацента–плод оценивали по классификации Павловой Н.Г. и соавт. (2007) [7], где I степень – нарушение маточно-плацентарного или плодово-плацентарного кровотока; II степень – сочетание нарушений маточно-плацентарного и плодово-плацентарного кровотока; III степень – централизация плодово-плацентарного кровотока с его перераспределением в сторону жизненно важных органов. Плоды, имевшие критические нарушения в магистральных артериях плодово-плацентарной циркуляции, в нашем исследовании отсутствовали, поскольку к 34/35 неделе такие беременные, как правило, были родоразрешены.
Всем пациенткам проводили ультразвуковое исследование (УЗИ), включающее фетометрию, допплерометрию в основных артериях функциональной системы мать–плацента–плод. Помимо определения стандартных индексов, характеризующих резистентность сосудов (индекс резистентности, пульсационный индекс), проводили расчет церебро-плацентарного отношения (ЦПО).
Изучение цикла активность–покой проводили методом визуальной оценки 90-минутных кардиотокограмм, полученных на аппарате Sonicaid Team Care, Oxford (Великобритания). Определяли наличие цикла активность–покой, а также длительность в нем спокойного состояния в минутах. В период активного состояния плода оценивали: базальную частоту сердечных сокращений, амплитуды осцилляций сердечного ритма (СР) и моторно-кардиального рефлекса (МКР).
Статистическую обработку материала проводили на ЭВМ с помощью программных пакетов Microsoft Office 2007, SPSS 17.0. Описание количественных данных представлено в виде медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1;Q3). Для выявления возможной связи между показателями проводили корреляционный анализ с определением коэффициента корреляции Спирмена. Для проверки гипотезы о нормальности распределения применялся критерий Шапиро–Уилка. U-критерий Манна–Уитни был выбран с целью обнаружения различий между выборками. При уровне значимости p<0,05 результаты считались статистически значимыми.
Результаты
Частота выявления гипотрофии новорожденного у пациенток 1-й группы, имевших в III триместре беременности нарушения кровообращения в магистральных артериях функциональной системы мать–плацента–плод, представлена в табл. 1.

Из табл. 1 следует, что расстройства маточно-плацентарного кровотока наблюдались у 84,8% (n=28) женщин, имевших допплерометрические нарушения плацентарной гемодинамики. При этом у 42% (n=12) из них расстройства маточно-плацентарного кровотока сочетались с нарушениями плодово-плацентарной гемодинамики. У 15% (n=5) беременных маточно-плацентарный кровоток не страдал, однако имелись стойкие нарушения кровообращения в артериях пуповины, не исчезающие при изменении положения тела пациентки на бок/полубок.
У беременных 2-й группы (n=10), родивших детей с гипотрофией, в III триместре беременности нарушений плацентарной гемодинамики не было. Однако после рождения у одного ребенка из женщин этой группы была выявлена гипотрофия III степени, у 2 новорожденных – II степени, а у 7 – I степени. Пренатальные фетометрические показатели у новорожденного, имевшего III степень гипотрофии, были ниже 3 перцентиля. Роды произошли на 37-й неделе беременности плодом массой 1770 г, ростом 44 см. Аналогичные фетометрические показатели (меньше 3 перцентиля) наблюдались у всех новорожденных, родившихся на 37-й неделе с гипотрофией II степени (масса1 – 2310 г, рост1 – 45 см; масса2 – 2440 г, рост2 – 46 см). Из 7 новорожденных, родившихся с гипотрофией I степени, данные фетометрии в III триместре беременности были меньше 3 перцентиля только у 4 плодов, а остальные соответствовали показателям ниже 10 перцентиля для срока беременности.
Таким образом, в нашем исследовании почти у четвертой части женщин, имевших гипотрофию плода, нарушения плацентарного кровообращения в III триместре отсутствовали, при этом у ⅓ из них была выявлена гипотрофия II–III степени при рождении.
Поскольку задержка созревания функциональных систем, и прежде всего ЦНС, у плода сочетается с задержкой его роста, а иногда предшествует ей, проведен анализ наличия цикла активность–покой, а также продолжительности в нем активного и спокойного состояний у плодов обеих групп женщин в 34/35 недель. Установлено, что к 34/35 неделям беременности цикл активность–покой не сформировался у 66% плодов (n=22) женщин 1-й группы и у 60% (n=6) беременных 2-й группы. Проведено сопоставление продолжительности спокойного состояния, амплитуд осцилляции СР и МКР у плодов пациенток 1-й и 2-й групп, имевших к 34/35 неделям фазы цикла активность–покой.
Для сравнения были использованы данные, полученные в наших предыдущих исследованиях при обследовании плодов относительно здоровых женщин в III триместре беременности [13].
Из табл. 2 видно, что у плодов 1-й и 2-й групп продолжительность спокойного состояния в цикле активность–покой была практически равнозначно уменьшена на 42,3 и 39,9% соответственно по отношению к таковой у плодов здоровых женщин при физиологической беременности. Помимо этого, у плодов женщин 1-й и 2-й групп наблюдались более низкие амплитуды СР и МКР (на 45 и 57%, а также на 18,7 и 19,8% соответственно). У половины плодов женщин 1-й и 2-й групп, имевших активное и укороченное спокойное состояние, была выявлена гипотрофия II и III степени. У остальных – гипотрофия I степени.
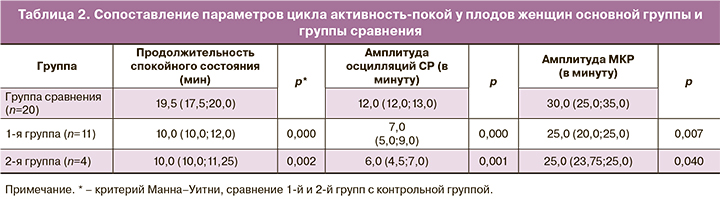
Корреляционный анализ подтвердил, что тяжесть гипотрофии новорожденного имеет прямую зависимость от степени нарушения гемодинамики, если таковое имеется (r=0,36; p=0,037). Установлено, что чем тяжелее наблюдались расстройства плацентарного кровообращения, тем реже формировался цикл активность–покой у плодов (r=-0,39; p=0,021). При этом отсутствовала корреляционная зависимость между присутствием фаз цикла активность–покой и степенью тяжести гипотрофии при наличии и отсутствии нарушений плацентарной гемодинамики (r1=–0,21, p1=0,15; r2=–0,13, p2=0,71 соответственно). Однако выявлена обратная корреляционная зависимость между продолжительностью спокойного состояния в цикле активность–покой и степенью тяжести гипотрофии новорожденного (r=–0,35; p=0,05).
Таким образом, нарушение формирования цикла активность–покой у плодов может наблюдаться как при наличии, так и при отсутствии нарушений плацентарного кровообращения, а также при разных степенях задержки роста плода, в том числе самых минимальных. Вместе с тем продолжительность спокойного состояния в цикле определяется тяжестью гипотрофии.
Обсуждение
Задержка роста и развития плода, занимающая одно из ведущих мест в структуре перинатальной заболеваемости и смертности, до настоящего времени является дискуссионным вопросом современной перинатологии. Данное осложнение беременности является вторым по частоте в структуре причин перинатальной смертности [14]. Ее высокая частота наблюдается в условиях гипоксии на фоне плацентарной дисфункции, что сопровождается нарушением развития органов и систем плода и их функционального созревания. Особенно страдают кислород-зависимые системы, такие как ЦНС.
В нашем исследовании у большинства женщин имелись нарушения только маточно-плацентарного кровотока, развившиеся на фоне увеличения периферического сопротивления сосудов, обусловленного неполной инвазией трофобласта в спиральные артерии. Более ¾ новорожденных этих женщин родились с гипотрофией I и II степени. Если же наблюдалось сочетание расстройств маточно-плацентарной и плодово-плацентарной гемодинамики, обусловленной уменьшением васкуляризации терминальных ворсин, более чем ⅔ новорожденных имели гипотрофию III степени. При централизации плодово-плацентарного кровообращения более 80% плодов имели тяжелую задержку роста (II и III степень). Корреляционный анализ подтвердил, что чем более значимыми были пренатальные нарушения плацентарной гемодинамики, тем тяжелее была гипотрофия у новорожденного (r=0,36; p=0,037). Такие же данные были получены многими другими исследователями, в том числе Е.В. Тимохиной [15] и Ю.В. Копыловой [16].
Н.Г. Павловой [13] было установлено, что максимальные изменения показателей сердечного ритма плода в сторону снижения амплитуд осцилляции СР и МКР, а также параметров цикла активность–покой в сторону укорочения спокойного состояния и удлинения продолжительности промежуточного состояния было у тех плодов, которые в раннем неонатальном периоде имели диссоциированную задержку становления тонических и рефлекторных реакций. Наше исследование подтвердило, что чем тяжелее были расстройства плацентарного кровообращения, тем реже у плода формировался цикл активность–покой (r=–0,35; p=0,05). В тех случаях, когда это все же наблюдалось, уменьшалась продолжительность спокойной фазы (р=0,01)
В нашем исследовании отдельный интерес представляли женщины, у которых при беременности отсутствовали нарушения плацентарного кровообращения, но сформировалась задержка роста и развития плода, подтвердившаяся при рождении. Исследование носило ретроспективный характер, поэтому мы анализировали так называемые «скрытые» пренатальные маркеры, характеризующие задержку роста и развития плода. Однако хорошо известно, что в клинической практике на пренатальном этапе при отсутствии нарушений плацентарного кровотока дифференциальный диагноз между малыми к сроку гестации плодами и плодами, имеющими задержку роста, долгое время представлял предмет дискуссии. Имеются данные, что у таких плодов увеличивается риск мертворождения, неонатальной смертности, оценки по шкале Апгар менее 4 баллов на 5-й минуте жизни [17].
В настоящее время закончено многоцентровое исследование – Delphi протокол (2016), который обобщает единичные или множественные высокоинформативные маркеры задержки роста и развития плода при раннем (до 32 недель) и позднем (после 32 недель) ее формировании [18]. Согласно протоколу, если отсутствуют нарушения плацентарного кровотока, задержка роста устанавливается при предполагаемой массе плода менее 3 перцентиля для данного срока беременности. В нашем исследовании такие фетометрические параметры наблюдались только у 70% плодов 2-й группы женщин. Остальные 30% плодов женщин этой группы имели фетометрические параметры между 5 и 10 перцентилями по отношению к сроку беременности. Следовательно, для уточнения диагноза следовало исключить феномен централизации мозгового кровотока. Bakalis S. и соавт. [19] установили, что неблагоприятные перинатальные исходы наблюдались при предполагаемой массе плода менее 3 перцентиля по отношению к сроку беременности и централизации мозгового кровотока даже при неизмененном кровотоке в артерии пуповины, что обусловлено низкой толерантностью этих плодов к родовому стрессу. В нашем исследовании у 3 плодов (2-я группа), родившихся с гипотрофией II и III степени, при нормальной резистентности артерий пуповины ЦПО составляло менее 5 перцентили. Однако все эти плоды имели массу менее 3 перцентили и уже были включены в группу из 7 плодов, у которых была диагностирована задержка роста и развития на основании данных фетометрии.
В исследованиях Figueras F. и соавт. [20] было показано, что у малых к сроку плодов при нормальных допплерометрических значениях в артерии пуповины могут наблюдаться неблагоприятные перинатальные исходы, в том числе неврологические.
В нашем исследовании у 3 плодов женщин 2-й группы фетометрические показатели находились между 5–10 перцентилями. Вместе с тем при рождении они были оценены как имеющие гипотрофию I степени. Следовательно, эти плоды не попали в алгоритм, предложенный Delphi протоколом, и для их пренатального выявления необходим дополнительный диагностический подход.
Известно, что задержка развития и роста плода является наиболее частой причиной нарушения становления ЦНС. На протяжении всего онтогенеза человека наблюдается формирование цикла активность–покой, а его нарушения свидетельствуют о задержке созревания координационной и интеграционной функций [9].
В нашем исследовании установлено, что задержка роста и развития плода сопровождается нарушением становления цикла активность–покой. Только у ⅓ таких плодов к 34/35 неделям беременности cформировался цикл активность– покой, однако задерживалось его становление. Так, у плодов 1-й и 2-й групп женщин продолжительность спокойного состояния была уменьшена на 42,3 и 39,9% соответственно по отношению к таковой у плодов здоровых женщин. У них наблюдались сниженные амплитуды МКР и осцилляции СР по сравнению с плодами здоровых женщин при физиологической беременности (на 18,7 и 19,8%; 45 и 57% соответственно). Однонаправленные результаты были получены Павловой Н.Г. [13] в предыдущих исследованиях.
Анализ наличия цикла активность–покой у 3 плодов женщин 2-й группы, не попавших в алгоритм Delphi протокола, показал, что этот цикл у них в 34/35 недель отсутствовал. Этот факт свидетельствует о задержке созревания координационной и интеграционной функций их ЦНС. Обнаружение этого феномена позволяет дифференцировать малых к сроку гестации плодов и плодов, задержавшихся в росте, на основании выявления задержки развития ЦНС.
Заключение
Таким образом, комплексный подход к диагностике задержки роста и развития плода, основанный на фетометрических, допплерометрических и дополнительных функциональных методах, включающих циклическую организацию функциональных состояний плода, позволяет осуществить пренатальную дифференциальную диагностику малых к сроку гестации плодов и плодов с задержкой роста и развития, низкотолерантных к родовому стрессу. Используемый диагностический алгоритм позволит снизить перинатальную заболеваемость и смертность путем выбора своевременного срока и метода родоразрешения.



