По данным многочисленных исследований, эндометриозом страдают около 5–10% женщин репродуктивного возраста [1, 2] и до 35–50% пациенток с бесплодием [3–6].
Патогенез снижения фертильности при эндометриозе включает такие компоненты, как развитие спаечного процесса, непосредственное повреждение яичниковой ткани формирующимися кистами, что приводит к снижению овариального резерва, негативному влиянию на качество ооцитов, и, соответственно, эмбрионов, а также нарушение рецептивности эндометрия.
Согласно отчету Российской ассоциации репродукции человека в среднем у больных с бесплодием, получавших лечение методами вспомогательных репродуктивных технологий (ВРТ) в РФ в 2019 г., частота наступления беременности после проведения криопротокола составила 43,0% [7]. Высокая распространенность эндометриоза у пациенток с бесплодием заставляет искать новые подходы для повышения результативности работы с такими больными.
Более половины репродуктивных потерь связано с нарушениями в периимплантационном периоде. Имплантация, являясь уникальным биологическим феноменом, представляет собой критический этап репродуктивного процесса. Она возможна только в течение краткого периода времени, которое называется «окном имплантации». Считается, что нарушение рецептивности эндометрия в этот период или десинхронизация его взаимодействия с эмбрионом является причиной большинства случаев неэффективных попыток экстракорпорального оплодотворения (ЭКО) и других методов ВРТ [8–10].
В течение длительного времени предпринимались попытки оценить рецептивность эндометрия с помощью эхографических, морфологических, биохимических и/или иммунологических методов исследования [11–14]. Однако ни один из предложенных тестов не стал диагностически и прогностически значимым.
Как правило, рецептивное состояние эндометрия, предварительно подготовленного эстрогенами, достигается спустя 120 ч влияния на него экзогенного или эндогенного прогестерона.
В основе формирования рецептивного состояния эндометрия лежит изменение экспрессии генов под влиянием прогестерона, что приводит к комплексу морфологических и функциональных перестроек, характерных для «окна имплантации». Однако у больных эндометриозом эутопический эндометрий при нормальном гистологическом строении и отсутствии морфологических изменений отличается по своим функциональным свойствам от эндометрия здоровых женщин. Одними из патогенетических звеньев эндометриоз-ассоциированного бесплодия являются относительная локальная гиперпродукция эстрогенов и резистентность к прогестерону в результате эпигенетической регуляции активности генов [15]. Отсутствие закономерной реакции эутопического эндометрия на прогестерон может объясняться снижением количества прогестероновых В-рецепторов в эндометрии и отсутствием динамики соотношения изоформ А- и В- рецептора прогестерона, характерной для нормального менструального цикла (МЦ) у здоровых женщин, что показано в ряде исследований [15, 16]. При этом отмечено, что у женщин с более высоким содержанием рецепторов к прогестерону после проведения оперативного лечения по поводу эндометриоза наступает спонтанная беременность, в отличие от пациенток с низким количеством рецепторов [17]. Помимо изменений рецепторного аппарата эндометрия, при эндометриозе изменяется активность сигнальных молекул – IHH-COUPTFII-WNT4 прогестерон-индуцированного пути, который в норме регулирует пролиферацию и децидуализацию эндометрия, а также сигнального пути PGR-GATA2-SOX17. Фактор транскрипции GATA2 является модулятором активности 97,0% прогестерончувствительных генов, и в его отсутствие, несмотря на нормальный уровень прогестерона, активации транскрипции не происходит. Проведенные исследования показали, что при эндометриозе в эутопическом эндометрии подавляется активность GATA2 в результате метилирования, а эндометриоидные гетеротопии активно экспрессируют GATA6, приводящий эутопический эндометрий в прогестеронрезистентное состояние. Также отмечена связь между снижением концентрации FOXO1 и нарушениями механизма имплантации в связи с изменением уровня экспрессии генов, участвующих в активации клеточной инвазии, молекулярного транспорта, апоптоза, пути передачи сигналов β-катенина (CTNNB1) и прогестерона [18].
Комплекс вышеописанных механизмов может приводить к дисрегуляции рецептивности эндометрия на генетическом, эпигенетическом и молекулярном уровнях.
Результатом активного изучения геномики эндометрия стало создание метода оценки экспрессии генов в эндометрии в момент открытия «окна имплантации» – ERA-теста (Endometrial Receptivity Analysis), лаборатория Igenomix, Валенсия, Испания. В ходе проведения теста из фрагмента ткани эндометрия, полученной при пайпель-биопсии и помещенной затем в специальный раствор, выделяется РНК, далее с помощью метода NGS (Next Generation Sequencing, секвенирование нового поколения) оценивается профиль экспрессии 248 генов в эндометрии, среди которых – гены молекул адгезии, факторов роста, интегринов, сигнальных молекул и другие. В результате полученный профиль экспрессии можно отнести к рецептивной, пререцептивной или пострецептивной фазе.
Благодаря внедрению в 2009 г. ERA-теста в клиническую практику на сегодня известно, что до 30,0% женщин в популяции имеют смещенное на более раннее или более позднее время «окно имплантации» [19], что может снижать эффективность лечения методами ВРТ. Перенос эмбриона в программе ЭКО в момент времени, когда эндометрий находится в пререцептивной или пострецептивной фазе, является одной из причин повторных неудач имплантации. Так, J. Tan et al. в работе 2018 г. показали, что среди пациентов с неудачными переносами эуплоидных бластоцист в анамнезе у 22,5% пациенток по результатам ERA-теста наблюдалось смещение «окна имплантации». Специальный алгоритм анализа позволяет прогнозировать время достижения рецептивного состояния эндометрия с точностью до 6 ч и провести пациентке перенос эмбрионов согласно индивидуальному времени открытия «окна имплантации» – персонализированный перенос эмбрионов. По результатам исследований, проведение переноса эмбрионов с учетом результатов ERA-теста приводит к повышению частоты имплантации до 73,7% и продолжающейся беременности – до 54,2% по сравнению с проведением переноса размороженных эмбрионов согласно стандартному протоколу (54,2 и 41,7% соответственно) [20]. Поэтому больным с повторными неудачами имплантации для повышения эффективности лечения бесплодия рекомендуется проведение теста для оценки восприимчивости эндометрия в процессе подготовки к переносу эмбрионов.
Немногочисленные исследования посвящены изучению рецептивности эндометрия у пациенток с наружным генитальным эндометриозом (НГЭ) и аденомиозом. Согласно имеющимся данным, частота повторных неудач имплантации составила 66,6% у пациенток с аденомиозом по сравнению с 34,9% в группе контроля (р<0,001; ДИ 15,5–47,9%). По результатам ERA-теста в группе пациенток с аденомиозом частота смещения «окна имплантации» была достоверно выше (47,2%), чем в группе контроля (21,6%) (р<0,001; ДИ 8,7–42,5%). Частота наступления беременности после персонализированного переноса эмбрионов в группе с аденомиозом составила 62,5%, что указывает на смещение «окна имплантации» как на причину неудачных переносов эмбрионов у пациентов с аденомиозом [21].
Опубликованы данные о достоверном снижении количества пиноподий и экспрессии лейкемия-ингибирующего фактора в эндометрии в период предполагаемого «окна имплантации», а также повышении активности ароматазы и снижении концентрации белков HOXA10 и интегрина αVβ3 у пациенток с НГЭ [12, 22]. Однако работа M.G. Da Broi et al. (2017) [23] не подтвердила присутствие статистически достоверных различий выраженности пиноподий в эндометрии пациенток с эндометриозом и без него. Результаты исследований неоднозначны, поэтому возможность использования биохимических и морфологических маркеров для определения рецептивности эндометрия все еще обсуждается.
Пилотное исследование J.A. Garcia-Velasco et al. [24], посвященное изучению транскриптомики эндометрия у больных эндометриозом, не выявило достоверного изменения активности генов в период «окна имплантации» у таких пациенток в сравнении с контрольной группой, однако в связи с небольшим количеством случаев, включенных в исследование, продолжение работ в этой области необходимо для повышения результативности лечения эндометриоз-ассоциированного бесплодия.
Цель работы: оценить эффективность персонализированного переноса эмбрионов по результатам ERA-теста в криопротоколах у больных НГЭ.
Материалы и методы
В период с января 2020 г. по август 2021 г. на базе клиники «ВитроКлиник» ООО «ВИТРОМЕД» проведено проспективное исследование с участием 62 пациенток с бесплодием. Исследование одобрено Этическим комитетом ФГБОУ ВО ТулГУ.
Всем больным в ходе обследования была проведена диагностическая лапароскопия, по результатам которой пациентки были разделены на 2 группы: в группу исследования включены 20 пациенток с гистологически верифицированным диагнозом НГЭ II–III ст.; в группу контроля – 42 пациентки с мужским и трубно-перитонеальным фактором бесплодия и отсутствием очагов НГЭ по данным лапароскопии.
Критерии исключения из исследования: ожирение (ИМТ ≥30 кг/м2), гипоплазия эндометрия, внутриматочные синехии, гиперплазия и полипы эндометрия, пороки развития матки, миома матки с субмукозным расположением узлов и/или с размером узлов более 4 см любой локализации.
12 пациенток с НГЭ и 18 пациенток из группы контроля получали эстроген-гестагенную гормонзамещающую терапию (ГЗТ) в цикле забора биопсии для выполнения ERA-теста и в последующем цикле переноса размороженных эмбрионов по схеме: 17β-эстрадиол 3,0 мг/сут в виде трансдермального геля с 3-го дня МЦ в течение 8 дней с последующим добавлением микронизированного прогестерона в дозе 600 мг/сут интравагинально по достижении эндометрием толщины 7 мм и более. При отсутствии достаточной толщины эндометрия терапия эстрадиолом продолжалась в течение еще 4–6 дней.
У 8 больных НГЭ и 24 пациенток контрольной группы ERA-тест и перенос размороженных эмбрионов проводился в модифицированном МЦ с введением триггера овуляции (рекомбинантный хорионический гонадотропин человека, 250 мкг – препарат «Овитрель») подкожно при достижении доминантным фолликулом диаметра 17 мм.
Ультразвуковой мониторинг фолликулогенеза и состояния эндометрия выполнялся на аппаратах Canon Aplio i 800 с использованием ректовагинального датчика с центральной частотой 11 МГц в режиме «серой шкалы» на 2–3-й, 8–9-й дни МЦ, а также в день перед введением триггера овуляции или началом использования прогестерона.
При визуализации патологических изменений в эндометрии, включая его толщину менее 7 мм на день введения триггера/назначения прогестерона, пациентка из исследования исключалась.
Всем больным в день введения триггера овуляции или назначения вагинального прогестерона проводилось исследование уровня прогестерона в сыворотке крови. Критерием продолжения подготовки эндометрия и взятия биопсии для ERA-теста являлся уровень прогестерона менее 1,0 нг/мл.
Биопсия эндометрия выполнялась через 120 ч после первого применения препаратов прогестерона либо через 156 ч после введения триггера овуляции при помощи стандартного зонда «пайпель». Материал также направлялся на гистологическое исследование для исключения органических изменений эндометрия.
В качестве первичного исхода изучалась частота смещения персонального «окна имплантации» во времени относительно 120 ч влияния прогестерона на эндометрий в каждой группе пациенток. Вторичным изучаемым исходом являлась частота наступления беременности после проведения персонализированного переноса эмбрионов согласно результатам ERA-теста.
Наступление беременности оценивалось по результатам анализа крови на β-хорионический гонадотропин человека. Клиническая беременность подтверждалась наличием плодного яйца в полости матки при проведении ультразвукового исследования на 21-й день после переноса эмбрионов.
Статистический анализ
Статистическая обработка полученных данных проводилась с помощью стандартного пакета программы прикладного статистического анализа (Microsoft Excel 2010). Для оценки межгрупповых различий применяли двусторонний Т-тест. Различия между сравниваемыми группами по анализируемым признакам расценивали как статистически значимые при уровне значимости p≤0,05.
Результаты
Анализ анамнеза и клинических показателей пациенток обеих групп показал отсутствие достоверных различий между ними (таблица).
Средний возраст пациенток составил 34,4 года (от 31 до 44) – в группе больных НГЭ и 37,6 года (от 30 до 51) – в группе контроля. В группе контроля 20/42 (47,6%) больных имели трубно-перитонеальные причины бесплодия, 16/42 (38,1%) – мужской фактор, 6/42 (19,5%) – сочетание трубного и мужского факторов.
Средняя продолжительность бесплодия у пациенток обеих групп также была сопоставимой в двух группах: 4,6 (2,7) года – в группе исследования и 5,3 (3,0) года – в группе контроля. Меньшая продолжительность бесплодия у пациенток с НГЭ, вероятно, может быть объяснена более активной врачебной тактикой при ведении таких пациенток (сравнительно ранним направлением на лечение методами ВРТ).
10/42 (23,8%) пациенток из группы контроля не имели предшествовавших переносов эмбрионов, у 8/42 (19,0%) отмечено по 1 неудачному переносу эмбрионов в анамнезе. В среднем пациентки контрольной группы имели в анамнезе 2,3 переноса эмбрионов без имплантации, что значимо меньше, чем у пациенток с эндометриозом (p=0,03). У всех пациенток из группы исследования в анамнезе было не менее 3, а в среднем – 4,2 неудачных переноса эмбрионов. Эти результаты подтверждают имеющиеся литературные данные о повышении частоты встречаемости повторных неудач имплантации в группе пациенток с эндометриоз-ассоциированным бесплодием [25].
Всем больным ранее переносили эмбрионы на стадии бластоцисты, качества не ниже 2ВВ. Перенос эуплоидных эмбрионов по результатам преимплантационного генетического тестирования анеуплоидий (ПГТ-А) в анамнезе имели 8/20 (40,0%) больных из группы наблюдения (среднее число перенесенных бластоцист – 1,6) и 18/42 (42,9%) пациенток контрольной группы (в среднем 2,1 неудачных криопереноса). Статистически значимой разницы в количестве попыток и числе перенесенных эмбрионов после ПГТ-А нами не выявлено.
Уровень прогестерона в день назначения триггера овуляции или начала применения вагинального прогестерона у всех пациенток был менее 1 нг/мл. Толщина эндометрия на день назначения триггера/начала приема прогестерона составляла не менее 8,5 мм и в среднем у пациенток с НГЭ равнялась 9,8 мм, что сопоставимо с показателем толщины эндометрия в контрольной группе – 10,3 мм. Помимо толщины эндометрия, оценивалась также его структура. У всех пациенток, включенных в исследование, эндометрий перед назначением триггера овуляции или началом приема прогестерона был трехлинейным, однородным.
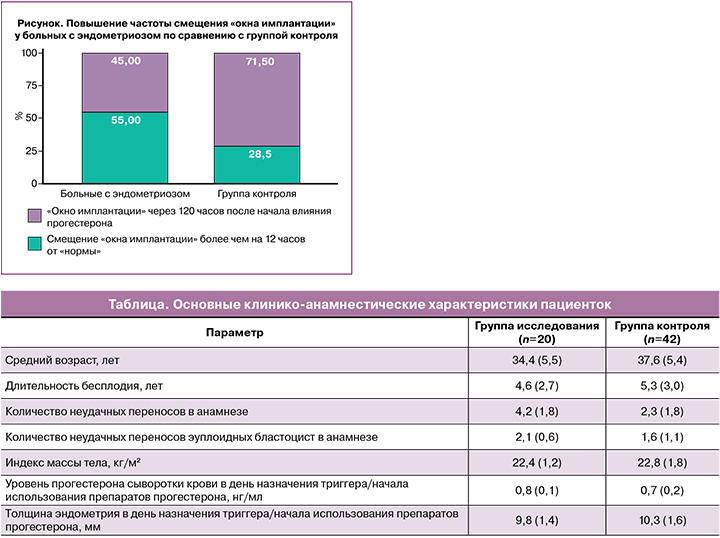
По результатам нашего исследования, среди пациентов с верифицированным диагнозом НГЭ частота случаев смещения «окна имплантации» составила 11/20 (55,0%) по сравнению с 11/42 (28,5%) в группе контроля (p=0,01) (рисунок). При этом в подгруппе больных эндометриозом, получавших в цикле биопсии ГЗТ, «окно имплантации» было смещено у 6/12 (50,0%) пациенток, а среди пациенток, которым биопсию проводили в модифицированном МЦ, – у 6/8 (75,0%). У пациенток контрольной группы в подгруппе с ГЗТ «окно имплантации» было смещено у 8/18 (44,4%), при проведении биопсии в естественном цикле – у 3/24 (12,5%).
За смещение «окна имплантации» принимались случаи, когда время достижения максимальной восприимчивости эндометрия, согласно результатам ERA-теста, отличалось на 12 ч и более от 120 ч экспозиции прогестерона (или 156 ч после введения триггера овуляции в модифицированном МЦ). Подобное смещение в клинической практике является значимым, так как в совокупности с нарушением со стороны пациентки времени начала приема препаратов прогестерона, возможным смещением времени переноса согласно расписанию работы клиники и операционной, может приводить к снижению результативности лечения.
Отклонение во времени формирования рецептивного состояния эндометрия в группе больных с НГЭ от нормальных сроков (120 ч влияния прогестерона) составляло от 12 до 19 ч. У 2/20 (10,0%) пациенток с пострецептивным профилем экспрессии биопсия не позволяла определить время формирования рецептивного состояния, что потребовало повторной биопсии, подтвердившей смещение «окна имплантации» более чем на 1 сут. Полученные результаты не противоречат имеющимся на сегодняшний день данным о том, что рецептивность эндометрия у больных эндометриозом принципиально не нарушена [26], однако более частое смещение во времени периода максимальной рецептивности эндометрия у этих пациенток представляет несомненный клинический интерес.
В течение 2–6 месяцев после получения результатов ERA-теста 19/20 (95,0%) больным НГЭ и 36/42 (85,7%) пациенткам из группы контроля был выполнен селективный перенос эмбрионов на стадии бластоцисты качества 2ВВ и выше. В анализе результатов данного исследования нами учитывался результат первого переноса, а не кумулятивная частота наступления беременности. Клиническая беременность наступила у 12/19 (63,2%) пациенток с НГЭ и у 25/36 (69,4%) пациенток группы контроля, данная разница не являлась статистически значимой (р=0,65). Еще у одной пациентки из исследуемой группы наступила биохимическая беременность. При этом перенос эуплоидных по результатам ПГТ-А бластоцист был проведен 4/19 (21,1%) пациенткам с НГЭ и 9/36 (25,0%) пациенткам группы контроля. У всех пациенток после тестирования наступила клиническая беременность. Таким образом, несмотря на имеющиеся литературные данные о снижении частоты наступления беременности (ЧНБ) в программах ВРТ у пациенток с НГЭ [27], проведение персонализированного переноса эмбрионов по результатам ERA-теста позволяет достичь у таких больных повышения ЧНБ, сопоставимой с ЧНБ в группе контроля и статистически значимо не отличающейся от нее.
Заключение
Многофакторность негативного влияния эндометриоза на женскую фертильность требует комплексного подхода к больным с данным заболеванием на всех этапах ведения, начиная от выработки тактики, определения объемов и времени оперативного вмешательства, сроков направления на лечение методами ВРТ, заканчивая подбором оптимальной схемы стимуляции и подготовки к переносу эмбрионов.
Принимая во внимание полученные результаты, в связи с высокой частотой встречаемости смещенного во времени «окна имплантации» у пациентов с эндометриоз-ассоциированным бесплодием проведение ERA-теста может быть использовано в качестве стандартной тактики подготовки к переносу эмбрионов в криопротоколе. Проведение персонализированного переноса эмбрионов, согласно результатам ERA-теста, способствует повышению частоты наступления беременности у больных НГЭ.



