Современная медикаментозная терапия начальных изменений эпителия шейки матки, ассоциированных с папилломавирусной инфекцией (ПВИ), включает большую группу иммунокорригирующих препаратов. Накопленный опыт их применения уже доказал хорошую эффективность, однако до сих пор на гинекологических форумах выбор препарата и схемы лечения вызывают бурные дискуссии, часто обусловленные богатым выбором иммуномодуляторов при «жесткой конкуренции» фармакологических компаний. Благодаря развитию лабораторных методик, позволяющих определять ДНК-вирусную нагрузку, были получены новые данные в пользу иммуномодуляторов как препаратов, способствующих сокращению вирусной нагрузки и времени персистенции вируса папилломы человека (ВПЧ) в шейке матки. В то же время рекомендуемые схемы и режимы лечения крайне разноплановые, что приводит к неадекватному сочетанию нескольких иммуномодуляторов или недостаточному дозированию препарата. Такие подходы дискредитируют метод, приводя к путанице в сознании врачей и вызывая отрицательное отношение к медикаментозной терапии у женщин с низким уровнем поражения эпителия шейки матки [1]. Одним из наиболее изученных в нашей стране и мировой практике системных иммуномодуляторов, используемых при ПВИ с целью иммунокоррекции и элиминации ВПЧ, является инозин пранобекс. По данным исследований противовирусное и иммуномодулирующеее действие препарата позволяет до 98% случаев элиминировать ВПЧ, в том числе ВПЧ высокого онкогенного риска [2]. Эффективность инозин пранобекса отмечена как при клинической, так и при субклинической форме ПВИ (остроконечных кондиломах и цервикальной интраэпителиальной неоплазии (CIN)). При CIN препарат оказывается эффективным как на ранних стадиях, в том числе в качестве монотерапии, так и на поздних стадиях – в составе комбинированной лекарственной и деструктивной терапии [3]. В комбинации с деструктивным лечением поражений шейки матки, вызванных ПВИ, препарат снижает частоту рецидивов в 3 раза [4]. Обращает внимание тот факт, что инозин пранобекс – единственный системный иммуномодулятор, официально включенный в российский Протокол ведения больных с ПВИ [5]. В отношении же продолжительности применения препарата, в качестве монотерапии при ПВИ, наблюдаются некоторые разногласия, так как данные литературы и регистрационные рекомендации допускают его применение как в течение 14 дней, так и в течение 28 дней. При этом сравнительные данные по эффективности и побочным эффектам двух предложенных схем пока отсутствуют. В этой связи в реальной клинической практике встречаются пациенты, принимающие препарат всего 7–10 дней и в низких дозировках, чего часто недостаточно для достижения эффекта.
Исходя из вышесказанного, нами была предпринята попытка изучить эффективность и переносимость препарата инозин пранобекса для лечения ВПЧ-ассоциированных начальных изменений эпителия шейки матки в 28- и 14-дневных режимах в сравнительном аспекте между собой и группой контроля.
Материал и методы исследования
Нами отобраны 128 пациенток репродуктивного возраста, имеющих цитологические признаки легкой дисплазии шейки матки и/или кольпоскопические изменения эпителия. У всех выбранных больных патология ассоциировалась с ПВИ онкогенных типов, диагностированной с помощью метода полимеразой цепной реакции (ПЦР) в реальном времени. Общими для всех пациенток критериями включения в исследование служили все перечисленные признаки:
- женщины от 20 до 50 лет с подтвержденным цитологическим диагнозом – легкая дисплазия шейки матки, или атипическими клетками неясного генеза, но с кольпоскопической картиной начальных поражений эпителия шейки матки;
- обнаружение ВПЧ-инфекции онкогенных 16 и/или 18 типов вируса в количестве ≥3 lg на 105 клеток методом ПЦР в режиме реального времени, с помощью тест-системы «Амплисенс ВПЧ ВКР Скрин-Титр FRT» [6];
- удовлетворительное общесоматическое состояние пациентки, соблюдающей адекватные меры контрацепции на период лечения;
- отсутствие противопоказаний для приема инозин пранобекса;
- информированное согласие пациентки на участие в исследовании и возможность прекращения лечения досрочно в случае побочных проявлений или других причин, при устном отказе больной.
Критериями исключения служил один из нижеперечисленных признаков:
- наличие противопоказаний к приему инозин пранобекса;
- выявление серьезных сопутствующих заболеваний с нарушением функции печени, почек, гемопоэза;
- беременность или кормление грудью;
- любые интеллектуальные или другие нарушения, влияющие на способность адекватно дать согласие или следовать процедурам, предусмотренным протоколом;
- прием любых иммуномодулирующих или нефротоксичных препаратов за три месяца до начала исследования.
Все пациентки были разделены на 3 группы: больные из 1-й группы (n=48) получали инозин пранобекс (изопринозин, ООО Тева) 28 дней; из 2-й группы (n=41) получали инозин пранобекс 14 дней, а контрольная группа (3-я) состояла из 39 женщин, находящихся под динамическим наблюдением, без медикаментозного лечения. Инозин пранобекс назначали в стандартной дозировке: 1 таблетка (500 мг) на 10 кг веса больной, обычная суточная доза 6–8 таблеток, с разделением ее на 3 приема. Контроль групп женщин, получавших инозин пранобекс, проводился через 3 и 6 мес, при этом итоги были подведены по результатам 6 мес контроля, так как этот период был установлен для группы наблюдения. Оценка эффективности лечения также, как и первичная диагностика, включала несколько методов: кольпоскопический динамический контроль изменений эпителия; цитологическое исследование мазков с экто- и эндоцервикса, а также определение динамики изменений по ВПЧ (ДНК) нагрузке. В качестве метода для выявления клинически значимой концентрации вируса и количественного определения его ДНК выполнялась ПЦР в режиме реального времени, тест-система «Амплисенс ВПЧ ВКР Скрин-Титр FRT». Преимуществом методики является возможность совмещения двух тестов: детекции и количественного определения специфической ДНК 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59-го типов ВПЧ, при концентрациях не менее 5*103 копий/мл [6].
Кольпоскопия с регистрацией изображений и сравнение их в динамике производилась с использованием кольпоскопа Leisecap. Основные начальные изменения эпителия шейки матки имели картину воспаления с «небольшой пунктацией или рисунком в виде полей, петель, колец», на которые мало действует уксусная кислота (максимально – «нежная ацето-белая реакция»). Также могли обнаруживаться небольшие фрагменты йод-негативных участков, свидетельствующие о незрелости эпителия. Переносимость инозин пранобекса и субъективное отношение к лечению оценивалось в сравнительном аспекте между группами, по результатам анкетирования больных. Статистическая обработка данных проводилась с учетом коэффициента t-критерия Стъюдента.
Результаты исследования
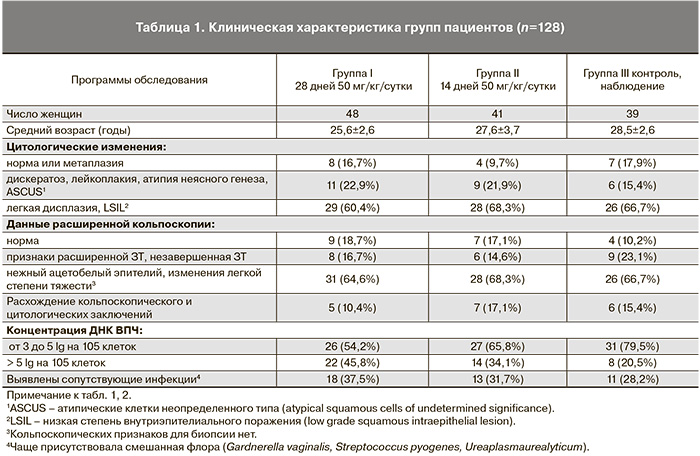
Начальные ВПЧ-ассоциированные поражения эпителия шейки матки чаще встречались у молодых женщин, средний возраст составил 28,5±4,3 года (табл. 1). По исходным сравниваемым характеристикам отобранные группы были практически однородны. По данным цитологического обследования у 64,8% женщин определялась легкая дисплазия эпителия (LSIL), у 35,2% обнаружены атипичные клетки неясного генеза (ASCUS) и кольпоскопические начальные признаки поражения эпителия. У всех больных, включенных в исследование, определялась клинически значимая ДНК вирусов, более 3 lg на 105 клеток человека. Расхождение кольпоскопического и цитологического заключений имелось у 14% больных, что можно связать с наличием признаков вульвовагинита или бактериального вагиноза (БВ) или с разным типом зоны трансформации (ЗТ). Как известно, при ЗТ I типа частота расхождений диагнозов минимальна, а при ЗТ III типа недостаточной визуализации разночтения достигают 42% [7]. С учетом влияния признаков БВ на кольпоскопическую и цитологическую картину такие женщины дополнительно получали местное лечение нео-пенотраном в течение 7 дней. Также необходимо отметить, что у 34,4% больных определялся высокий титр ДНК – более 5 lg на 105 клеток человека, что по данным многих авторов свидетельствует о неблагоприятном прогнозе – персистенции вируса [8].
Среди больных репродуктивного возраста с признаками ВПЧ-ассоциированных начальных изменений эпителия шейки матки, принимавших инозин пранобекс 14 или 28 дней, при контрольном осмотре через 6 месяцев цитологическая норма была выявлена в 67,4% случаев, а в группе контроля – в 35,9%, различия в группах достоверны (р<0,05). При этом лучшие результаты получены в группе при 28-дневном режиме лечения, цитологическая норма – 77,1%, в то время как при 14-дневном режиме – лишь 56,1% (табл. 2). Такая же тенденция наблюдалась и при оценке кольпоскопической картины, где после проведения медикаментозной терапии положительная динамика отмечена у 80,9% пациенток, в сравнении с группой контроля (59%) это достоверно лучший результат (р<0,05). Молекулярный контроль по ДНК ВПЧ нагрузке показал снижение вирусной нагрузки или элиминацию вируса после лечения у 77 (86,5%) женщин. Сравнивая этот критерий, мы отметили преимущество 28-дневного курса лечения, так как в этой группе пациенток через 6 мес вирус не обнаружен у 93,7% женщин, а в группе 14-дневного лечения – у 78,0%. Необходимо отметить, что за 6 мес самостоятельная элиминация вируса зафиксирована и без лечения у 43,6% пациенток, что связано с естественным жизненным циклом вируса и активацией собственной иммунной системы. Однако скорость и эффективность противовирусной защиты была достоверно лучше в группах женщин, принимавших инозин пранобекс (р<0,05). В нашем исследовании не было ни одного случая отказа от медикаментозного лечения, это еще раз подтверждает хорошую переносимость препарата, даже пролонгированного 28-дневного режима. Безусловно, такая высокая комплаентность достигалась тщательной работой с женщинами, объяснением им цели и задач терапии.
У всех больных, у которых через 6 мес наблюдения имелись цитологические или кольпоскопические признаки аномального эпителия и определялась ПВИ, мы применили деструктивные методы лечения, в основном методом петлевой эксцизии ЗТ (LEEP/LLETZ) (табл. 3).
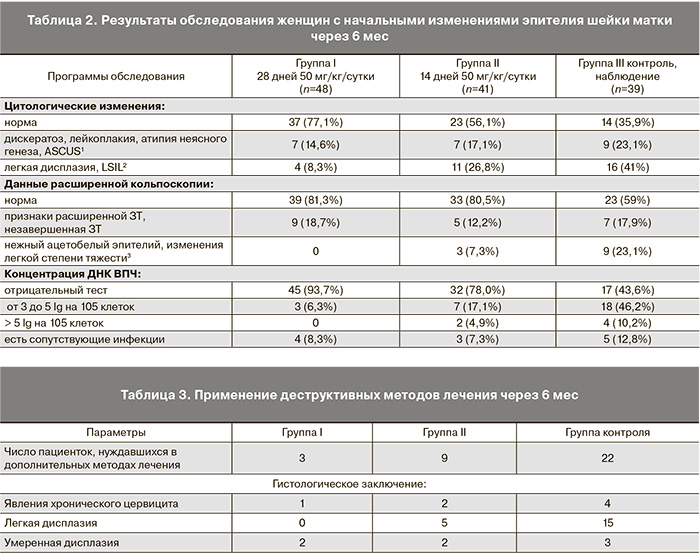
Выявление у части пациенток гистологического подтверждения более тяжелого повреждения эпителия может свидетельствовать об ошибке первичной диагностики, обычно связанной с одновременным присутствием эпителиальных повреждений разной степени тяжести, или о прогрессировании болезни.
Обсуждение
Современные данные о жизненном цикле онкогенных типов ВПЧ демонстрируют угнетение местного иммунитета за счет иммуносупрессивных свойств вирусных белков. Например, Е5 блокирует антиген-презентативную функцию макрофагов, что снижает сигнал к производству основных цитокинов (интерферонов и интерлейкина 2), необходимых для работы врожденного иммунитета. Также вирусные белки за счет блока экспрессии индоламина 2, 3-диоксигеназы (IDO) и ингибирования экспрессии E-кадгерина снижают активность клеток Лангерганса и их способность выполнить презентацию вирусного антигена. В этом случае, даже достигнув лимфатических узлов, макрофаги не стимулируют эффекторные Т-клетки против вируса [9]. Такой эволюционно-выработанный механизм самозащиты позволяет вирусу существовать в эписомальной фазе достаточно длительный период, требуемый для количественного синтеза онкогенных белков Е6/Е7 [3].
При активации системы врожденного иммунитета и его нормальной работе клетки с эписомальной формой ВПЧ уязвимы для Т-киллеров. Механизмы «ухода» ВПЧ от иммунной системы, а также известное иммуносупрессивное действие ВПЧ обусловливают целесообразность применения и эффективность иммуномодуляторов.
Наш выбор иммуномодулятора основывался на клиническом опыте применения инозин пранобекса, который показал, что препарат имеет широкий спектр противовирусной активности, в том числе в борьбе с симптомами подострого склерозирующего панэнцефалита, при ПВИ, остроконечных кондиломах вульвы и влагалища [10–12]. Инозин пранобекс может задерживать прогрессирование ВИЧ-инфекции [13] и быть использован в качестве иммунорегуляторного средства для лечения иммунопатологических заболеваний, таких как ревматоидный артрит [14] и гнездная алопеция [15]. Современное изучение фармакокинетических характеристик инозин пранобекса на группах добровольцев показало его рациональную фармакодинамику и безопасность клинического применения в дозировках до 100 мг/кг веса [16].
Преимущество препарата перед другими иммуномодуляторами состоит в том, что он обладает иммуномодулирующим действием в отношении различных звеньев иммунитета, нормализует функциональные способности клеток [13]. Наличие у него прямого противовирусного действия, связанного с нарушением транскрипции и репликации вирусных белков, позволяет снижать вирусную нагрузку, что при одновременной нормализации функциональной активности макрофагов приводит к ускорению элиминации ПВИ. Наши данные показали, что эффективность инозин пранобекса зависит от длительности курса и при 28-дневном режиме позволяет достигать элиминации вируса у 93,7% больных в течении 6 мес. По данным литературы, среднее время самостоятельной элиминации вируса при хорошей работе иммунной системы достигается в среднем за 368–384 дня [17].
Необходимо отметить, что выбор данного режима лечения для выполненного клинического протокола был обусловлен накопленным клиническим опытом применения препарата. По данным многих авторов, истинное неэффективное лечение иммуномодуляторами не превышает 8–12% наблюдений, что, возможно, связано с другими проблемами вторичных иммунодефицитных состояний, например с генетическими особенностями HLA-антигена. До проведения исследования из собственной клинической практики мы анализировали случаи, когда женщина имела неудачный опыт применения инозин пранобекса, то есть вирус и изменения эпителия определялись как до, так и после лечения. В основном таким пациенткам назначался неправильный режим, короткие курсы или имел место низкий комплаенс. Дозировки препарата 1,5–2 г/сут, сокращение времени его приема до 1 недели, а также его применение при умеренной и тяжелой дисплазии без деструктивных методов лечения не имели эффекта, а в дальнейшем способствовали недоверию пациентки врачу. Приходится констатировать тот факт, что в клинической практике приверженность женщин с ПВИ к медикаментозному лечению в 20–30% случаев остается неудовлетворительной и в подавляющем большинстве случаев проблема заключается в отсутствии эффективной коммуникации «врач – пациент» [18].
Заключение
Текущее понимание особенностей существования ВПЧ в эпителии шейки матки, процесса развития ПВИ, вероятности ее регресса и прогрессирования определяет тактику терапии начальных повреждений шейки матки, ассоциированных с ВПЧ. По нашему опыту инозин парнобекс может быть рекомендован как препарат, используемый в режиме монотерапии, для лечения начальных поражений эпителия шейки матки (ASCUS, LSIL). Препарат показал эффективность и хорошую переносимость как 14-дневного, так и 28-дневного режима лечения, из расчета 500 мг (1 таб.) на 10 кг веса больной в сутки. Поиск оптимальных схем терапии показал преимущество 28-дневной схемы. Такой подход демонстрирует необходимость активной тактики при ведении пациенток с начальными поражениями эпителия шейки матки, ассоциированных с ВПЧ. Полученные различия в результатах лечения инозин пранобексом в зависимости от продолжительности курса демонстрируют важность соблюдения приверженности пациенток к рекомендованной врачом терапии.



