В последние годы в фокусе научного интереса находятся исследования, посвященные изучению внутриутробно программируемых заболеваний человека. Течение беременности и родов у матери оказывает определяющее влияние на становление репродуктивного здоровья девочки [1–3]. Известно, что нарушение менструальной функции, в частности аномальные маточные кровотечения пубертатного периода (АМК ПП), чаще формируются у девочек, рожденных от матерей, беременность которых протекала на фоне привычного невынашивания, преэклампсии и хронической фето-плацентарной недостаточности с исходом в синдром задержки внутриутробного роста плода (СЗРП) [2, 4, 5]. Пусковым механизмом патогенеза этих акушерских осложнений является синдром эндотелиальной дисфункции [6–8].
Доказана роль генетического полиморфизма эндотелиальной NO-синтазы (NOS3) в развитии преэклампсии и плацентарной недостаточности [9–11]. Поэтому логично предположить, что девочки, рожденные с СЗРП от матерей, чья беременность протекала на фоне синдрома эндотелиальной дисфункции с исходом в преэклампсию и фетоплацентарную недостаточность, унаследовали определенный полиморфизм генов, регулирующих функцию эндотелиальной системы. Фенотипически эндотелиальная дисфункция у этих девочек может реализоваться в развитие АМК ПП, связанных с нарушением баланса тканевых эндотелиальных факторов, сосудистого тонуса, ангиогенеза и локального гемостаза в эндометрии [12].
На сегодняшний день среди полиморфизмов гена эндотелиальной NO-синтазы наиболее изученными являются функционально связанные полиморфизмы: 894 G/T (rs1799983), 786 T/С (rs2070744). Данные литературы подтверждают важную роль этих полиморфизмов в увеличении чувствительности к сердечно-сосудистым заболеваниям (ишемической болезни сердца, инфаркту миокарда, преэклампсии, гипертензии, инсульту), а также в генезе других заболеваний (инсулинорезистентность, сахарный диабет) [13, 14].
Одними из важнейших регуляторов эндотелиальной функции являются эстрогены. Они оказывают влияние на сосудистую систему и микроциркуляцию, активируя высвобождение оксида азота (NO), простациклина, гиперполяризационного фактора эндотелия, а также уменьшая высвобождение сосудосуживающих субстанций, таких как эндотелин I и ангиотензин II [15–17]. Биологический эффект эстрогенов реализуется через специфические ядерные и мембранные негеномные рецепторы, локализованные в эндотелии и гладкомышечных клетках сосудов. Описаны два типа рецепторов эстрогенов – ERα и ERβ, которые относятся к суперсемейству ядерных рецепторов стероидных гормонов. Для эндотелиальной ткани наибольшее значение имеет передача сигнала через рецептор ERα [18].
Ген эстрогенового рецептора ERα (ESR1) расположен на хромосоме 6q25. Он состоит из 8 экзонов, 7 интронов и занимает более чем 140 кб. В этом гене были обнаружены несколько полиморфизмов. Наиболее широко изученными являются PvuII (T397C), XbaI (C351G) (RFLPs – restriction fragment length polymorfisms) в первом интроне и вариабельное число тандемных повторов (VNTR) (ТА) n в промоторе [14, 19].
Молекулярные механизмы, благодаря которым эти полиморфизмы влияют на активность рецепторов, остаются малопонятными. ESR1 PvuII полиморфизм может влиять на экспрессию гена ESR1, изменяя связывание транскрипционных факторов [20] и влиять на сплайсинг гена ESR1. Стало известно, что некоторые из протективных эффектов эстрогенов на сосуды реализуются через негеномный механизм, включая пути активации: ras, raf, MEK (mitogen-activated protein kinase kinase), MAPK (mitogen-activated protein kinase), и phosphatidyl-inositol-3-kinase/Akt. Таким образом, активируется эндотелиальная NO – синтаза (NOS3) в совокупности с геномным эффектом эстрадиола на синтез NO [21, 22].
Остаются малоизученными вопросы межгенных взаимодействий полиморфных вариантов генов эндотелиальной NO-синтазы и генов рецепторов к эстрадиолу при целом ряде заболеваний, в том числе репродуктивной системы. Подобных работ в отечественной и зарубежной литературе встречается не много, и проблема требует дальнейшего изучения.
Цель работы – изучение ассоциаций полиморфизмов генов NOS3 и ESR1 у девочек, рожденных с внутриутробной задержкой роста, страдающих АМК ПП.
Материал и методы исследования
Обследованы 96 девочек-подростков, страдающих с менархе АМК ПП. Из них 32 девочки, рожденные доношенными с СЗРП и 37 девочек, рожденных в доношенном сроке с нормальной массой тела. Контрольную группу составили 27 здоровых девочек.
Критерий включения пациенток в основную группу – оценка физического развития при рождении менее 10 перцентили по массо-ростовым показателям. Срок беременности на момент рождения составлял 37 недель и более. Группы девочек были сопоставимы по паритету матерей, сроку и способу родоразрешения.
Исследование проводилось с согласия девочек-подростков и их родителей, в присутствии родителей по желанию девочек.
У всех пациенток были изучены полиморфизмы гена NOS3 786T>C, 894G>T и полиморфизмы гена ESR1 351A>G (полиморфизм Xbal, VNTR – variable note of tandems repiet) и 397T>C (полиморфизм Pvull, RELPs – restriction fragment length polymorphism). Для генотипирования исследовали венозную кровь. ДНК выделяли с помощью реагентов «Проба ГС-Генетика» (ООО «НПО ДНК-Технология») из 0,5 мл крови, взятой в пробирку с ЭДТА в качестве антикоагулянта.
Для оценки количества выделенной геномной ДНК использовали набор реагентов «КВМ» контроля взятия материала для метода полимеразной цепной реакции (ПЦР) (НПО «ДНК-Технология», Россия). В исследование брали не менее 1,0 нг геномной ДНК на реакцию. Генотипирование образцов по аллельным вариантам исследуемых генов проводили методом аллель-специфичной ПЦР в «режиме реального времени» со снятием кривых плавления продуктов амплификации. Анализ результатов ПЦР проводили в автоматическом режиме программного обеспечения детектирующего амплификатора ДТ-96 (НПО «ДНК-Технология», Россия).
Статистический анализ данных осуществлялся с помощью пакета прикладных программ Statistica 7.0. Результаты обрабатывались методами вариационной статистики и представлены в виде M±m. Оценка достоверности различий средних величин и относительных показателей проводилась с использованием t-критерия (критерия Стьюдента). За уровень значимости в исследовании принято р<0,05. Различия между непараметрическими переменными проводилось при помощи χ2 Пирсона (Person). Относительный риск оценивали по показателю соотношения шансов (oddsratio, OR) с 95% доверительным интервалом (95% CL). Нулевая гипотеза отвергалась при р≤0,05.
Тест на соответствие распределения генотипов закону Харди–Вайнберга в обеих выборках проводили с помощью критерия χ2 с использованием программы Hardy–Weinberge quilibrium.
Результаты исследования
Средний возраст обследованных девочек, страдающих аномальными маточными кровотечениями пубертатного периода (АМК ПП), рожденных с нормальной массой тела составил 14,18±0,31 года, рожденных с СЗРП- 13,50±0,24 года, в контроле – 14,61±0,41 года, р>0,05. Группы сопоставимы по возрасту.
Девочки, рожденные с СЗРП, к моменту пубертатного периода имели достоверно более высокий индекс массы тела, граничащий с нормой (девочки с СЗРП – 24,3±1,89 кг/см2 в сравнении с девочками без СЗРП – 22,19±1,32 кг/см2, р=0,04; и в сравнении с контролем 20,05±1,71 кг/см2, р=0,008) и массу тела (девочки с СЗРП – 63,03±2,91 кг в сравнении с девочками без СЗРП – 57,81±1,34 кг, р=0,01; и в сравнении с контролем 55,2±1,83 кг, р=0,03), но при этом наименьший рост по сравнению с контрольной группой (девочки с СЗРП – 161,06±1,85 см в сравнении с контролем – 164,0±2,1 см, р=0,02). Это подтверждает теорию о внутриутробном программировании некоторых заболеваний у людей, рожденных с низкой массой тела, и в первую очередь – ожирения [23].
Соматически девочки, страдающие АМК ПП, имели акцентуированный инфекционный фон (частые респираторные инфекции, ангины, воспаления среднего уха и гайморовых пазух носа) – в 46,2% случаев, против 14,3% в контроле, р<0,05. Все девочки основной группы страдали вегето-сосудистой дистонией, в контроле – 12,0% пациенток, синдром дисплазии соединительной ткани определялся у 81,8% девочек основной группы и у 10% контрольной. Патологию щитовидной железы имели 4,5% девочек с АМК ПП, в контрольной группе – нет. К распространенной соматической патологии у девочек, страдающих АМК ПП, относят заболевания желудочно-кишечного тракта – 40,2% девочек основной группы, в группе контроля – не выявлено. Следует отметить, что все девочки с АМК ПП страдали железодефицитной анемией различной степени тяжести, а у 9,6% девочек отмечалась тромбоцитопения. В контроле показатели красной крови и уровня тромбоцитов были в пределах нормальных значений.
У девочек, страдающих АМК ПП, отмечалось раннее менархе – в 10,88±0,31 года в основной группе с СЗРП и 11,73±0,20 года – без СЗРП, в отличие от группы контроля – в 12,4±0,51 года, р<0,01. У 85,5% девочек основной группы с СЗРП менархе дебютировало с развития АМК, и в 57,4% случаев эта патология носила рецидивирующий характер.
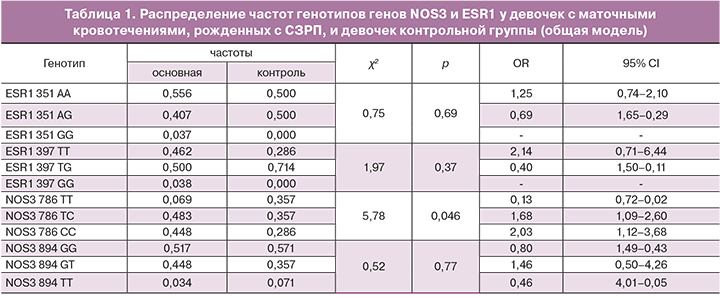
Результаты генотипирования показали, что характер распределения аллелей и генотипов по полиморфным вариантам гена NOS3 и ESR1 одинаков в обеих группах и соответствует равновесию Харди–Вайнберга.
Возможное влияние особенностей генотипа на функциональное состояние эндотелия оценивалось по общей, мультипликативной и доминантной моделям.
Анализ распределения генотипов по полиморфным вариантам генов NOS3 и ESR1 (табл. 1) показал достоверное увеличение частоты встречаемости генотипов, содержащих полиморфную аллель 786С гена NOS3Т>С в гомо- и гетерозиготном состоянии у девочек с маточными кровотечениями, рожденных с СЗРП (для гомозигот OR=2,03; 95% CI 1,12–3,68; p=0,046; для гетерозигот OR=1,68; 95% CI 1,09–2,60; p=0,046)
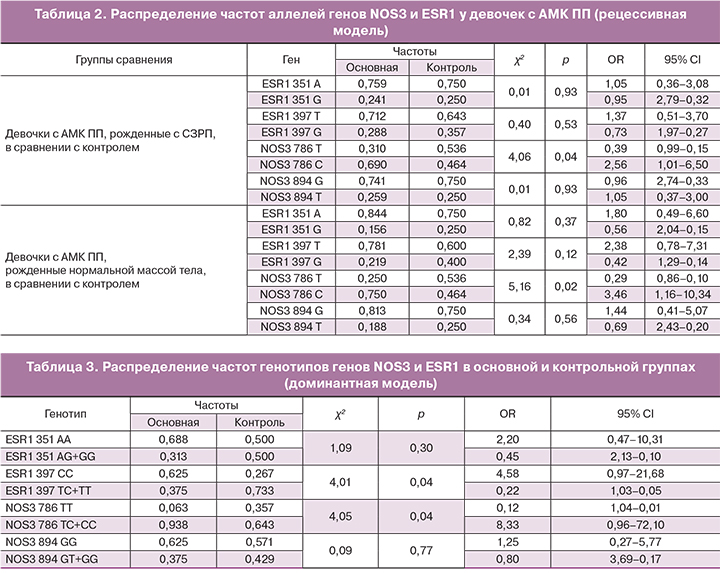
Анализ распределения частот аллелей генов NOS3 и ESR1 также показал, что частота встречаемости аллеля 786С гена NOS3 достоверно выше у девочек страдающих АМК ПП (OR=2,56; 95% CI 1,01–6,50; p=0,04; табл. 2).
При анализе результатов генотипирования по исследуемым аллельным полиморфизмам генов NOS3 и ESR1 девочек основной группы, рожденных с нормальной массой тела, и группой контроля также было выявлено статистически значимое повышение частоты встречаемости полиморфного аллелеля 786С в гене NOS3:786Т>C: (OR=3,46; 95% CI 1,16–10,34; p=0,02; табл. 2).
Использование рецессивной модели наследования позволило выявить различия в частоте встречаемости генотипов по полиморфным локусам генов NOS3 и ESR1 в обследуемых группах девочек. Наличие в генотипе аллеля 786С гена NOS3 в гетеро- и гомозиготном состоянии чаще определяется у девочек, страдающих АМК, рожденными как с СЗРП (ОR=2,56; 95% CI: 1,01–6,5; р=0,04; табл. 2), так и с нормальной массой тела (ОR=3,46; 95% CI: 1,16–10,34; р=0,02; табл. 2), а носительство генотипа NOS3:786ТТ достоверно чаще встречается у девочек в контрольной группе (ОR=0,12, 95% CI: 1,04–0,01; р=0,04; табл. 1). Таким образом, можно утверждать, что полиморфный аллель С в локусе 786 гена эндотелиальной NO-синтазы связан с повышенным риском развития у девочек АМК ПП.
Кроме того, при изучении доминантной модели генотипов NOS3 и ESR1 было выявлено, что у девочек, страдающих АМК ПП, рожденных с СЗРП, достоверно чаще определяется генотип ESR1:397 СС с полиморфным локусом 397С в гене ERα (OR=4,58; 95% CI; 0,97–21,68; p=0,04; табл. 3). Таким образом, полиморфный аллель 397С в гене ESR1 имеет негативный эффект в отношении дополнительного риска развития АМК ПП, именно у девочек, рожденных с задержкой внутриутробного роста.
Обсуждение
Рождение девочки с синдромом внутриутробной гипотрофии, развивающейся на фоне эндотелиальной дисфункции матери при вынашивании беременности, определяет внутриутробно программируемые особенности функционирования эндотелиальной системы девочки. В подростковом периоде на этапе становления менструальной функции данные нарушения функции эндотелия и регуляции ангиогенеза реализуются в развитии с менархе АМК ПП.
Нами проведено исследование полиморфизмов генов NO–синтазы 786 T>C, 894G>T, гена ESR1 351A>G (Xbal) и 397T>C (Pvull) и некоторых маркеров эндотелиальной дисфункции и ангиогенеза у девочек, рожденных с задержкой внутриутробного роста. Анализ распределения частот аллелей генов NOS3 и ESR1 показал, что частота встречаемости аллеля С гена NOS3 786Т>С достоверно выше у девочек, страдающих АМК, которые родились с СЗРП. В последних работах показано, что наличие С-аллеля в промоторе гена 786 Т>С NOS3 приводит к снижению активности еNOS и уменьшает ее экспрессию в тканях, в результате чего снижается синтез и высвобождение оксида азота, что и определяет синдром эндотелиальной дисфункции [14, 17, 22, 24]. Сообщается, что носители аллеля С гена 786С гена NOS3 имеют более низкие уровни нитритов в крови, у них снижена реакция компенсаторой активации кровотока в плечевой артерии на введение ацетилхолина и эстрогенов [25]. Мета-анализ из 20 исследований, включающий 11236 пациенток, продемонстрировал связь полиморфного аллеля С в гене 786 Т>С NOS3 с наличием повышенного тонуса коронарных артерий, склонностью к спазму коронарных сосудов и извращенной реакцией на введение ацетилхолина, что может служить основой развития ишемической болезни сердца и острого коронарного синдрома (OR 1,32, Cl 95% 1,07–1,28, p=0,001) [13]. Таким образом, наличие в генотипе полиморфного аллеля 786С гена NOS3 в гетеро- или гомозиготном состоянии, ассоциированного с риском синдрома эндотелиальной дисфункции, достоверно чаще определяется у девочек, страдающих АМК, рожденных с внутриутробной задержкой роста плода.
Кроме того, у девочек, страдающих АМК ПП, рожденных с СЗРП, чаще определяется генотип ESR1 Pvull-CC в гене ERα. В работах, посвященных изучению влияния полиморфизма Рvull ESR1 на дисфункцию эндотелия при сердечно-сосудистых заболеваниях, подчеркивается, что генотип ESR1 Pvull-CC несет повышенный риск формирования эндотелиальной дисфункции и клинически чаще проявляется увеличением систолического артериального давления, толщины интимы и частоты ишемической болезни сердца у женщин [19, 26]. В работах других авторов подчеркивается, что генотип ESR1 Pvull-CC значительно уменьшает NO-зависимое увеличение скорости кровотока и биодоступность NO [14].
Ряд исследователей полагают, что синдром эндотелиальной дисфункции вызывает снижение кровотока в строме эндометрия и формирование тканевой гипоксии [27, 28]. Тканевая гипоксия запускает развитие аномального ангиогенеза за счет образования клеток, интенсивно экспрессирующих сосудистый эндотелиальный фактор роста (VEGF). C.J. Lоcwood и соавт. показали, что тканевая гипоксия, связанная с ингибированием активности кровотока в эндометрии и гиперпродукцией активных форм кислорода при синдроме эндотелиальной дисфункции, увеличивает синтез ангиогенных факторов роста, таких как VEGF-A в HESC (human endometrial stromal cells – клетки стромы эндометрия человека) и ангиопоэтина-2 (Ang-2) в эндотелиальных клетках эндометрия, в то время как синтез ангиопоэтина-1 в HESC клетках уменьшается [12, 29]. В результате возрастает хрупкость сосудистой стенки, происходит активация неконтролируемого ангиогенеза в эндометрии, что влечет за собой развитие АМК.
Стратегия формирования выраженного проангиогенного статуса является, по-видимому, одним из компенсаторных механизмов сохранения оптимальной тканевой перфузии в эндометрии при нарушении условий ее существования.
Заключение
Таким образом, АМК ПП у девочек, рожденных от матерей с осложненным течением гестации в виде преэклампсии, хронической плацентарной недостаточности с исходом в СЗРП, могут иметь в основе патогенеза внутриутробно программируемый синдром эндотелиальной дисфункции с нарушением регуляции ангиогенеза и сосудистого тонуса. Дальнейшее изучение молекулярно-генетических механизмов реализации данной патологии расширит возможности прогнозирования и профилактики маточных кровотечений у девочек-подростков.



