Как известно, необходимость во вспомогательных репродуктивных технологиях (ВРТ) непрерывно возрастает. Однако, несмотря на постоянные усилия, направленные на повышение вероятности наступления беременности, эффективность программы ЭКО не превышает 40% [1]. В свою очередь благоприятный исход программы ВРТ, рождение здорового ребенка зависит от множества факторов, одним из наиболее значимых является качество полученных эмбрионов. Способность прогнозировать качество эмбрионов позволит изначально выбрать правильный подход к ведению пациенток, а также персонифицированную тактику эмбриологического этапа. В связи с этим требуются все новые технологии, позволяющие повысить эффективность проводимого лечения, так как прогнозирование качества получаемых ооцитов и эмбрионов представляет собой одну из наиболее важных проблем в современной репродуктологии. Использующиеся на сегодняшний день маркеры результативности программ ВРТ не являются универсальными и зависят от множества сопутствующих факторов, в том числе и экзогенных. С этой точки зрения изучение генетической предрасположенности представляется важным биологическим фактором, предопределяющим многие процессы репродуктивной функции.
Исследование генотипа, в отличие от многих других маркеров, может проводиться однократно, так как данные, полученные в результате генотипирования пациентки, не меняются в течение жизни, не зависят от веса, от дня менструального цикла и так далее. Изучение ассоциации генетических маркеров со многими биологическими процессами представляется крайне актуальным как с научной, так и с практической точки зрения [2, 3].
В литературе описаны исследования, согласно которым четко прослеживается ассоциация генотипа пациенток с качеством получаемых эмбрионов. Так, например, показана связь полиморфизма гена ESR1 –351A>G[XBaI] с качеством эмбрионов. Однако в большинстве из них выводы основаны на проведенном однофакторном анализе, не позволяющем оценить значение сочетания генотипов полиморфизма генов. Также недостатками однофакторных моделей являются низкая прогностическая значимость и противоречивость данных [4–6].
Таким образом, целью исследования стало создание многофакторной молекулярно-генетической модели для предикции качества получаемых эмбрионов, оптимизации проводимого лечения бесплодия методом ВРТ.
Материал и методы исследования
Проведено проспективное исследование на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, включавшее 160 женщин. Все пациентки соответствовали критериям включения (возраст 18–36 лет, трубно-перитонеальный и/или мужской фактор бесплодия при отсутствии выраженной патозооспермии, регулярный менструальный цикл) и исключения (эндокринный фактор бесплодия, перенесенные оперативные вмешательства на яичниках, эндометриоз, миома матки, генетические аномалии, пороки развития половых органов).
Стимуляция функции яичников проводилась по стандартному протоколу с антагонистами гонадотропин-рилизинг гормона со 2–3-го дня менструального цикла препаратами рекомбинантного фолликулостиму-лирующего гормона в течение 9,8±0,9 дня. Ультразвуковой контроль динамики фолликулогенеза осуществлялся трансвагинально 4–5-кратно в течение стимуляции суперовуляции. При достижении диаметра максимального фолликула более 1,4–1,5 см ежедневно вводился препарат антагониста гонадотропин-рилизинг гормона в дозе 0,25 мг. Финальное дозревание ооцитов достигалось путем введения хорионического гонадотропина (8000–10 000 МЕ).
Трансвагинальная пункция яичников производилась спустя 36 часов после введения хорионического гонадотропина. Оплодотворение аспирированных ооцитов проводилось как методом ЭКО (73/160, 45,6%), так и ИКСИ (87/160, 54,4%).
Для проведения генетического исследования производился забор периферической венозной крови по стандартной методике. В качестве потенциальных молекулярно-генетических маркеров качества бластоцист исследовались 10 полиморфных локусов генов: AMH 146 G>T (Ile49Ser) [rs 10407022]; AMHR2(-482 A>G) [rs 2002555]; ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; FSHR 2039 G>A(Ser680Asn) [rs 6166]; LHCGR 935 A>G (Asn312Ser) [rs 2293275]; VEGFA -634 G>C [rs 2010963]; ESR2 G>A [RsaI] [rs 4986938]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Определяли генотип по данным позициям с применением полимеразной цепной реакции (ПЦР). ПЦР и определение температуры плавления олигонуклеотидных проб проводили при помощи детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена с помощью пакета прикладных программ SPSS Statistics 17.0. В качестве меры центральной тенденции количественных признаков была выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Результаты представлены в виде Me (L-H). Для оценки значимости межгрупповых различий нескольких независимых выборок использовали тест Крускала–Уоллиса. В случае двух выборок применялся U-критерий Манна–Уитни для несвязанных совокупностей. Оценку соответствия выявленных частот генотипов закону Харди–Вайнберга проводили по критерию χ2 в сравнении с ожидаемыми частотами генотипов равновесного распределения. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2. При построении бинарной логистической регрессионной модели использовался метод обратной селекции. Качество приближения регрессионных моделей при каждом последующем шаге оценивалось при помощи функции подобия – отрицательного удвоенного значения логарифма этой функции (-2LL). Оценка качества полученной модели проведена с помощью ROC-анализа. Часть дисперсии, объяснимая с помощью логистической регрессии, вычислялась по методу Наделькеркеса. Статистически значимыми считались различия при значении р<0,05. Отношение шансов (ОШ) приведено с 95% доверительным интервалом (ДИ).
Результаты исследования
По клинико-анамнестическим, ростовесовым показателям пациентки не различались. По типу и этиологии бесплодия, по структуре перенесенных гинекологических заболеваний и оперативных вмешательств пациентки также были сравнимы между собой (р>0,05). При наличии мужского фактора бесплодия без выраженной патозооспермии оплодотворение ооцитов производилось методом ИКСИ. Статистически значимых различий по данному показателю выявлено не было (χ2, р=0,128).
Бинарная логистическая регрессия рассчитывает вероятность наступления события (в данном случае получение эмбрионов 5 суток развития низкого качества класса С согласно классификации Istanbul consensus workshop on embryo assessment (ESHRE, 2011) [7] в зависимости от значений независимых переменных (в данном случае полиморфизма исследуемых генов).
Вероятность наступления события (получения бластоцист низкого качества) (р) для некоторого случая рассчитывается по формуле, имеющей общий вид:
p=1/(1+e-z),
где р – искомая вероятность наступления события; z (классифицирующая дискриминантная функция) = a + b1*X1 + b2*Х2+ ...+ bn*Xn; а – некоторая константа; X1 — независимые переменные; b1 – коэффициенты, расчет которых является задачей бинарной логистической регрессии; е – экспонента.
Если для р получается значение меньшее 0,5, то можно предположить, что событие не наступит; в противном случае предполагается наступление события.
В бинарной логистической регрессионной модели исходом считается факт получения эмбрионов низкого качества, предикторами – полиморфизм генов AMH 146 G>T (Ile49Ser), FSHR 2039 G>A (Ser680Asn), LHCGR 935 A>G (Asn312Ser) и LHCGR 872 A>G (Asn291Ser).
При построении бинарной логистической регрессионной модели, используют метод обратной селекции. Качество приближения регрессионных моделей при каждом последующем шаге оценивают при помощи функции подобия. Мерой правдоподобия служит отрицательное удвоенное значение логарифма этой функции (-2LL). В качестве начального значения для -2LL применяется значение, которое получается для регрессионной модели, содержащей только константы. После добавления переменной влияния значение -2LL равно 180,962. Разность между значением -2LL начальной и конечной модели составила 22,807 (р=0,004). Подобное снижение величины означает улучшение полученной модели.
Мера определенности показывает ту часть дисперсии, которую можно объяснить с помощью логистической регрессии. Мера определенности по Коксу и Шелу имеет тот недостаток, что значение равное 1 является теоретически не достижимым; этот недостаток устранен благодаря модификации данной меры по методу Наделькеркеса. Часть дисперсии, объяснимой с помощью логистической регрессии, в данном уравнении составляет 18,5% (вычисляется по методу Наделькеркеса).
Проверка значимости отличия коэффициентов от нуля, проводится при помощи статистики Вальда, использующей распределение χ2, которая представляет собой квадрат отношения соответствующего коэффициента к его стандартной ошибке.
Согласно полученной константе и согласно значимым коэффициентам для прогнозирования вероятности получения эмбрионов низкого качества (р) классифицирующая дискриминантная функция имеет вид:
Z= – 22,36 – 0,79* AMHT/G – 20,621* AMHG/G + 0,993* FSHRA/G + 0,364* FSHRG/G – 1,206* LHCGR (935 A>G)A/G + 1,164* LHCGR (935 A>G)A/A + 22,888* LHCGR (872 A>G)A/G + 21,6* LHCGR (872 A>G)A/A,
где:
AMHT/G – наличие у пациентки генотипа AMH: 146 Т/G (1 – да, 0 – нет);
AMHG/G – наличие у пациентки генотипа AMH: 146 G/G (1 – да, 0 – нет);
FSHRA/G – наличие у пациентки генотипа FSHR: А/G (1 – да, 0 – нет);
FSHRG/G – наличие у пациентки генотипа FSHR: G/G (1 – да, 0 – нет);
LHCGR (935 A>G)A/G – наличие у пациентки генотипа LHCGR: 935 A/G (1 – да, 0 – нет);
LHCGR (935 A>G)A/A – наличие у пациентки генотипа LHCGR: 935 A/А (1 – да, 0 – нет);
LHCGR (872 A>G)A/G – наличие у пациентки генотипа LHCGR: 872 A/G (1 – да, 0 – нет);
LHCGR (872 A>G)A/A – наличие у пациентки генотипа LHCGR: 872 A/А (1 – да, 0 – нет).
Точность прогнозирования качества бластоцист с использованием полиморфизма генов AMH 146 G>T (Ile49Ser), FSHR 2039 G>A (Ser680Asn), LHCGR 935 A>G (Asn312Ser) и LHCGR 872 A>G (Asn291Ser) составляет 82,9%.
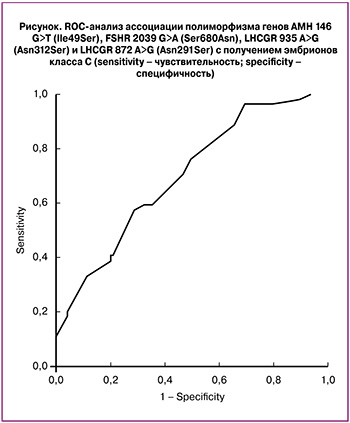
Провели ROC-анализ для валидации полученной модели (рисунок). Чувствительность составила 82,9%, специфичность 40%, значение AUC (площадь под кривой) для данной модели составляет 0,699, 95% доверительный интервал от 0,616 до 0,783.
Пример
Прогнозирование получения бластоцист низкого качества класса С провели у пациентки М. 32 лет, обратившейся для проведения программы ЭКО по поводу бесплодия трубного происхождения. Из анамнеза: беременностей 2, родов 0, абортов 0. В 2010 г. левосторонняя трубная беременность, произведена лапароскопия, тубэктомия слева. В 2012 г. правосторонняя трубная беременность, произведена лапароскопия, тубэктомия справа. Данная попытка ЭКО первая.
Кровь для генотипирования у пациентки М. брали натощак из локтевой вены в стерильную пробирку. Определяли замены однонуклеотидных последовательностей с применением ПЦР согласно описанному выше методу.
Результат генотипирования пациентки М.:
AMH 146 G>T (Ile49Ser) – T/G
FSHR 2039 G>A (Ser680Asn) – A/G
LHCGR 935 A>G (Asn312Ser) – A/G
LHCGR 872 A>G (Asn291Ser) – A/G
Значение дискриминантной функции составило:
z=-22,36-0,79*1+0,993*1-1,206*1+22,888*1= -0,475
Вероятность (р) получения эмбрионов класса С (ESHRE 2011) у данной пациентки рассчитывали по формуле 1:
р=1/(1+е-0,475)=0,622
Рассчитанная вероятность р указывает на исполнение прогноза, в данном случае – на получение эмбрионов низкого качества класса С с вероятностью 62,2%.
В результате проведения программы ВРТ у пациентки всего было получено 8 эмбрионов (на 5-е сутки развития), из них 5 эмбрионов класса С, 3 эмбриона класса В (согласно классификации Istanbul consensus workshop on embryo assessment (ESHRE 2011) [7].
Согласно полученным данным, предикция получения эмбрионов низкого качества при проведении программ ВРТ на основании молекулярно-генетических маркеров носит статистически достоверный характер.
Полученный результат свидетельствует о независимой генетической детерминации процессов эмбриогенеза. Следовательно, способ прогнозирования качества эмбрионов с учетом генотипа пациенток может быть использован в клинико-лабораторной практике с целью предикции исходов программы ЭКО.
 Обсуждение
Обсуждение
В современном здравоохранении актуально такое понятие, как персонифицированная медицина. Под этим подразумевают прежде всего профилактику и диагностику, основанные на данных об индивидуальных особенностях организма пациентов, в том числе и генетической предрасположенности к тому или иному заболеванию, состоянию или функции организма [1].
Генетическая вариабельность представляется важным предиктором исходов стимуляции суперовуляции и программ ВРТ в целом. В литературе достаточно редко встречаются аналогичные исследования, посвященные созданию мультигенных моделей. В исследовании Boudjenah и соавт. установлено, что у женщин – носительниц Ser/Ser полиморфизма гена FSHR (Asn680Ser) [rs 6166] и Ser/Ser гена AMH (Ile49Ser) [rs10407022] получают большее количество зрелых ооцитов, чем у пациенток – носительниц Asn/Asn полиморфизма гена FSHR (Asn680Ser) и/или Ile/Ile гена AMH (Ile49Ser) (p<0,05) [8].
В исследовании, проведенном Altmae и соавт., были представлены данные анализа мультигенной модели 680Ser(FSHR 2039 A>G) – T(ESR1 [PvuII]) – G(ESR2 [AluI]), которая прогнозировала сниженный овариальный ответ на стимуляцию суперовуляции препаратами рФСГ, но не было выявлено ассоциации полиморфизма гена с качеством ооцитов и эмбрионов [4, 9].
Несмотря на имеющиеся разногласия во взглядах исследователей на проблемы репродукции, единым является факт, что будущая перспектива развития протоколов стимуляции суперовуляции заключается в необходимости учитывать совокупность гормональных, функциональных и генетических маркеров. Исходы стимуляции суперовуляции мультифакториальны, изменчивы и не всегда предсказуемы. Вариабельность в популяции не фертильных пациенток исключает возможность единого ко всем подхода в программах стимуляции суперовуляции [10]. Такая вариабельность может быть обусловлена единичными однонуклеотидными полиморфизмами (SNPs) [11]. Способность более точно прогнозировать ответ яичников на их стимуляцию будет представлять собой значительный шаг вперед в лечении бесплодия методом ЭКО [12]. Пациенткам, впервые обратившимся по поводу лечения бесплодия методом ЭКО, на этапе подготовки целесообразно проводить генотипирование наряду с клинико-лабораторным обследованием для возможности индивидуализированного проведения программы ВРТ.
При носительстве неблагоприятных генотипов полиморфизма генов AMH 146 G>T (Ile49Ser), FSHR 2039 G>A (Ser680Asn), LHCGR 935 A>G (Asn312Ser) и LHCGR 872 A>G (Asn291Ser), учитывая риск получения эмбрионов низкого качества, пациенткам показаны протоколы стимуляции суперовуляции, направленные на получение большего количества фолликулов, зрелых ооцитов и эмбрионов, пригодных для переноса в полость матки. Целесообразно проведение процедуры ИКСИ с целью повышения вероятности оплодотворения. Таким пациенткам также можно рекомендовать проведение преимплантационного генетического скрининга [13].
Заключение
Несмотря на современные достижения в области лечения бесплодия, существует необходимость индивидуализировать и оптимизировать подготовку больных к программе ЭКО, протоколы стимуляции суперовуляции, снизить вероятность неадекватного ответа яичников и развития осложнений, повышая эффективность и безопасность программ ВРТ. Поэтому одной из важнейших задач врача является наиболее точное прогнозирование возможных исходов стимуляции суперовуляции еще до вступления пациентки в программу ЭКО. Генотипирование пациенток с целью предикции исходов программ ВРТ является перспективным и актуальным методом, позволяющим индивидуализировать методы обследования и проводимую терапию бесплодия.



