В настоящее время проблема бесплодия является одной из самых актуальных и приоритетных в медицине развитых стран, учитывая неблагоприятные демографические показатели народонаселения. По данным отчета Российской ассоциации репродукции человека за 2017 г., в программах экстракорпорального оплодотворения (ЭКО) и интрацитоплазматической инъекции сперматозоида частота наступления беременности из расчета на перенос эмбриона в полость матки составила 38,4% и не имеет выраженной тенденции к росту [1].
Одной из причин неэффективности ЭКО являются неудачи имплантации, которые могут возникнуть:
- при нарушении рецептивности эндометрия, которое обусловлено различными гинекологическими заболеваниями (эндометриоз, полипы эндометрия, последствия перенесенных воспалительных заболеваний, нарушения гормональной регуляции) [2–4];
- наличии хромосомных аномалий у эмбриона [5, 6];
- утолщении zona pellucida, затрудняющей высвобождение эмбриона и его прикрепление к эндометрию, что чаще встречается у женщин старшего репродуктивного возраста [7, 8].
Предметом исследований последних лет является изучение микробиоты матки и ее влияния на успешность имплантации.
Микробиота – это совокупность микроорганизмов, представленных в отдельном биотопе человека, находящихся в симбиозе с организмом хозяина. Несмотря на то, что эти симбиотические отношения сложились эволюционно, наше понимание физиологической и патофизиологической роли микробиоты в большей степени остается недостаточным [9–15].
До настоящего времени остается неясным, оказывают ли выявленные в эндометрии условно-патогенные микроорганизмы (УПМ) негативное влияние на имплантацию; какой состав микробиоты полости матки считается нормой, а какой ассоциируется с дисбиозом, оказывающим неблагоприятное воздействие на имплантацию, и где грань между нормой и патологией в количественном и качественном соотношении.
В связи с этим целью нашего исследования явилась оценка влияния микробиоты полости матки на успешность имплантации эмбриона у женщин в программах вспомогательных репродуктивных технологий.
Материалы и методы
В исследование включено 130 пациенток репродуктивного возраста, которые обратились в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России с жалобами на бесплодие.
Критерии включения в исследование: возраст от 23 до 37 лет, регулярный менструальный цикл, отсутствие патологии эндометрия по данным ультразвукового исследования, перенос эмбрионов (ПЭ) хорошего качества.
Критерии исключения: наличие у пациенток интерстициальной и/или субсерозной миомы матки более 4 см, деформирующей полость матки, наружный генитальный эндометриоз (III–IV стадия), внутриматочная патология (внутриматочная перегородка, полип эндометрия, хронический эндометрит), тяжелые формы патозооспермии у супруга (3–4 степень).
Пациентки были разделены на три группы: I группу составили пациентки с первой попыткой ЭКО (n=39); II группу – женщины с повторными неудачами имплантации и ПЭ в цикле овариальной стимуляции (n=27); III группу – пациентки с повторными неудачами имплантации с ПЭ в криоцикле (n=64).
Всем женщинам перед ПЭ в полость матки проведено микробиологическое исследование микробиоты цервикального канала. Для исключения контаминации цервикального канала микрофлорой влагалища влагалищную часть шейки матки обрабатывали стерильным ватным тампоном. Взятие материала из цервикального канала осуществляли с помощью дакронового бактериологического тампона в пробирки с транспортной средой Эймса (Medical Wire, Англия). Состав микробиоты исследовали методом культуромики – с использованием расширенного набора селективных и неселективных питательных сред. Отделяемое цервикального канала засевали на селективные и неселективные агаризованные плотные питательные среды. После ПЭ в полость матки дистальный фрагмент эмбриокатетера срезали стерильными ножницами и помещали в пробирку со средой накопления (1 мл), используемой для гемокультур (Oxoid, Великобритания). После 48 часов культивирования в анаэробном боксе (Jouan, Франция) в атмосфере трехкомпонентной газовой смеси (N2 – 80%; CO2 – 10%; Н2 – 10%) состав микробиоты исследовали методом культуромики. Для выделения факультативно-анаэробных микроорганизмов использовали колумбийский агар (Oxoid, Великобритания), маннит-солевой агар (Himedia, Индия), среду для выявления и дифференциации Streptococcus agalactiae (CHROMagar, Франция), энтерококковый агар и агар Эндо-ГРМ (ФГУН «ГНЦПМ и Б», Оболенск, Россия), декстрозный агар Сабуро (Oxoid, Великобритания). Лактобациллы культивировали на среде Лактобакагар (ФГУН «ГНЦПМ и Б», Оболенск, Россия), строгие анаэробы – на агаре для бифидобактерий (Himedia, Индия), прередуцированном агаре Шедлера с необходимыми добавками, основном агаре для анаэробов и перфрингенс агаре (Oxoid, Великобритания).
Идентификацию выделенных микроорганизмов проводили методом времяпролетной масс-спектрометрии (MALDI-TOF) с помощью масс-спектрометра AutoFlex III с программным обеспечением Maldi BioTyper (Bruker Daltonics, Германия) версии 3.0.
Всем женщинам проводили селективный перенос 1 качественного эмбриона. Пациенткам I и II групп проводили стимуляцию суперовуляции со 2–3-го дня менструального цикла по протоколу с антагонистами гонадотропин-рилизинг гормона. В качестве триггера овуляции использовался хорионический гонадотропин человека в стандартной дозе 10000 МЕ.
ПЭ в криоцикле осуществляли без заместительной гормональной терапии, в естественном овуляторном цикле. Ведение посттрансферного периода осуществляли по общепринятой методике препаратами дидрогестерона в дозе 30 мг/сутки перорально со дня проведения трансвагинальной пункции яичников в циклах стимуляции суперовуляции.
Сравнительный анализ полученных результатов проводили у женщин как в циклах стимуляции суперовуляции, так и в криоциклах в зависимости от наступления беременности или ее отсутствия.
На втором этапе исследования были отобраны 30 образцов биоматериала из полости матки (фрагмент эмбриокатетера в среде накопления) для проведения высокопроизводительного секвенирования с целью сравнения с микробиологическими данными.
Для определения видового состава микробиоты полости матки методом высокопроизводительного секвенирования (NGS) были выбраны вариабельные регионы V3–V4. Амплификацию выбранного региона проводили с использованием опубликованных праймеров 357F и 806R, выделение ДНК из образцов с использованием набора реагентов ДНК «МЧ-Рапид v2», а амплификацию последовательности гена 16S pРНК – с использованием детектирующего амплификатора ДТ-прайм («ДНК-технология», Россия). Оценку качества полученных ампликонов производили в 2%-ном агарозном геле. Качество и концентрацию библиотек ДНК для NGS-секвенирования проверяли с использованием прибора Bioanalyzer. Секвенировали на приборе MiSeq (Illuminа, USA) на ячейках v2 согласно протоколу производителя. Анализ данных проводили с использованием программного пакета QIMME.
Статистический анализ
Статистическая обработка данных выполнена с использованием программы IPM SРSS Statistics, версия 22. Для количественных параметров определены: среднее значение и стандартное отклонение М (SD), для качественных данных – частоты и абсолютные значения % (абс.). При нормальном распределении, значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью t-критерия Стьюдента. При сравнении качественных параметров применялся метод χ2.
Статистически значимыми различия считали при уровне значимости р<0,05. При попарном сравнении трех групп использовали поправку Бонферрони, статистически значимыми различия считали при уровне значимости р<0,017.
Результаты
Возраст пациенток в исследуемых группах варьировал от 22 до 37 лет, статистически значимых различий по возрасту не выявлено (р>0,017). В группе с первой попыткой ЭКО возраст женщин составил 30,4 (3,3) года; у женщин с повторными неудачами имплантации с ПЭ в цикле овариальной стимуляции (II группа) – 32,3 (3,5) года; у пациенток с повторными неудачами имплантации и ПЭ в криоцикле (III группа) – 32,0 (3,0) года.
Результаты репродуктивных исходов у обследуемых женщин представлены в таблице.
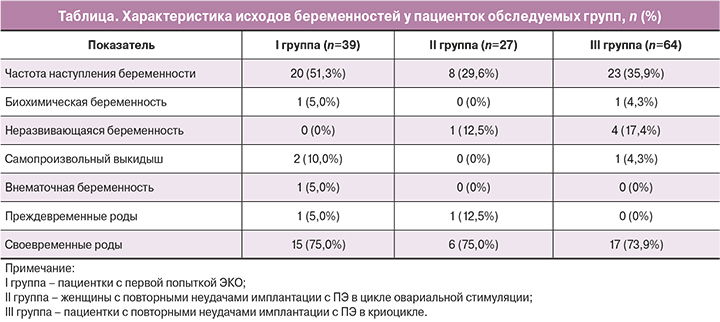
Из данных, представленных в таблице, следует, что частота наступления беременности на перенос у пациенток I группы была выше в 1,7 раз по сравнению с женщинами II группы – 29,6% (8/27) и в 1,4 раза по сравнению с III группой – 35,9% (23/64) и составила 51,3% (20/39), однако разница не была статистически значимой (р>0,017). При анализе исходов беременностей в исследуемых группах обращает на себя внимание отсутствие неразвивающихся беременностей у пациенток с первой попыткой ЭКО (0%), тогда как у пациенток с повторными неудачами имплантации (II и III группы) этот показатель составил 12,5% (1/27) и 17,4% (4/64) соответственно, однако статистически значимого отличия не установлено (р>0,017). По частоте своевременных родов от числа наступивших беременностей все группы были сопоставимы – 75%1 (15/20), 75% (6/8) и 73,9 % (17/23) соответственно.
Проведен количественный и качественный анализ состава микрофлоры, выделенной из цервикального канала у женщин исследуемых групп.
У пациенток с первой попыткой ЭКО в умеренном (104–105 КОЕ/мл) или в большом (106 КОЕ/мл и более) количестве наиболее часто выделяли лактобациллы, чаще у женщин с наступившей беременностью – 90,0% (18/20), чем с отсутствием – 73,7% (14/19), однако статистически значимой разницы не выявлено (р>0,05). УПМ выделяли преимущественно в низком титре (103 КОЕ/мл и менее). Исключение составили гарднерелла и облигатно-анаэробные микроорганизмы. Так, G. vaginalis в основном обнаружена в умеренном или высоком титре: у забеременевших женщин выявлена только в умеренном – 15% (3/20) или высоком – 5% (1/20), но и среди не забеременевших ее выявляли в высоком – 5,3% (1/19) и в умеренном – 10,6% (2/19) титре.
Облигатно-анаэробные микроорганизмы, напротив, несколько чаще выявляли в низком – 15,8% (3/19) или умеренном титре – 10,5% (2/19) у женщин с ненаступившей беременностью, а у забеременевших женщин – с одинаковой частотой в низком и умеренном титре – по 5% (1/20), но также без статистической разницы. Прочие УПМ такие, как энтерококки, энтеробактерии и актиномицеты колонизировали цервикальный канал только в низкой концентрации. Полная картина уровня микробной колонизации с учетом частоты встречаемости и количественной оценки микроорганизмов в I группе женщин показана на тепловой карте (рис. 1).
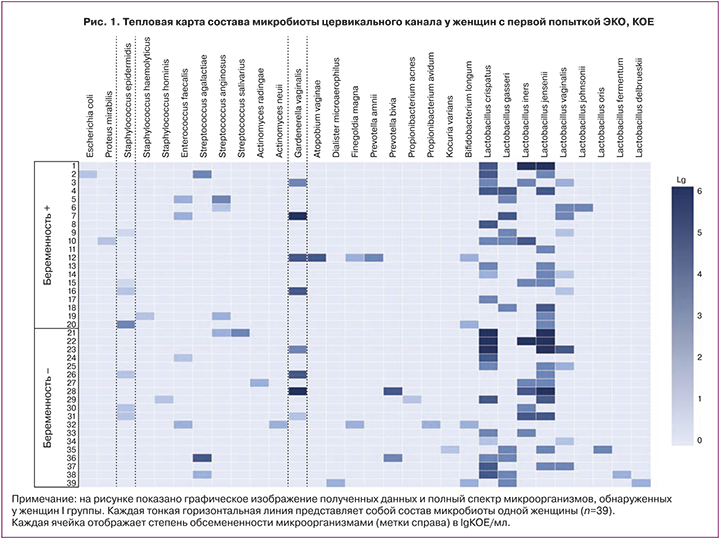
Таким образом, у пациенток I группы с наступившей и ненаступившей беременностью статистически значимой разницы в частоте выделения из цервикального канала лактобацилл и УПМ, как в низкой концентрации, так и в умеренной или высокой, не установлено. Более частая колонизация лактобациллами в умеренной или высокой концентрации, а также более частое выделение УПМ (G. vaginalis) в умеренном или высоком титре у пациенток I группы с наступившей беременностью существенно не повлияли на имплантацию эмбриона.
У женщин с повторными неудачами имплантации и ПЭ в цикле овариальной стимуляции по сравнению с пациентками I группы лактобациллы в умеренном или в большом количестве чаще выделяли у незабеременевших – 63,2% (12/19), чем у забеременевших женщин – 50,0% (4/8), однако статистически значимой разницы не выявлено (р>0,05). УПМ высевали, как в низком, так в умеренном или высоком титре. Так, энтерококк и коагулазоотрицательные стафилококки обнаружены только в низкой концентрации, стрептококки в обеих подгруппах высевали преимущественно в умеренном титре при доминировании в группе забеременевших женщин – 12,5% (1/8) и 5,3% (1/19) соответственно. Гарднерелла обнаружена в обеих подгруппах в умеренном титре чаще у женщин с отсутствием беременности – 21,1% (4/19), а высоком титре у одной забеременевшей женщины – 12,5% (1/8). Строгие анаэробы в низком – 12,5% (1/8) и умеренном титре – 12,5% (1/8) выделяли чаще также у забеременевших женщин, чем с отсутствием – 10,5% (2/19). Полная картина уровня микробной колонизации с учетом частоты встречаемости и количественной оценки микроорганизмов во II группе женщин показана на рисунке 2.
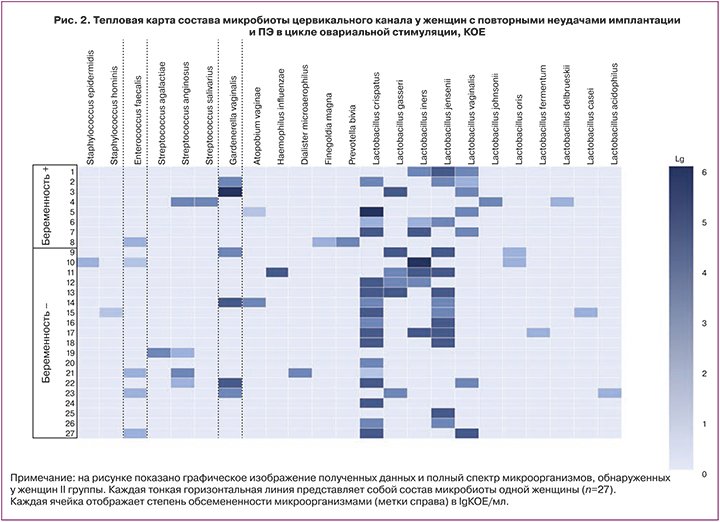
Таким образом, во II группе у забеременевших женщин с повторными неудачами имплантации и ПЭ в цикле стимуляции суперовуляции обнаружена более низкая частота выделения лактобацилл, определяющих колонизационную резистентность биотопа, и более низкая степень обсемененности ими цервикального канала и, напротив, более частая колонизация цервикального канала УПМ (облигатными анаэробами) в низком и умеренном титре. Однако это не повлияло негативным образом на наступление беременности, что свидетельствует о том, что наличие в цервикальном канале, анатомически максимально приближенном к полости матки, микроорганизмов, в том числе УПМ в низком и умеренном титре не обязательно влияет на имплантационные процессы и наступление беременности.
У пациенток с повторными неудачами имплантации и ПЭ в криоцикле в умеренном или в большом количестве наиболее часто выделяли лактобациллы, чаще у женщин с наступившей беременностью – 60,9% (12/23), чем у незабеременевших женщин – 51,2% (21/41), однако статистически значимой разницы не обнаружено (р>0,05). УПМ выделяли преимущественно в низком титре. Исключение составляют: гарднерелла, которая обнаружена в обеих подгруппах только в умеренном количестве – 4,3% (1/23) и 7,3% (3/41) соответственно; строгие анаэробы, которые у забеременевших женщин выявляли только в низкой концентрации – 13,0% (3/23), а среди женщин с отсутствием беременности – с одинаковой частотой в низком и умеренном титре – по 9,75% (4/41). Коагулазоотрицательные стафилококки и энтерококки присутствовали практически всегда в низком титре.
Следует отметить, что статистически значимого отличия в частоте колонизации цервикального канала упомянутыми группами микроорганизмов в низком и, что более важно, в умеренном количестве между женщинами с наступившей беременностью и незабеременевшими женщинами не получено (р>0,05). Полная картина уровня микробной колонизации с учетом частоты встречаемости и количественной оценки микроорганизмов в III группе женщин показано на рисунке 3.
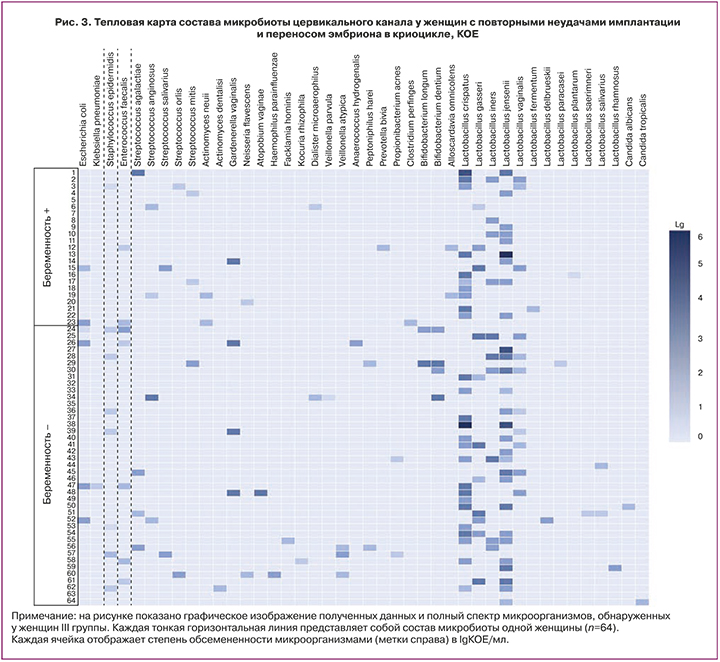
Таким образом, у пациенток III группы с повторными неудачами имплантации с ПЭ в криоцикле с ненаступившей беременностью реже, чем у забеременевших пациенток, отмечена колонизация цервикального канала лактобациллами в высоком или умеренном титре и, напротив, чаще УПМ (стрептококками, энтеробактериями и особенно строгими анаэробами и гарднерелллой) – в умеренном титре. Однако наметившаяся тенденция при отсутствии статистически значимой разницы указанных показателей не позволяет в полной мере рассматривать снижение титра лактобацилл, а также возрастание численности УПМ до умеренных значений, как фактор риска ненаступления беременности.
Проведена сравнительная оценка микробиоты цервикального канала между исследуемыми группами женщин. Стерильным оказалось отделяемое цервикального канала только у 7,8% пациенток с повторными неудачами имплантации и ПЭ в криоцикле (III группа). Видовой состав выделенных из цервикального канала микроорганизмов оказался разнообразным. Доминирующими во всех группах были лактобациллы (16 видов), обнаруженные у пациенток I, II и III групп с частотой 94,9% (37/39); 92,6% (25/27) и 81,3% (52/64) соответственно.
Второй по частоте встречаемости составляющей микробиоты цервикального канала были УПМ: в I группе – у 66,6% (26/39) женщин, во II – у 55,5% (15/27), в III – у 54,7% (35/64). Среди факультативно-анаэробных УПМ энтеробактерии чаще встречались у женщин с повторными неудачами имплантации и ПЭ в криоцикле (III группа) – 9,4% (6/64), по сравнению с женщинами I – 5,1% (2/39) и II (0%) групп. Также с большей частотой у пациенток III группы выделяли стрептококки – 23,4% (15/64) по сравнению с женщинами с первой попыткой ЭКО – 18,0% (7/39) и II группой – 14,8% (4/27). Стафилококки чаще высевали у пациенток I группы – 23,1% (9/39) по сравнению с пациентками II – 7,4% (2/27) и III групп – 12,5% (8/64) соответственно. Однако частота выделения энтерококков оказалась выше у женщин II группы – 18,5% (5/27) по сравнению с пациентками I – 10,3% (4/39) и III групп – 10,9% (7/64).
 Высеваемость облигатно-анаэробных бактерий была примерно одинаковой во всех группах и составила в I группе – 17,9% (7/39), во II – 14,8% (4/27) и в III – 17,2% (11/64). Частота выделения G. vaginalis оказалась заметно выше у женщин I – 20,5% (8/39) и II групп – 22,2% (6/27) по сравнению с пациентками III группы – 6,3% (4/64), однако разница оказалась статистически незначимой (р>0,017).
Высеваемость облигатно-анаэробных бактерий была примерно одинаковой во всех группах и составила в I группе – 17,9% (7/39), во II – 14,8% (4/27) и в III – 17,2% (11/64). Частота выделения G. vaginalis оказалась заметно выше у женщин I – 20,5% (8/39) и II групп – 22,2% (6/27) по сравнению с пациентками III группы – 6,3% (4/64), однако разница оказалась статистически незначимой (р>0,017).
Таким образом, наиболее часто встречаемой составляющей в микробиоте цервикального канала во всех группах женщин были лактобациллы, которые несколько чаще встречались у женщин с ПЭ в цикле овариальной стимуляции (I и II группы) в сравнении с женщинами с ПЭ в криоцикле (III группа), но без статистически значимого различия. Почти у 40,0% женщин всех групп цервикальный канал заселен только лактобациллами – 33,3% (13/39); 44,4% (12/27) и 36,0% (23/64) соответственно, преимущественно ассоциациями двух-трех видов. УПМ обнаружены у каждой второй женщины во всех группах. Статистически значимого отличия во всех группах, касающегося колонизации цервикального канала факультативными и облигатными анаэробами, не наблюдалось. Частота выделения G. vaginalis была выше у женщин I (20,5%) и II (22,2%) групп по сравнению с III (6,3%), однако разница оказалась статистически незначимой (р>0,017).
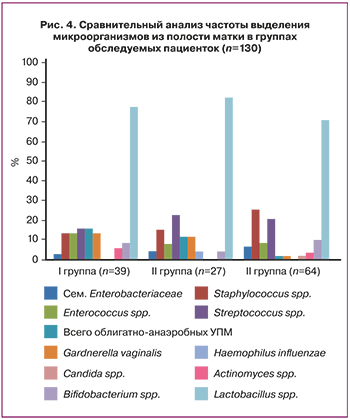
В исследовании был проведен анализ биоматериала из полости матки. Результаты сравнительного анализа микробиоты матки в группах обследуемых женщин представлены на рисунке 4.
По данным культурального исследования содержимого полости матки 130 женщин микрофлора обнаружена в 89,2% случаев. Установлено, что полость матки у женщин I, II и III групп стерильна только в 10,3% (4/39), 7,4% (2/27) и 12,5% (8/64) случаев соответственно. Видовой состав выделенных из полости матки микроорганизмов оказался разнообразным. Доминирующими во всех группах были лактобациллы (14 видов), из которых чаще встречались три вида – L. jensenii, L. crispatus и L. vaginalis. Статистически значимого отличия в частоте колонизации полости матки лактобациллами суммарно и по частоте выделения отдельных видов среди пациенток сравниваемых групп не отмечено (р>0,017). УПМ у пациенток I–III групп выделяли практически с одинаковой частотой – 46,1% (18/39); 44,4% (12/27) и 48,4% (31/64) соответственно (р>0,017).
Обращает на себя внимание, что cтафилококки чаще высевались у пациенток III группы – 25,0% (16/64) по сравнению с пациентками I группы – 12,8% (5/39) и II группы – 14,8% (2/27). Стрептококки чаще встречались у пациенток с повторными неудачами имплантации II – 22,2% (6/27) и III групп с ПЭ в криоцикле – 20,3% (13/64), по сравнению с женщинами с одной попыткой ЭКО 15,4% (6/39). Однако частота выделения энтерококков была выше у женщин I группы – 12,8% (5/39) по сравнению со II – 7,4% (2/27) и с пациентками III группы – 7,8% (5/64). Следует отметить, что высеваемость облигатно-анаэробных микроорганизмов статистически значимо выше в I группе – 15,4% (6/39) по сравнению c III группой – 1,6% (1/64) (р<0,001). Частота выделения G. vaginalis была также выше у женщин в I группе – 12,8% (5/39), чем в III – 1,6% (1/64) (р=0,02).
Данные секвенирования содержимого полости матки показаны на рисунке 5. Приведены наиболее представленные (встречаемость выше 5,0%) рода бактерий по данным секвенирования фрагмента последовательности 16S рибосомальной РНК.
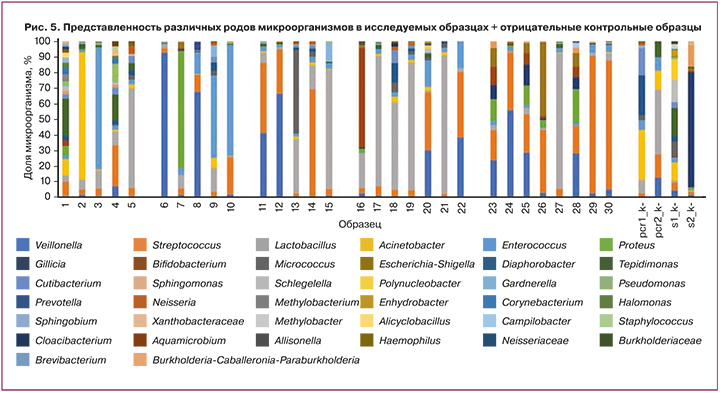
Для образцов со стерильной полостью матки во всех случаях была обнаружена крайне низкая концентрация бактериальной ДНК, сопоставимая с концентрацией ДНК в отрицательных контрольных образцах. В этих образцах обнаруживались микроорганизмы родов Lactobacillus, Tepidimonas, Streptococcus, Acinetobacter, Proteus, Acinetobacter, Enterococcus, Pseudomonas, Veillonella, которые также определяются в отрицательных контрольных образцах. Полученные результаты могут быть обусловлены наличием следовых количеств бактериальной ДНК в каких-то из используемых реактивов и свидетельствуют о том, что метод секвенирования не является достаточно специфичным для работы с образцами с крайне низкой концентрацией ДНК.
В большинстве случаев представленность микроорганизмов в полости матки по данным микробиологических исследований и по данным секвенирования совпадали. В некоторых случаях были обнаружены рода бактерий, которые не были выявлены при микробиологическом исследовании. Эти результаты могут объясняться наличием в образце микроорганизмов, которые по разным причинам не выросли на питательной среде, но при этом их ДНК присутствует в образце.
Секвенирование позволило нам определить количественное соотношение микроорганизмов, однако к этим данным стоит относиться с осторожностью, поскольку исследуются образцы питательной среды, а не непосредственно образец и соотношение может зависеть от скорости роста различных микроорганизмов.
Таким образом, использование данного метода для оценки микрофлоры полости матки в момент ПЭ является сомнительным. Однако применение секвенирования может быть целесообразно при комплексной оценке микробиоты эндометрия и его рецептивности при получении биологического материала с помощью пайпель-биопсии, учитывая большую биомассу материала, чем на эмбриокатетере.
Обсуждение
За последние несколько лет в связи с активным изучением микробиома человека большое внимание в репродуктивной медицине уделяется роли микробиоты полости матки при ПЭ. В настоящее время ведутся многочисленные дискуссии о том, что полость матки не является стерильной. Однако до сих пор нет четкого понимания влияния микрофлоры эндометрия на имплантационные процессы. Кроме того, не изучено, что следует понимать под эубиозом полости матки, а что под дисбиотическим нарушением, отсутствует четкая грань между этими двумя понятиями. Более того, зачастую обнаружение УПМ в репродуктивном тракте и применение антибактериальной терапии не приводят к успеху.
Необходимо отметить, что микрофлора в полости матки обнаружена у 87,7% женщин. Установлено, что полость матки не является свободной от микроорганизмов, и в этом наши результаты совпадают с результатами других авторов [16–23].
Частота наступления беременности на ПЭ у женщин I группы была максимальной (51,3%) по сравнению с пациентками с повторными неудачами имплантации (29,6% и 35,9% соответственно). Несмотря на то, что высеваемость облигатно-анаэробных микроорганизмов и G. vaginalis была статистически значимо выше в I группе по сравнению с III группой (строгие анаэробы – 15,4% и 1,6% (р<0,001)); G. vaginalis – 12,8% и 1,6% соответственно (р=0,02), этот факт не сказался негативным образом на процессе имплантации у данной группы женщин. У пациенток с повторными неудачами имплантации (II и III группы) частота неразвивающихся беременностей составила 12,5% и 17,4% соответственно, в то время как у женщин с одной попыткой ЭКО – 0%. По частоте своевременных родов от числа наступивших беременностей все группы были сопоставимы – 75%, 75% и 73,9% соответственно.
В исследовании Moreno I. et al. [16] оценивалось влияние микробиоты полости матки на имплантацию. Выявлено, что группа пациенток со снижением количества лактобацилл (менее 90%) и преобладанием УПМ (более 10%) в эндометрии, по сравнению с группой с преобладанием лактобацилл (более 90%), имела более низкую частоту имплантации (60,7% против 23,1%, p=0,02), наступления беременности (70,6% против 33,3%, p=0,03), прогрессирующей беременности (58,8% против 13,3%, p=0,02) и частоты родов (58,8% против 6,7%, p=0,002).
В исследовании Kyono K. [24, 25] проанализировали частоту наступления беременности у пациенток с доминированием лактобацилл (содержание лактобацилл более 80%) и группы без доминирования лактобацилл (содержание лактобацилл менее 80% и присутствие УПМ более 20%). Частота наступления беременности была выше у женщин с доминированием лактобацилл (более 80%) – 61,3% по сравнению с пациентками без доминирования лактобацилл (менее 80%) – 40% женщин.
Исследования других авторов свидетельствуют об обратном. Так, в исследовании Kitaya K. et al. [26], напротив, преобладание лактобацилл в полости матки (> 90%) встречалось чаще у женщин с повторными неудачами имплантации – 64,3% (18/28), чем в контрольной группе – 38,9% (7/18). Сходные результаты получены из образцов влагалища, где у женщин с повторными неудачами имплантации доминировали лактобациллы – 67,9% (19/28), в отличие от пациенток с первой попыткой ЭКО – 44,4% (8/18). Частота высеваемости гарднерелл составила 39,3% (11/28) у женщин с повторными неудачами имплантации и 27,7% (5/18) – в контрольной группе.
Кроме того, в исследовании Fang R.L. et al. (2016) обнаружили большее количество лактобацилл у пациенток с хроническим эндометритом (33,2%) по сравнению со здоровой когортой женщин (6,2%) [15]. Таким образом, крайне важным направлением научного поиска становится патогенетически значимое взаимодействие между микробиотой эндометрия и его иммунитетом, а не просто подтверждение присутствия микроорганизмов в эндометрии.
Результаты нашего исследования согласуются с результатами зарубежных исследователей [15, 26]. Нет четких доказательств явного преимущества состава эндометрия с доминированием лактобацилл с точки зрения исходов беременности. Но, очевидно, восстановление микробиоты эндометрия с целью преобладания в нем лактобацилл, благоприятно для имплантации эмбриона. Наличие УПМ в полости матки не повлияло на частоту наступления беременности.
Вероятно, микробиота эндометрия представляет собой совокупность функционально связанных микроорганизмов. И, очевидно, у каждого здорового индивидуума гомеостаз полости матки поддерживают «свои» определенные микроорганизмы. Большую роль играют биопленки, которые представляют собой микробные сообщества. Бактерии в биопленках имеют определенные физиологические свойства. Нормальные биопленки в организме человека представлены микробными сообществами, формирующими физиологическую микрофлору кожи, ротовой полости, влагалища, кишечника и т.д. Но существуют и патологические биопленки, которые часто связаны с хроническими воспалительными процессами.
Однако нельзя исключить негативное влияние на наступление беременности таких видов микроорганизмов, как Haemophilus influenzae и Haemophilus parainfluenzae, обнаруженных в умеренных количествах у пациенток с повторными неудачами имплантации. Данные УПМ обладают большим патогенным потенциалом и нетипичны для биотопа репродуктивного тракта, чаще попадая в него гематогенным путем из ротовой полости.
При сравнении микробиоты полости матки и цервикального канала отмечено, что у 87,9% пациенток эти два биотопа отличались по качественному составу, что не исключает возможность формирования в полости матки самостоятельной микробиоты, отличающейся меньшим видовым разнообразием по сравнению с цервикальным каналом.
Многочисленные дискуссии вызывает сравнение микробиоты верхнего и нижнего отделов генитального тракта. В исследовании Moreno I. et al. примерно в 20% исследуемых образцов влагалищная и эндометриальная микробиоты были различны по микробному составу [16]. Различия между этими биотопами обнаружены у Wee B.A. et al., которые сравнивали микробиоту эндометрия с вагинальным и цервикальными образцами у фертильных и бесплодных женщин [27]. Данные результаты свидетельствуют, что микробиота верхнего и нижнего отделов репродуктивного тракта может быть схожей, но не всегда идентична.
Отдельным этапом работы стало проведение метагеномного секвенирования микробиоты полости матки (дистальная часть эмбриокатетера в среде накопления). Данный метод изучения микробиоты описан в исследованиях зарубежных авторов [16, 19, 20]. В большинстве случаев представленность микроорганизмов в полости матки по данным культуральных и метагеномных исследований совпадали. В некоторых случаях обнаружены рода бактерий, которые не выявлены по данным культурального исследования. Эти результаты могут объясняться наличием в образце микроорганизмов, которые по разным причинам не выросли на питательных средах, но при этом их ДНК присутствует в образце. Полученные данные могут быть обусловлены наличием следовых количеств бактериальной ДНК в используемых реактивах и свидетельствуют о том, что метод секвенирования не является достаточно специфичным для работы с образцами с крайне низкой концентрацией ДНК. Можно полагать, что помимо присутствия микроорганизмов в полости матки важна количественная оценка состава микрофлоры, что в момент переноса проблематично, учитывая низкую потенциальную возможность получения достаточного количества образца с помощью эмбриокатетера. Вторым важным моментом является состояние макроорганизма с точки зрения защиты от разрушающего воздействия микробного фактора на эндометрий. Известно, что в физиологических условиях микроорганизмы инактивируются системой врожденного и адаптивного иммунитета. На ранних этапах этот процесс осуществляется TOLL-NOD и TOLL-RIG подобными рецепторами, располагающимися на поверхности клеток иммунной системы, эпителиоцитах, эндотелиоцитах и фибробластах. Микробная колонизация эндометрия сдерживается также TOLL-like подобными рецепторами, которые, взаимодействуя со структурами микробной клетки, стимулируют механизмы врожденной антимикробной резистентности.
Заключение
Таким образом, учитывая отсутствие статистического подтверждения о влиянии тех или иных микроорганизмов полости матки на репродуктивный исход, микробиота эндометрия требует дальнейшего изучения. Очевидно, значение имеет не только факт наличия микробов, но и индивидуальные особенности макроорганизма, а также взаимодействие микроорганизмов с макроорганизмом. Четкое понимание механизмов дисбиотических процессов развития хронического воспалительного процесса в полости матки, а также его своевременная диагностика и лечение являются одним из основополагающих вопросов в лечении пациенток с неудачами имплантации в анамнезе.



