Пролапс тазовых органов (ПТО) является одной из наиболее часто встречающихся патологий у женщин среднего и пожилого возраста. К 80 годам риск возникновения показаний для хирургического лечения ПТО составляет около 20% [1]. При этом у большинства пациенток, нуждающихся в операции, имеют место сочетанные дефекты лобково-шеечной фасции (цистоцеле или переднее энтероцеле) и крестцово-маточно-кардинального связочного комплекса (апикальный пролапс) [2, 3].
По данным K. Rooney, выраженные формы опущения передней стенки влагалища в 80% случаев сочетаются со значимыми дефектами на апикальном уровне. Автор также отметил, что изолированная хирургическая коррекция на I уровне по DeLancey устраняет и опущение передней стенки влагалища у половины пациенток [4]. И напротив, по данным исследований K. Kenton, хирургическое лечение ПТО без выполнения апикальной поддержки приводит к анатомическому рецидиву у 58% пациенток через год после операции [5]. Большинство методик оперативного лечения ПТО, массово применяемых в стационарах, адресованы II уровню поддержки по De Lancey (передняя и задняя кольпоррафия, паравагинальная реконструкция) [6]. Однако все современные исследования указывают на то, что именно коррекция апикального отдела является ключевым компонентом в лечении ПТО, наиболее сильно влияющим на частоту рецидивов. Существует немало методик, направленных на устранение апикального пролапса, но среди них наиболее изучены сакровагинопексия (открытым и лапароскопическим доступом), крестцово-остистая фиксация и кульдопластика по McCall. Все перечисленные подходы имеют очевидные ограничения и нередко сопровождаются серьезными побочными эффектами и осложнениями. Кроме того, все они значительно технически усложняют хирургическое лечение ПТО, что ограничивает их широкое распространение в рутинной практике.
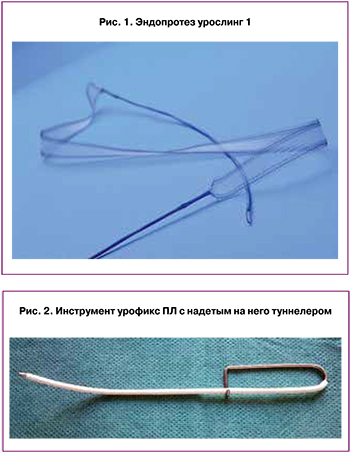 В 2001 году была описана оригинальная методика реконструкции апикального отдела тазового дна влагалищным доступом – задний интравагинальный слинг ЗИВС (англ. – posterior intravaginal sling – PIVS) [7, 8]. По своей сути это вмешательство представляет собой билатеральную крестцово-остистую фиксацию апикального отдела влагалища при помощи ленты из синтетического материала. Данная технология, в отличие от оригинальной общеизвестной крестцово-остистой фиксации, позволяет сохранить центральное положение апикального отдела влагалища, а также исключает необходимость обширной диссекции в области крестцово-остистой связки для ее прошивания. Последнее достигается применением специального инструмента – туннелера, позволяющего провести концы эндопротеза-ленты билатерально через разрезы в коже перианальной области, ягодичные мышцы, ишиоректальное пространство и крестцово-остистые связки. Данная методика показала многообещающие результаты [8], однако не получила широкого распространения в своем классическом виде. Причина последнего заключается в том, что изначально для ЗИВС была предложена несовершенная полифиламентная лента IVS (Tyco Healthcare), которая часто приводила к инфекционным осложнениям и рецидивам. Идея ЗИВС с определенными изменениями мигрировала в технологии Apogee, Elevate apical & posterior (AMS), Prolift posterior (Ethicon) аналоги.
В 2001 году была описана оригинальная методика реконструкции апикального отдела тазового дна влагалищным доступом – задний интравагинальный слинг ЗИВС (англ. – posterior intravaginal sling – PIVS) [7, 8]. По своей сути это вмешательство представляет собой билатеральную крестцово-остистую фиксацию апикального отдела влагалища при помощи ленты из синтетического материала. Данная технология, в отличие от оригинальной общеизвестной крестцово-остистой фиксации, позволяет сохранить центральное положение апикального отдела влагалища, а также исключает необходимость обширной диссекции в области крестцово-остистой связки для ее прошивания. Последнее достигается применением специального инструмента – туннелера, позволяющего провести концы эндопротеза-ленты билатерально через разрезы в коже перианальной области, ягодичные мышцы, ишиоректальное пространство и крестцово-остистые связки. Данная методика показала многообещающие результаты [8], однако не получила широкого распространения в своем классическом виде. Причина последнего заключается в том, что изначально для ЗИВС была предложена несовершенная полифиламентная лента IVS (Tyco Healthcare), которая часто приводила к инфекционным осложнениям и рецидивам. Идея ЗИВС с определенными изменениями мигрировала в технологии Apogee, Elevate apical & posterior (AMS), Prolift posterior (Ethicon) аналоги.
Задачей настоящего исследования явилась оценка эффективности билатеральной крестцово-остистой фиксации современным монофиламентным синтетическим эндопротезом-лентой (задний интравагинальный слинг – ЗИВС) в сочетании с применением оригинальной методики субфасциальной передней (задней) кольпоррафии в хирургическом лечении ПТО с сочетанными дефектами на I и II уровнях поддержки по DeLancey.
Материал и методы исследования
Представленное исследование является ретроспективным (нерандомизированным). Были проанализированы результаты хирургического лечения 166 пациенток, которым была выполнена комбинированная реконструкция тазового дна в соответствии с предложенной методикой (получена приоритетная справка на изобретение) в период с сентября 2014 по апрель 2015 года в отделении урологии ФГБУ СПМЦ Минздрава России (Университетская клиника СПбГУ).
Всем проходившим лечение женщинам заранее была дана информация об операции, технике ее проведения, рисках и возможных осложнениях. Исследование зарегистрировано и одобрено этическим комитетом центра, больными подписано специальное информированное согласие.
Предоперационное обследование включало в себя сбор жалоб, анамнеза жизни и заболевания. Пациентками заполнялись специализированные валидизированные опросники: Pelvic Floor Distress Inventory (PFDI-20), Pelvic Floor Impact Questionnare (PFIQ-7), Pelvic Organ Prolapse\Urinary Incontinence Sexual Questionnare (PISQ-12), International Consultation on Incontinence Modular Questionnaire Short Form (ICIQ-SF). Проводился влагалищный осмотр по системе POP-Q, урофлоуметрия, УЗИ малого таза с определением объема остаточной мочи. Повторные визиты после проведенного лечения выполнялись на сроках 1, 3, 6, 12 месяцев затем ежегодно. Послеоперационное обследование было аналогично предоперационному и дополнялось заполнением визуальной аналоговой шкалы (VAS) от 0 до 100 для оценки удовлетворенности от операции. Субъективным успехом являлось, улучшение значений опросников и показатели VAS >80. Анатомическим рецидивом считалось наличие пролапса в прооперированном компартменте ≥2-й стадии (POP Q).
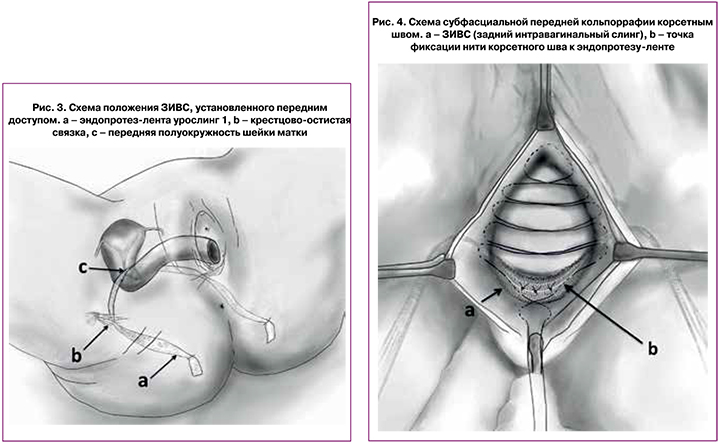
Во всех случаях использовался синтетический эндопротез урослинг 1 (ООО «Линтекс», Санкт-Петербург), который представляет собой цельновязанную ленту с поверхностной плотностью 60 г/м2, с атравматичным краем, шириной 15 мм и толщиной 0,5 мм, макропористой структуры (объемная пористость 72%), выполненный из полипропиленовых или поливинилиденфторидных мононитей диаметром 120 мкм. Протез устанавливался при помощи многоразового металлического проводника-иглы урофикс ПЛ (с облегченной ручкой – «булавка») и одноразового гибкого проводника – туннелера, предоставляемого в комплекте с эндопротезом (рис. 1, 2).
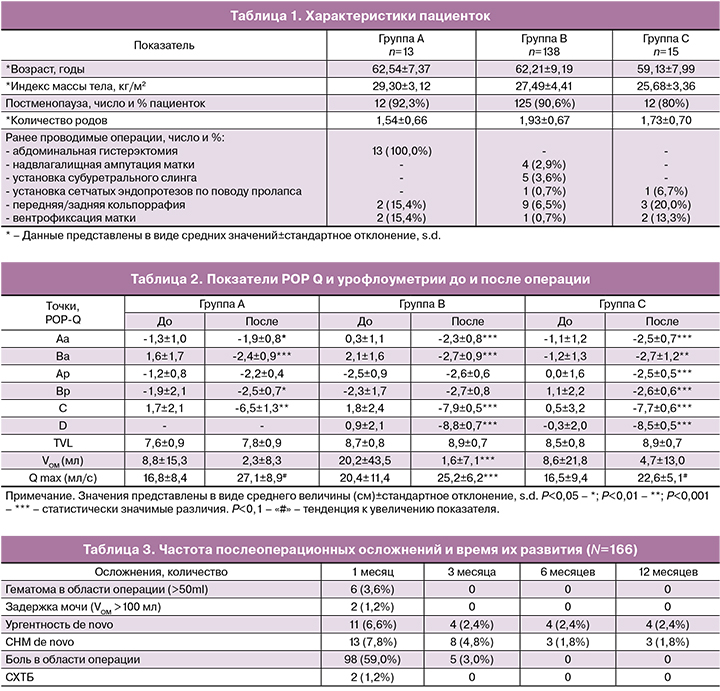
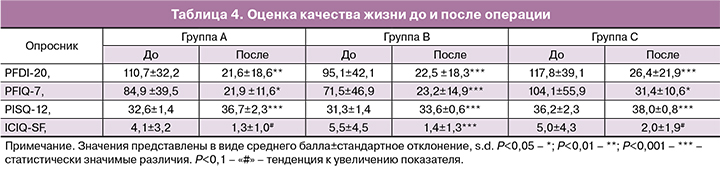
Предоперационная антибиотикопрофилактика проводилась пациенткам за час до операции и включала внутривенную инъекцию ампициллин + сульбактам (1 г+0,5 г). Операции выполнялись под эндотрахеальной или внутривенной анестезией во всех случаях одними и теми же двумя хирургами. Устанавливался уретральный катетер Фоли 18 или 20 Ch. Далее производилась глубокая гидропрепаровка передней (или задней) стенки влагалища 40 мл 0,9% раствора натрия хлорида (соответственно установка эндопротеза производилась через передний и/или задний доступы). Выполнялся срединный разрез передней или задней стенки влагалища длиной 5 см, отступая 2 см от входа в цервикальный канал (в случае постгистерэктомического пролапса разрез выполнялся через ведущую точку пролапса). Затем осуществлялась субфасциальная диссекция паравагинальных тканей тупым путем в направлении сакроспинальных связок с каждой стороны. После идентификации необходимых анатомических структур производились разрезы на коже перианальной области на 5 см латеральнее и 3 см краниальнее анального отверстия. Через разрезы снаружи внутрь вводился металлический проводник с надетым на него тунеллером в направлении сакроспинальной связки. После перфорации последней (отступя не менее 2 см от седалищной ости) дистальный конец туннелера захватывался пальцами, стягивался с проводника и выводился через влагалище. Через тунеллер изнутри наружу проводился эндопротез. Симметричное действие выполнялось с другой стороны (рис. 3). После проведения протез расправлялся и фиксировался к шейке матки 3 швами с использованием нерассасывающейся плетеной полиэфирной нити с фторполимерным покрытием (фторекс USP1 HR 45). В случае отсутствия шейки матки протез фиксировался к субфасциальному кисетному шву (фторекс USP1 или ПГА USP2), наложенному на культю влагалища. При наличии центрального или парацервикального дефекта лобково-шеечной и/или ректовагинальной фасции на последнюю накладывался корсетный шов по Холстеду–Золтану (ультрасорб или фторекс USP1 HR 35x2), причем начало и конец лигатуры связывали между собой и подшивали к фиксированной ранее части эндопротеза (рис. 4). Шов на рану влагалища накладывали рассасывающимся шовным материалом (ПГА USP 2-0). Затем производилось подтягивание эндопротеза за его дистальные концы. За счет тракции апикального отдела с фиксированным к нему субфасциальным швом, происходило восстановление как I, так и II уровня поддержки влагалища по DeLancey. В обязательно порядке контролировался просвет прямой кишки – при необходимости выполнялось ослабление натяжения эндопротеза. Дистальные концы имплантата срезались подкожно. Осуществлялось тампонирование влагалища салфеткой с левомеколем. Уретральный катетер и тампон удалялись на следующее утро после операции.
Полученные клинические результаты анализировались с использованием программной системы Statistica for Windows (версия 10, StatSoft Inc., USA).
Для количественных параметров использовался комплекс описательных статистик: средние значения, стандартное отклонение, ошибка среднего, минимальные и максимальные значения, медианы и квартили. Обработка шкалы QOL и системы POP-Q производилась путем сравнения исходных данных и значений, полученных в процессе наблюдения, они сравнивались с помощью парных критериев Знаков и Вилкоксона.
Анализ частотных характеристик качественных показателей проводился с помощью непараметрических методов c2, c2 с поправкой Йетса (для малых групп), критерия Фишера. Критерием статистической достоверности получаемых выводов мы считали общепринятую в медицинских науках величину Р<0,05.
Результаты
Все пациентки были разделены на 3 группы с учетом анатомического дефекта: A – постгистерэктомический пролапс; В – сочетание апикального пролапса с дефектом лобково-шеечной фасции; С – сочетание апикального пролапса с дефектом ректовагинальной фасции. Основные характеристики больных включали возраст, индекс массы тела, акушерский и гинекологический анамнез (табл. 1). Тридцать шесть женщин (21,7%) имели в анамнезе операции на органах малого таза: абдоминальная гистерэктомия, надвлагалищная ампутация матки, вентрофиксация матки, передняя/задняя кольпоррафия. Семи пациенткам (4,2%) ранее устанавливались сетчатые эндопротезы (Prolift, Elevate, TVT, TVT-O) по поводу пролапса тазовых органов и стрессового недержания мочи.
Из 166 пациенток, которым произведена установка ЗИВС у 138 была одномоментно выполнена передняя субфасциальная кольпоррафия с фиксацией к эндопротезу, у 15 – задняя кольпоррафия, у 13 была произведена фиксация купола влагалища к заднему слингу.
Средний срок наблюдения составил 18 месяцев (14–21). За время наблюдения анатомический рецидив в переднем отделе выявлен у 2,9% (4/138), в заднем – 6,7% (1/15) и в апикальном – 1,8% (3/166). При этом лишь у 2 пациенток стадия пролапса превышала 2А (по классификации POP-Q). Все рецидивы возникли на сроках до 9 месяцев (4,8±6,3). В трех случаях была отмечена прямая связь в развитии рецидива с повышенной физической активностью пациенток, в двух – с обострением ХОБЛ и в одном – с хроническими запорами. У одной пациентки из группы С развился пролапс de novo в переднем компартменте (2-й стадии).
При анализе показателей POP-Q у всех пациенток отмечалось значительное улучшение в ведущих для соответствующих групп точках при отсутствии изменений общей длины влагалища (TVL). Сравнение до- и послеоперационных показателей мочеиспускания выявило статистически значимое (p<0,001) улучшение максимальной скорости потока (Qmax) и снижение объема остаточной мочи (VОМ) у пациенток группы В (табл. 2). У пациенток остальных групп прослеживалась тенденция к увеличению Qmax.
Средняя продолжительность операции составила 32±11 минут (20–65), средний объем интраоперационной кровопотери – 40±10 мл (20–150). Данные показатели существенно не различались между группами. Средний срок дренирования мочевого пузыря составил 1,07±0,69 суток (0,25–5), длительность пребывания в стационаре 3,1±0,75 койко-дня (2–5). За время проведения исследования не зафиксировано случаев интраоперационного повреждения мочевого пузыря или прямой кишки и клинически значимого кровотечения, потребовавшего переливания компонентов крови. Основные послеоперационные осложнения представлены в табл. 3. На всех сроках наблюдения не выявлено ни одного эпизода экструзии эндопротеза. Ургентность de novo развилась в послеоперационном периоде у 7 (5,0%) пациенток из группы В, 2 (13,3%) из группы С и 2 (15,4%) из группы А. В случае развития ГАМП у большинства больных после назначения холинолитиков симптомы регрессировали. Стрессовое недержание мочи (СНМ) de novo было отмечено у 12 (8,7%) женщин из группы В и 1 (7,7%) пациентки из группы А. В течение полугода 8 пациенткам был установлен субуретральный слинг по поводу данной патологии, а 5 пациенток отказались от предложенного хирургического лечения ввиду слабой выраженности недержания. Болевой синдром в ягодичных и крестцово-копчиковой областях, связанный в большей степени с прохождением троакара через большие массивы мягких тканей, окончательно нивелировался ко 2-му месяцу после лечения. Синдром хронической тазовой боли (СХТБ) был зарегистрирован у 2 больных (был связан с травмой таза и копчика в анамнезе) – разрешен консервативно (курс остеопатии) в течение 3 месяцев. Задержка мочи развилась у 2 пациенток и самостоятельно разрешилась в течение 5 дней. Нарушений со стороны функции прямой кишки (констипация/инконтиненция) в послеоперационном периоде выявлено не было.
Большинство пациенток отмечали значительное улучшение качества жизни после проведенного лечения (табл. 4). Жалобы со стороны функции прямой кишки и ее выпадения оценивались с помощью опросников PFDI – 20 и PFIQ-7 и были гораздо реже после операции. Качество сексуальной жизни оценивалось в соответствии с PISQ-12 и также значительно улучшилось после операции. Из 166 пациенток 54 женщины были сексуально активны исходно, из них опросник заполнили 40. Из опрошенных пациенток 7 (17,5%) сообщили об исходно имеющейся диспареунии (определяемой как «всегда» или «обычно» на вопрос 5 PISQ-12, «Вы чувствуете боль во время полового акта?»), которая регрессировала в послеоперационном периоде у 5 (71,4%) из них. Диспареуния de novo развилась у 5 пациенток (15,2%). Кроме того, 15 (13,4%) женщин, не будучи сексуально активными до операции, вернулись к половой жизни через 1 год после лечения.
Оценка удовлетворенности пациенток показала, что были «очень» или «весьма» удовлетворены 87,9% (146/166), «некоторое» или «значительное» улучшение отмечают 9,6% (16/166). В целом, 97,0% (161/166) испытуемых ответили, что они будут рекомендовать процедуры друзьям (VAS>80%).
Обсуждение
Известно, что изолированная коррекция ПТО в переднем отделе связана с высоким риском рецидива, который по данным разных авторов составляет от 10 до 70% [9]. Существует тесная взаимосвязь между I и II уровнем поддержки. Большинство пациентов с ПТО имеют нарушения поддержки в обоих отделах тазового дна. Есть данные, что устранение апикального пролапса в 2 раза снижает риск развития цистоцеле [4]. Предлагаемая нами методика позволяет одновременно устранять ПТО в переднем/заднем и апикальном компартменте с применением минимального количества синтетических материалов. Метод вобрал в себя преимущества пластики собственными тканями и надежность применения сетчатых эндопротезов. Выполнение субфасциальной передней/задней кольпоррафии корсетным швом по Холстеду–Золтану позволяет устранять парацервикальные и центральные дефекты лобково-шеечной (ректо-вагинальной) фасции. При этом отсутствует риск уменьшения длины влагалища, минимизирована вероятность повреждения мочевого пузыря или прямой кишки, сохраняется подвижность стенок влагалища (один из механизмов удержания мочи). Трансвагинальная кресцово-остистая фиксация с помощью эндопротеза восстанавливает физиологическое положение апикального компартмента, не требует выполнения гистерэктомии и позволяет одновременно выполнить переднюю и/или заднюю пластику влагалища без технических сложностей. Дополнительная фиксация шва к эндопротезу усиливает надежность операции за счет создания единой «конструкции», позволяющей эффективно восстанавливать одномоментно и I, и II уровни поддержки тазового дна.
Учитывая достаточно короткий период наблюдения (18 месяцев), оценка долгосрочных результатов предлагаемого подхода на данный момент затруднительна. Вместе с тем, принимая во внимание уже имеющиеся отдаленные результаты применения ЗИВС и классической кольпоррафии, можно рассчитывать на кумулятивный эффект при комбинации двух этих методик. Особенно с учетом усовершенствования техники шва и свойств эндопротеза.
Оптимальный результат того или иного подхода может быть достигнут лишь при строгом соблюдении показаний к его выполнению. В отношении предложенного нами способа это, прежде всего, пациентки с постгистерэктомическим, изолированным апикальным пролапсом и сочетанием его с центральным и/или парацервикальным дефектом лобково-шеечной (ректо-вагинальной) фасции. Необходимо понимать, что данный подход с низкой долей вероятности будет эффективным в случае выраженных латеральных повреждений пубо-цервикальной фасции.
Заключение
Билатеральная крестцово-остистая фиксация вагинальным доступом с применением современного монофиламентного синтетического эндопротеза-ленты (задний интравагинальный слинг – ЗИВС) в сочетании с реконструкцией тазового дна нативными тканями (субфасциальная кольпоррафия) может применяться с высокой эффективностью и безопасностью у пациенток, имеющих комбинацию дефектов лобково-шеечной и ректо-вагинальной фасции (II уровень по DeLancey) с поврежденимями крестцово-маточно-кардинального связочного комплекса (I уровень по DeLancey).



