Вирус папилломы человека (ВПЧ) вызывает заболевания шейки матки, которые способны трансформироваться в рак шейки матки (РШМ) [1]. Ежегодно в мире регистрируются более 400 000 новых случаев РШМ, половина из которых заканчивается летальным исходом (высокий процент этих случаев приходится на женщин репродуктивного возраста) [2].
РШМ предшествуют цервикальные интраэпителиальные неоплазии (CIN). Выбор правильного объема лечения является ключевым моментом в ведении пациенток с CIN, так как слишком радикальная терапия может поставить под угрозу репродуктивную функцию пациенток, а слишком щадящая может оказаться недостаточно эффективной и заболевание может прогрессировать дальше.
Для многих акушеров-гинекологов вопрос ведения пациенток с CIN I является крайне спорным: лечить или динамически наблюдать? Деструктивная терапия может быть оправдана для пациенток, которые относятся к группе высокого риска по прогрессированию заболевания. В отношении пациентов с низким риском, к чему относится спонтанная регрессия, можно выбрать тактику динамического наблюдения. В связи с этим возникает необходимость в поиске и определении эффективных специфичных биомаркеров, обнаруживаемых при помощи молекулярно-генетических методов исследования и оценки молекулярного состава биологических жидкостей и тканей при помощи масс-спектрометрии и ядерно-магнитного резонанса [3].
Исследования последних 10 лет подтвердили высокий потенциал диагностики и прогнозирования различных заболеваний при помощи биологических жидкостей организма, в том числе цервиковагинальной жидкости (ЦВЖ) [4]. Изменение молекулярного состава ЦВЖ может дать важную информацию о патогенезе многочисленных гинекологических заболеваний, в первую очередь – хронических воспалительных процессов нижнего отдела генитального тракта. Изучение протеомного состава ЦВЖ раскрыло патогенетический аспект целого ряда гинекологических заболеваний, таких как бактериальный вагиноз, вагиниты, цервициты [5].
Анализ ЦВЖ с использованием методов протеомики может дать новую информацию о нарушениях реакций иммунитета женских половых органов при ВПЧ-инфекции и ассоциированных с ним заболеваний шейки матки и более глубоко изучить этиологию и патогенез указанных заболеваний.
Цель исследования: изучить протеомный состав ЦВЖ у пациенток репродуктивного возраста для определения риска малигнизации неоплазий шейки матки при ВПЧ-инфекции.
Материал и методы исследования
В одномоментное проспективное исследование были включены 30 женщин в возрасте от 21 до 45 лет (средний возраст 30,5 года), обратившиеся в научно-поликлиническое отделение ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России по поводу наличия патологии шейки матки. Критерии включения: ВПЧ-инфекция, ВПЧ-ассоциированные заболевания шейки матки, регулярный менструальный цикл. Критерии исключения: беременность, период лактации, прием гормональной терапии, наличие инфекций, передающихся половым путем, нарушение функции почек, печени, легких в стадии декомпенсации, наличие психоневрологических заболеваний. Среднее время наблюдения за пациентками составило 6 месяцев.
Комплексное обследование женщин включало: сбор жалоб, анамнеза, гинекологический статус, молекулярно-биологические методы исследования, цитологическое исследование, расширенную кольпоскопию, протеомное исследование ЦВЖ.
Для оценки кольпоскопической картины применяли единую Международную кольпоскопическую классификацию, одобренную на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011 г.). Использовалась цитологическая оценка мазков с шейки матки по системе Бетесда (2004) [6].
Для протеомного анализа проводился забор ЦВЖ после орошения влагалища и шейки матки 5 мг раствором натрия хлорида 0,9%. Забранная жидкость центрифугировалась при условиях: скорость, время и температура центрифугирования 2000 g 10 мин при 4°C.
Для определения мРНК функциональных генов человека забирался мазок из переходного эпителия цервикального канала щеткой, помещался в раствор гуанидина тиоцианата, не центрифугировался.
Для ВПЧ-генотипирования 21-го типа забирался мазок из зоны переходного эпителия щеткой, помещался в пробирку объемом 1,5 мл с 0,9% раствором натрия хлорида (500 мкл), затем центрифугировалось при условиях: 13000 об./мин 10 мин при комнатной температуре.
К образцам ЦВЖ добавляли восстанавливающий буфер (0.2 M Tris-HCl, pH 8.5, 2.5 mM EDTA, 8 M мочевина), затем восстанавливали дитиотреитолом (0.1 М, 45 минут при +39 оС) и алкилировали йодацетамидом (0.05 M, 45 минут, +20оС, в темноте). Белки осаждали добавлением 5 объемов ледяного ацетона, содержащего 0,1% ТФУ, растворяли в 200 mM ABB до концентрации 0,1 мг/мл для последующего гидролиза трипсином в течение 16 часов при 37оС (белок/фермент – 50:1). Концентрацию белка в ЦВЖ определяли по методу Брэдфорда. Хромато-масс-спектрометрический анализ образцов проводился в соответствии с ранее разработанным протоколом [7, 8].
Поиск идентификация белков и полуколичественный анализ проводился по базе данных UniProt Knowledgebase (UniProtKB, версия 16.05.2014) в программе MaxQuant software, version 1.1.1.2 [8]. Считалось, что белок достоверно идентифицирован, если для него нашлось более 2 пептидов (Score >24).
В рамках исследования выполнено определение экспрессии мРНК генов пролиферации и регуляции клеточного цикла (MKI67, CDKN2A), апоптоза (BCL2, BAG1, BAX), эстрогенового (ESR1) и прогестеронового (PGR1) рецепторов, а также количественная оценка ВПЧ в соскобах переходного эпителия цервикального канала методом полимеразной цепной реакции (ПЦР) в режиме реального времени (ДНК-Технология, Россия). Выделение нуклеиновых кислот (РНК и ДНК) проводили с использованием набора реагентов «Проба НК» согласно инструкциям. Во избежание деградации мРНК взятие материала (соскобы из цервикального канала) осуществляли в пробирки с раствором гуанидина тиоцианата (лизирующий раствор наборы «Проба НК»). В качестве праймеров для обратной транскрипции использовали специфические олигонуклеотиды. Нормировка проводилась по трем референсным генам B2M, TBP и GUSB.
ВПЧ-генотипирование (16, 52, 33, 58, 31, 35, 68, 45, 18, 59, 39, 66, 56, 53, 82, 51, 26, 73, 6, 11, 44-й типы) и количественная оценка вирусной нагрузки выполнено методом мультиплексной ПЦР в режиме реального времени (Квант-21).
При статистической обработке данных в качестве меры центральной тенденции количественных признаков выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Для оценки значимости межгрупповых различий применялся U-критерий Манна–Уитни с коррекцией по Бенджамини для множественных сравнений. Метод проекций на латентные структуры (PLS) с программным пакетом ropls использовался для многомерного анализа протеомных данных. В результате белки ЦВЖ были отсортированы в порядке их вклада в кластеризацию образцов (VIP индекс белка).
Помимо оценки экспрессии отдельных генов проведена интегральная оценка уровня экспрессии четырех генов (MKI67, CDKN2A, PGR, BCL2) согласно разработанным ранее критериям определения индекса риска (ИР) развития неопластической трансформации эпителия шейки матки [9]. Индекс риска рассчитывался по формуле:
Z = 0,8*ln [KI67]/[PGR] + 1,6*ln [P16]/[BCL2] – 4, где [KI67]/[PGR] – соотношение уровней экспрессии мРНК KI67 и PGR, [P16]/[BCL2] – соотношение уровней экспрессии мРНК P16 и BCL2.
Разделяющая граница ранее была рассчитана с помощью ROC-анализа и составила 57 единиц 100-бальной шкалы.

Результаты и обсуждение
По результатам исследования было сформировано 4 группы в зависимости от данных цитологического исследования: NILM – интраэпителиальные изменения и злокачественные процессы отсутствуют, ASCUS – клетки плоского эпителия с атипией неясного значения, LSIL – интраэпителиальные изменения плоского эпителия низкой степени, НSIL – интраэпителиальные изменения плоского эпителия высокой степени: 7 пациенток (23%) – ВПЧ-негативные (I группа – контрольная), 23 (77%) – ВПЧ-позитивные, разделены на 3 группы: II группа – 11 (49%) по данным цитологического исследования ASCUS, III группа – 7 (30%) с LSIL, IV группа – 5 (21%) с HSIL. Основная часть обследуемых пациенток были репродуктивного возраста, соматически не отягощены, не имели хронических заболеваний. Средний возраст менархе составил 12,7 года. Средний возраст начала половой жизни – 19,2 года. Общее количество беременностей составило 65, из которых родами завершились 25%, абортами – 40%. Более 4 половых партнеров было у 10 (33%) пациенток. Из перенесенных гинекологических заболеваний в анамнезе выявлена высокая частота инфекций, передающихся половым путем (66%). Клинико-анамнестический анализ показал, что 48% ВПЧ-позитивных женщин отмечали ранее начало половой жизни (до 18 лет).
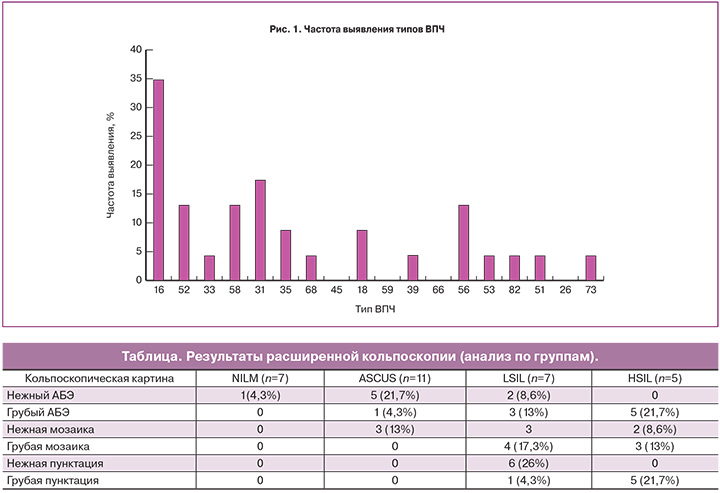
Оценка возрастного распределения показала высокую частоту выявления высокоонкогенных типов ВПЧ в возрасте до 30 лет (52,1%). ВПЧ высокого онкогенного риска выявлены в 90,9% случаев в группе ASCUS и в 100% – группах LSIL и HSIL. Наиболее распространенным типами были ВПЧ 16 (34,8%), 31 (17,4%), 52, 58, 56 (13%), 18, 35 (8,7%), остальные типы встречались у менее 5% (рис. 1). У 69% пациенток вирусная нагрузка была более 5,2lоg (в среднем – 5,6 (5,2–6,2lоg) без существенных различий между группами.
Расширенная кольпоскопия была проведена всем пациенткам. Нормальная кольпоскопическая картина наблюдалась у 7 (23%) пациенток, ненормальная – у 23 (87%). Варианты ненормальной кольпоскопической картины включали в себя слабовыраженные и выраженные изменения, наиболее важным из которых являлось наличие ацетобелого эпителия (АБЭ), интенсивность побеления которого коррелировала со степенью тяжести процесса. Изменения, которые характеризовались как слабовыраженные, выявлялись у 18 (60%), выраженные изменения – у 5 (17%) (таблица).
Общая концентрация белка в контрольной группе составила 0,31±0,09, в группе ASCUS – 0,47±0,22, LSIL – 0,52±0,17, HSIL – 0,52±0,33 мг/мл соответственно; при этом достоверные различия были обнаружены между группами NILM и ASCUS (p=0,049), а также группами ASCUS и LSIL (p=0,018). Протеомный состав ЦВЖ очень разнообразен: в каждом образце было идентифицировано в среднем 335±56 белков, всего обнаружено 683 белка. Среди них наиболее представленными по Gene Ontology являются структурные белки (коллагены, витроментин, белки микротрубочек), белки иммунной защиты (иммуноглобулины, система комплемента, лактоферрины, гаптоглобин и азуроцитин) адгезии и хемотаксиса (витронектин, плакоглобин). По своей локализации 33% белков относятся к водорастворимым белкам цитоплазмы, 17% мембранных белков и 24% белков внутренних компартментов клетки.

По результатам применения метода PLS было достигнуто достоверное разделение контрольных образцов (NILM) и группы с неоплазией (ASCUS, LSIL, HSIL) (рис. 2). Были обнаружены 50 белков (VIP-компоненты), внесшие основной вклад в данную кластеризацию, то есть позволяющие дифференцировать группу с нормальным эпителием шейки матки от групп с неоплазией разной степени тяжести. При полуколичественном анализе содержания этих белков в ЦВЖ оказалось, что более половины белков (54%) в ЦВЖ достоверно снижается при увеличении степени тяжести неоплазии (максимальное значение характерно для группы NILM, минимальное – HSIL). Можно выделить 9 белков характерных только для NILM (Tubulin alpha-1C chain, N-acetylmuramoyl-L-alanine amidase, Complement factor D, Galactose-3-O-sulfotransferase 4, Vitronectin, Peptidoglycan recognition protein 1, Poly(rC)-binding protein 1, Lumican, Serum paraoxonase/arylesterase 1) и 4 белка (Ig kappa chain V-I region Ni, Lymphocyte antigen 6D, Plasminogen activator inhibitor 1 RNA-binding protein, Cytochrome С) обнаруживаются только в группах с неоплазией шейки матки. Другие 13 белков демонстрируют различные тенденции. Для поиска биомаркеров именно эти белки и 4 белка второй группы наиболее перспективны. В частности, концентрация белков теплового шока S100-A9, S100-P, S100-A11, HSPA8, а также Acetyl-CoA-binding protein и Annexin A1 и A2 в группах с неоплазией на порядок выше, чем в контрольной группе. Концентрация белка Alpha-crystallin B chain повышается при развитии неоплазии (ASCUS, LSIL vs NILM) и исчезает в группе HSIL. Vimentin обнаруживается в группах NILM, ASCUS и не детектируется в группах с более тяжелой формой дисплазии (LSIL и HSIL). Tubulin beta chain идентифицируется в ЦВЖ контрольной группы и группы с неоплазией тяжелой степени, полностью отсутствуя в группах ASCUS и LSIL. Следует отметить, что практически все данные белки были ассоциированы с онкогенными процессами, среди которых особое место занимают злокачественные трансформации эпителия шейки матки, легких, пищевода, прямой кишки и ВПЧ-ассоциированные виды рака.
С целью поиска белков с прогностической значимостью для определения риска повышения степени тяжести неоплазии провели сравнение группы ASCUS и LSIL, HSIL (неоплазия средней и тяжелой степени тяжести), используя критерий Манна–Уитни с коррекцией по Бенжамини для множественных сравнений. Концентрация 10 белков ЦВЖ достоверно (p<0,05) различалась между рассматриваемыми группами. Из них 90% белков являются ферментами, причем их концентрация в группе ASCUS значительно выше, чем в других группах, и снижается при прогрессировании неоплазии шейки матки (рис. 3). Только структурный белок Cornifin-B (SPRRB1) снижается при переходе от контроля к ASCUS и вновь повышается при повышении степени тяжести неоплазии.
Профиль экспрессии мРНК исследованных генов (Me) представлен на рис. 4. Наиболее выраженные изменения отмечены для генов CDKN2A (повышение в 5,6 раза (р=0,005) при HSIL, аналогичные тенденции отмечены и для других групп) и PGR (снижение более чем в 5 раз при ASCUS (р=0,043), LSIL и HSIL) по сравнению с контрольной группой.
При интегральной оценке профиля экспрессии 4 генов (KI67, PGR, P16 и BCL2) в группу риска развития и прогрессии цервикальной дисплазии определены 1 пациентка (9%) из группы ASCUS, 3 женщины (43%) из группы LSIL, 3 (60%) из группы HSIL и ни одной пациентки из контрольной группы. Отмечено повышение Ме ИР в исследуемых группах по сравнению с контролем (рис. 5).
По данным интегральной оценки профиля экспрессии 4 генов (KI67, PGR, P16 и BCL2) выделены группы пациентов с LSIL и HSIL низкой и высокой степени риска развития и прогрессии цервикальной дисплазии; был выполнен многофакторный анализ (PLS) данных белкового состава ЦВЖ этих пациентов. В результате было достигнуто достоверное разделение группы с низким риском развития и прогрессии цервикальной дисплазии и группы высокого риска (рис. 6).
Отмечается, что образец 59 оказался вне 95% эллипса Хоттелинга, что говорит о значительном отличии состава протеома ЦВЖ этой пациентки от других пациенток группы низкого риска. Пациентка Х., 24 года, без отягощенного соматического и гинекологического анамнеза. Менструальная функция без особенностей, беременностей в анамнезе не имела, ранняя половая жизнь (с 17 лет), половых партнеров было более 3. ASCUS по цитологии (2014), ВПЧ 31 типа с вирусной нагрузкой 6,7 log. Пациентке была произведена биопсия пораженных участков шейки матки – диагноз LSIL. Клинико-анамнестические данные пациентки не позволили нам выявить основную причину отличия состава ЦВЖ у данной пациентки. Предложено динамическое наблюдение.
Белки, дифференцирующие группы низкого и высокого риска развития и прогрессии цервикальной дисплазии, включают: Ig heavy chain V-III region BRO, Plasminogen activator inhibitor 1 RNA-binding protein, IgGFc-binding protein, Ly6/PLAUR domain-containing protein 3, Zinc finger protein 185, Protein S100-A12, Thioredoxin, Hemoglobin subunit delta, Kallikrein-11, Repetin, Heat shock protein beta-1 и Gamma-glutamylcyclotransferase. Нами был проведен сравнительный анализ выявленных белков их ассоциации с другими злокачественными заболеваниями. Белок Plasminogen activator inhibitor 1 RNA-binding protein является активатором протеазного каскада, принимает участие в внутрисосудистом свертывании крови путем ингибирования эндотелиального активатора плазминогена и рассматривается как перспективный маркер прогнозирования исхода при раке молочной железы, раке яичников. По данным группы ученых во главе с N.B. Serce, данный белок является еще и маркером гинекологических заболеваний, в том числе и рака яичников [10].
IgGFc-binding protein является представителем семейства белков, связывающих инсулиноподобный фактор роста, играет роль в регуляции клеточной пролиферации и дифференцировки, апоптозе, вовлекается в неопластическую трансформацию клетки, ассоциированную с онкогенными типами вируса. IgGFc-binding protein является прогностическим маркером развития рака молочной железы, предстательной железы, легких и колоректального рака [11]. Белок Zinc finger protein 185 является ингибитором метилирования ДНК и участвует в процесс развития рака предстательной железы, легких, печени, меланомы [12]. Protein S100-A12 (calgranulin C) является белком, обладающим провоспалительным цитокиноподобным действием, воздействует на компоненты стенки клетки, модулируя нейтрофильную активность, вовлекается в развитие опухолевого процесса молочной железы, кишечника, легких, мочевыводящих путей и слизистой полости рта [13].
Белок Thioredoxin в больших количествах экспрессируется во время активного роста опухоли – в период гиперваскуляризации ткани и оксидативного стресса при раке молочной железы, поджелудочной железы, пищевода и колоректальном раке [14]. Repetin экспрессируется в клетках эпидермиса, волос и сосочках языка [15], в перспективе рассматривается как прогностический маркер при ВПЧ-ассоциированных раках головы и шеи [16]. Белок Heat shock protein beta-1 играет решающую роль в поддержании клеточного гомеостаза, апоптоза, инвазии, принимает участие в ангиогенезе и оксидативном стрессе, повышение экспрессии которого наблюдается при гепатоцеллюлярной карциноме, лейкемии, глиобластоме и раке поджелудочной железы [17, 18]. Gamma-glutamylcyclotransferase участвует в пролиферации клеток и обнаруживается при раке молочной железы и раке легких [19].
Заключение
Таким образом, нами выявлены белки ЦВЖ, внесшие важный вклад в дифференциацию групп с нормальным эпителием шейки матки от групп с неоплазией различной степени тяжести.



