Антитела к ядерным антигенам представляют собой большую группу антител, реагирующих с нуклеиновыми кислотами и ассоциированными с ними белками. Антитела к экстрагируемым ядерным антигенам взаимодействуют с водорастворимыми комплексами рибонуклеопротеинов в ядре и цитоплазме (SSA/Ro, SSB/La, Sm, RNP/Sm, Scl-70, Jo-1 и др.) и имеют важное диагностическое значение при системной красной волчанке (СКВ), синдроме Шегрена, склеродермии и других системных заболеваниях соединительной ткани [1]. Антитела к двуспиральной ДНК связываются с молекулами нативной ДНК и являются специфичными для СКВ [2]. При этом аутоантитела могут выявляться у женщин за годы до первых клинических проявлений аутоиммунных заболеваний и служить биомаркерами начала и активности заболевания.
Особую роль данные антитела приобретают во время беременности, поскольку они способны оказывать повреждающее действие на плод вследствие трансплацентарного перехода [3–5]. Важно отметить, что нарушение ритма сердца плода часто является первым симптомом аутоиммунного заболевания матери и служит основанием для ее обследования [6]. От 50% до 80% случаев всех брадиаритмий плода обусловлено наличием у матери аутоиммунного заболевания, такого как синдром Шегрена, СКВ, ревматоидный артрит, смешанные или недифференцированные заболевания соединительной ткани, или бессимптомным носительством, главным образом анти-Ro/La антител [7].
Патогенетические механизмы развития аутоиммуноопосредованной брадиаритмии плода, обусловленной присутствием аутоантител к SSA/Ro, включают отложение иммунных комплексов, воспаление и последующее развитие фиброза, кальцификации миокарда и проводящей системы сердца плода и блокады проведения сигнала в атриовентрикулярном (АВ) узле [4, 5].
У 2% новорожденных, матери которых имеют аутоантитела к экстрагируемым ядерным антигенам, прежде всего к SSA/Ro и SSB/La, внутриутробно диагностируется аутоиммуноопосредованная врожденная блокада сердца (ВБС), которая является тяжелым проявлением неонатальной волчанки [3, 5]. Частота смертности при аутоиммунной ВБС достигает 30% и возрастает до 100% при сопутствующем заболевании сердца или врожденном пороке развития [7]. По данным ряда авторов, в первый год жизни 70% новорожденных с ВБС требуется имплантация постоянного электрокардиостимулятора, причем подавляющее большинство детей (до 75–80%) нуждаются в проведении данной операции в первые 2 недели жизни [5].
Трансплацентарный переход аутоантител к SSA/Ro и SSB/La может осуществляться уже с 11-й недели беременности, а начиная с 16–18-й недели могут наблюдаться клинические проявления аутоиммунной ВБС в виде урежения частоты сокращений желудочков до 50–70 ударов в минуту при сохранении нормальной частоты сокращений предсердий [5]. По данным ультразвукового исследования, АВ-блокада II степени определяется по закономерному выпадению желудочковых сокращений, а блокада III степени характеризуется предсердно-желудочковой диссоциацией, при которой предсердия и желудочки сокращаются независимо друг от друга [8, 9].
Полная АВ-блокада, соответствующая III степени тяжести, является наиболее тяжелым и часто необратимым проявлением ВБС. Нередко аутоиммуноопосредованное поражение сердца также включает в себя эндокардиальный фиброэластоз, дилатационную кардиомиопатию и клапанную недостаточность, что существенно повышает перинатальную заболеваемость и смертность [7, 10].
В связи с вышеизложенным, цель настоящего исследования – изучить клинико-диагностическое значение антител к экстрагируемым ядерным антигенам у беременных с брадиаритмией плода.
Материалы и методы
Исследуемую группу (группа 1) составили беременные женщины (n=15) в сроке гестации от 16 до 36 недель с диагностированной брадиаритмией плода. Группы сравнения (группы 2 и 3) составили беременные с аналогичными сроками гестации и нормальным ритмом сердца плода: группа 2 – беременные без аутоиммунных заболеваний (n=20), группа 3 – беременные с диагностированными аутоиммунными заболеваниями (n=10). Все женщины проходили лабораторно-инструментальное обследование и лечение в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России и ФГБНУ «НИИ ревматологии им. В.А. Насоновой». Специальные инструментальные методы исследования включали: еженедельное эхокардиографическое исследование плода, ультразвуковую фетометрию и ультразвуковую допплерометрию плода в динамике, ежедневную антенатальную кардиотокографию. Проводились консультации смежных специалистов.
В группе 1 из 15 женщин 13 (86,7%) на момент постановки на учет по беременности не имели установленного диагноза аутоиммунного заболевания соединительной ткани. В 9 (60%) случаях после 18-й недели гестации внутриутробно была диагностирована синусовая брадикардия у плода, в 6 (40%) случаях – АВ-блокада 2–3-й степени. При комплексном клинико-лабораторном обследовании и диагностическом поиске причины брадиаритмии плода у 4 (26,7%) беременных с АВ-блокадой сердца плода был заподозрен дебют аутоиммунного заболевания: СКВ (n=2), синдрома Шегрена (n=1), СКВ и синдрома Шегрена (n=1). У одной беременной с диагностированной СКВ, не получавшей иммуносупрессивной терапии в полном объеме в связи с аллергической реакцией на гидроксихлорохин, было выявлено нарушение ритма сердца плода в виде синусовой брадиаритмии в сроке 36 недель. У второй пациентки с ревматоидным полиартритом, самостоятельно отменившей специфическую терапию на этапе прегравидарной подготовки и обратившейся в Центр в сроке 23 недели гестации по поводу нарушения ритма сердца плода, была диагностирована АВ-блокада 1–2-й степени. Кроме того, у 2 (13,3%) женщин была диагностирована дилатационная кардиомиопатия.
При сравнительном анализе клинико-анамнестических данных беременных женщин в группах 1 и 2 не было выявлено статистически значимых различий по частоте встречаемости заболеваний органов дыхания, желудочно-кишечного тракта, мочевыделительной и сердечно-сосудистой систем.
В группу 3 вошли 10 беременных с нормальным ритмом сердца плода и диагностированным аутоиммунным заболеванием: СКВ (n=6), синдромом Шегрена (n=5), ревматоидным артритом (n=3), системной склеродермией (n=2) и анкилозирующим спондилоартритом (n=1). Среди сопутствующих соматических патологий у женщин данной группы отмечались: миопия (n=3), аутоиммунный тиреоидит, желчнокаменная болезнь, язвенная болезнь двенадцатиперстной кишки, мочекаменная болезнь, пиелонефрит, тромбофлебит по одному случаю каждого заболевания.
Женщины данных трех групп значимо не различались между собой по паритету, акушерскому и гинекологическому анамнезу и осложнениям настоящей беременности.
Проведение исследования было одобрено Комиссией по этике Центра. От каждой женщины было получено письменное добровольное информированное согласие на участие в исследовании и обработку персональных данных.
Иммунологические исследования включали определение с помощью иммуноферментного анализа в сыворотке крови у женщин антител класса G к экстрагируемым ядерным антигенам (SSA/Ro, SSB/La, Sm), двуспиральной ДНК и антинуклеарных антител (АНА) с использованием наборов ORGENTEC Diagnostika (Германия). Исследования проводили в соответствии с инструкциями фирмы-производителя наборов. Уровень АНА оценивали по значению рассчитанного индекса позитивности (ИП), результат считали положительным при уровне ИП более 1,2.
Статистический анализ полученных результатов выполняли с использованием пакетов прикладных программ Microsoft Office Excel 2010, Statistica for Windows (версия 10) и MedCalc (версия 12). Нормальность распределения значений в выборках оценивали с помощью теста Колмогорова–Смирнова и W-критерия Шапиро–Уилка. При отклонении распределения от нормального данные представляли в виде медианы (Me) с 95% доверительным интервалом (95% ДИ). Достоверность различий между группами определяли с использованием χ2-теста при сравнении частотных показателей, U-теста Манна–Уитни при сравнении непрерывных величин. Наличие связи между независимыми переменными и зависимой бинарной переменной оценивали с помощью анализа логистической регрессии и ROC-анализа (Receiver Operating Characteristics). Различия считали статистически значимыми при уровне значимости P<0,05.
Результаты и обсуждение
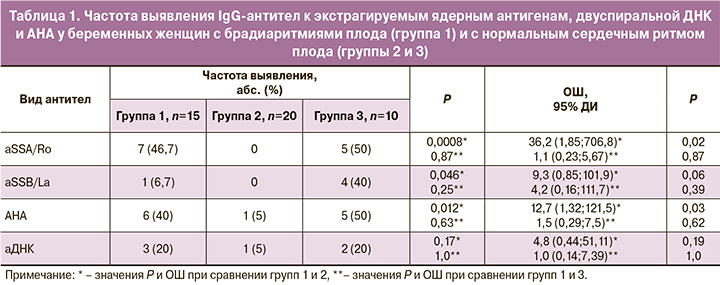
Повышенные уровни аутоантител были найдены у 8 (53,3%) матерей с брадиаритмией плода: у 5 – с АВ-блокадой сердца и у 3 – с синусовой брадикардией. Наиболее часто обнаруживались IgG-антитела к антигену SSA/Ro (у 46,7%) и АНА (у 40%), которые выявлялись значимо чаще, чем в группе 2 (табл. 1). Риск обнаружения IgG-антител к SSA/Ro и АНА был выше у беременных с брадиаритмией плода, чем в группе 2 с нормальным сердечным ритмом плода, соответственно в 36,2 и 12,7 раза. При этом у одной беременной с повышенным уровнем антител к SSA/Ro, равным 30,1 Ед/мл (норма 0–25 Ед/мл), ИП АНА составлял 1,0 и соответствовал нормальному диапазону. Такое расхождение результатов может объясняться разной чувствительностью определения антител в этих тестах. Важно отметить, что в группе с брадиаритмиями плода антитела к антигену SSA/Ro выявлялись значимо чаще, чем к SSB/La (р=0,015). Антитела к экстрагируемому ядерному антигену Sm не были найдены ни в одной из трех групп.
Следует отметить, что в группе 1 большинство женщин (86,7%) не имели диагностированного ревматического заболевания на момент постановки на учет по беременности. По результатам клинико-лабораторного обследования у 4 беременных с АВ-блокадой сердца плода и у 1 пациентки с брадикардией плода, положительных на антитела к SSA/Ro (n=5), АНА (n=5) и антитела к двуспиральной ДНК (n=2), был заподозрен дебют синдрома Шегрена и/или СКВ. Полученные результаты согласуются с данными систематического обзора (2015), демонстрирующими высокую распространенность бессимптомного носительства анти-SSA/Ro и анти-SSB/La антител у матерей, дети которых страдают ВБС [10]. Эти антитела могут быть обнаружены за несколько лет до постановки диагноза СКВ или синдрома Шегрена, а аутоиммунная ВБС может быть одним из первых косвенных признаков ревматического заболевания у женщин детородного возраста.
У двух матерей в группе 2 с нормальным сердечным ритмом плода были обнаружены низкие титры антител к ДНК или АНА, что может рассматриваться как носительство антител, которое встречается у здоровых людей без клинических проявлений аутоиммунных заболеваний с частотой 10–15%. В этом случае рекомендуются проведение повторного исследования антител и динамическое наблюдение для своевременной диагностики возможного развития аутоиммунного заболевания. Кроме того, данные антитела могут выявляться у родственников первой линии больных, страдающих ревматическими заболеваниями, у пациентов с аутоиммунными заболеваниями щитовидной железы, печени, инфекционными заболеваниями, на фоне приема некоторых лекарственных препаратов, включая антиаритмические, гипотензивные, противоэпилептические препараты и антидепрессанты. Однако влияние данных факторов у серопозитивных пациенток в группе 2 было исключено.
В группе 3 у женщин с диагностированными аутоиммунными заболеваниями, включающими СКВ (у 60%), синдром Шегрена (у 50%), ревматоидный артрит (у 30%), системную склеродермию (у 20%) и анкилозирующий спондилоартрит (у 10%), в 70% случаев были обнаружены IgG-антитела к SSA/Ro, SSB/La, двуспиральной ДНК и АНА (см. табл. 1). IgG-антитела к SSB/La обнаруживались у пациенток с ревматическими заболеваниями чаще, чем в группе 1 (р=0,046).
Медианный уровень IgG-антител к антигену SSA/Ro и ИП АНА был значимо выше у беременных с брадиаритмией плода, чем в группе 2 с нормальным сердечным ритмом плода (рис. 1). Уровни аутоантител другой специфичности в этих группах значимо не различались. Значимые различия между медианными уровнями исследованных антител в группах 1 и 3 не были обнаружены.
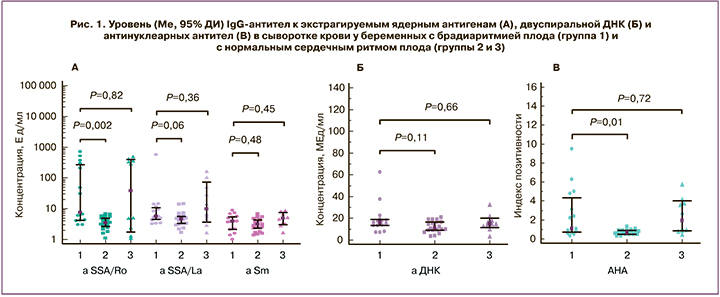
У 6 (40%) беременных женщин в группе 1 в сроке 26,3 (1,9) недели гестации была диагностирована АВ-блокада сердца плода 2–3-й степени, при этом у 5 из них наблюдались высокие уровни антител к SSA/Ro и АНА, у 1 – антител к SSB/La, у 1 – антител к ДНК. Медианные уровни IgG-антител к SSA/Ro и АНА в сыворотке крови у матерей с АВ-блокадой сердца плода (332,9 [3,0;721] и 4,9 [0,9;9,5] соответственно) были выше, чем у матерей c синусовой брадикардией плода (5,9 [3,0;47,2] и 0,7 [0,3;3,1]) (рис. 2). Уровень антител к Ro/SSA у 3 новорожденных с ВБС соответствовал или был ниже уровня антител у их матерей; при этом средние значения уровня антител у детей и матерей составляли соответственно 362,7 (104,5) Ед/мл и 496,7 (127,3) Ед/мл и значимо не различались (р=0,23).
В то же время у беременных с синусовой брадикардией плода медианный уровень антител к SSA/Ro был выше, чем в группе 2 с нормальным сердечным ритмом плода (3,5 [1,1;6,8]; р=0,024); при этом медианный уровень АНА у этих женщин значимо не отличался от уровня антител в группе 2 (0,7 [0,3;1,3]; р=0,68).
Полученные результаты согласуются с данными других исследований, демонстрирующими более высокие сывороточные уровни антител к SSA/Ro и SSB/La антигенам у матерей с аутоиммунной ВБС плода, чем у матерей не пострадавших детей [10]. Предполагается, что титры анти-SSA/Ro антител могут иметь прогностическое значение при оценке риска развития аутоиммунной ВБС [11]. По данным систематического обзора литературы, аутоиммунная ВБС, опосредованная антителами к SSB/La, наблюдается значительно реже и составляет менее 1% известных случаев аутоиммунной ВБС, поэтому эти антитела не рекомендуется использовать в качестве биомаркера для прогнозирования аутоиммунной ВБС [10].
У матерей с детьми, страдающими ВБС, при оценке аутоиммунитета могут обнаруживаться аутоантитела другой специфичности, антитела к двуспиральной ДНК и Sm-антигену при СКВ, ревматоидный фактор при ревматоидном артрите и синдроме Шегрена, анти-RNP антитела при смешанных заболеваниях соединительной ткани [10]. Рассматривается возможность дополнительного тестирования на эти антитела матерей с ВБС плода, отрицательных на антитела к антигенам SSA/Ro и SSB/Lа.
По данным ROC-анализа, определение IgG-антител к SSA/Ro и АНА у беременных с АВ-блокадой сердца плода характеризовалось высокими значениями чувствительности, специфичности, площади под ROC-кривой (AUC), положительной и отрицательной прогностической значимости (табл. 2); при этом точность тестов составляла в обоих случаях 96,2%.
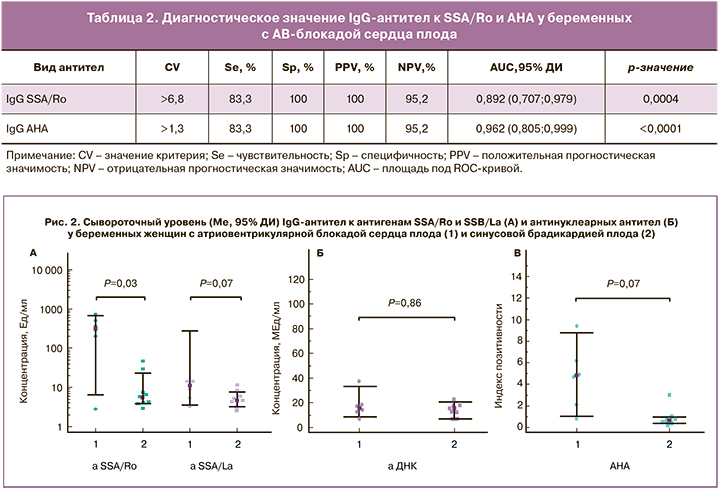
Построенные ROC-кривые позволяли дифференцировать матерей с АВ-блокадой сердца плода и нормальным сердечным ритмом плода по уровню IgG-антител к SSA/Ro и АНА (рис. 3), при этом показатели площади под кривой значимо не различались (р=0,87). Предсказательная способность модели оценивалась по значениям AUC как очень хорошая (AUC>0,8) при использовании в качестве предиктора IgG-антител к SSA/Ro и отличная (AUC>0,9) – при использовании в качестве предиктора АНА. По данным логистического регрессионного анализа, при комбинации IgG-антител к SSA/Ro и АНА значение AUC повышалось до 0,967 (95% ДИ 0,811–0,999) (P<0,0001), точность теста в этом случае составляла 96,2%.
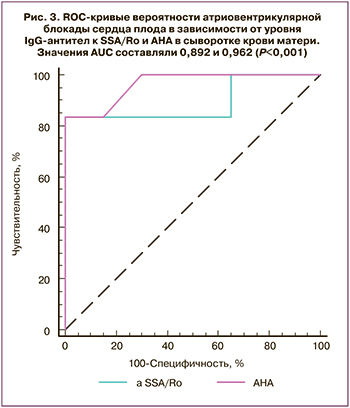 Высокое диагностическое значение антитела к SSA/Ro имели также при синусовой брадикардии плода; при этом значение AUC составляло 0,767 (95% ДИ 0,573–0,903; P=0,005), чувствительность – 55,6%, специфичность – 85%, PPV – 62,5%, NPV – 80,9%, точность теста – 79,3%. Предсказательная способность модели в данном случае оценивалась как хорошая (AUC>0,7).
Высокое диагностическое значение антитела к SSA/Ro имели также при синусовой брадикардии плода; при этом значение AUC составляло 0,767 (95% ДИ 0,573–0,903; P=0,005), чувствительность – 55,6%, специфичность – 85%, PPV – 62,5%, NPV – 80,9%, точность теста – 79,3%. Предсказательная способность модели в данном случае оценивалась как хорошая (AUC>0,7).
Установлено, что аутоантитела, специфичные к антигену SSA/Ro, способны распознавать одну или две его изоформы (Ro 52 кД и Ro 60 кД). Специфический эпитоп Ro52, соответствующий аминокислотам 200–239 и обозначаемый p200, рассматривается как серологический биомаркер повышенного риска развития аутоиммунной ВБС [4]. По данным Tonello M. et al. (2016), матери, имеющие комбинацию антител к Ro60, Ro52 и p200, наиболее подвержены ВБС, чем женщины с другими профилями антител [12]. Выявление высокого уровня антител может быть полезным для отбора матерей с повышенным риском развития ВБС плода, проведения мониторирования с эхокардиографией сердца плода и назначения пренатального лечения [13].
Выраженное повреждающее действие анти-Ro/SSA антител на проводящую систему сердца плода связано с массивной трансплацентарной передачей антител и активностью кардиального органогенеза. Анти-Ro/SSA антитела могут вызывать нарушение ритма сердца плода в результате перекрестного реагирования и ингибирования нескольких ионных каналов, в первую очередь кальциевых каналов L- и T-типа, а также калиевых каналов [14]. Экспрессия этих каналов и их вовлечение в электрофизиологию сердца различаются на разных этапах жизни человека. Так, кардиомиоциты плода характеризуются низкой экспрессией кальциевых каналов L-типа, поэтому воздействие антител может легко приводить к значительному снижению притока кальция и вызвать критическое торможение электрической активности кардиомиоцитов. Кроме того, кардиомиоциты плода легко подвергаются апоптозу; при ВБС апоптоз повышается более чем в 30 раз по сравнению с нормальным сердцем плода.
Системные глюкокортикоиды были первыми препаратами, предложенными в качестве базовой терапии ревматических заболеваний, и рассматриваются как потенциальное терапевтическое средство для лечения ВБС [15]. Согласно литературным данным, дексаметазон и бетаметазон способствуют снижению титра аутоантител в крови матери, но не воздействуют непосредственно на миокард и проводящую систему сердца плода. Показано, что монотерапия с использованием фторированных глюкокортикоидов не оказывает существенного влияния на улучшение исходов беременности для плода, однако способствует уменьшению перикардиального или плеврального выпотов, степени выраженности асцита и водянки плода [16, 17]. В то же время при назначении комбинации глюкокортикоидов и препаратов внутривенного иммуноглобулина женщинам с АВ-блокадой сердца плода и сопутствующей кардиомиопатией и/или эндокардиальным фиброэластозом в сроке 23 недели беременности получен оптимистичный результат с выживаемостью новорожденных 80% в течение проспективного наблюдения со средней продолжительностью 2,9 года без необходимости трансплантации сердца [18]. Однако требуются дальнейшие исследования для оптимизации схемы терапии и подтверждения ее эффективности.
В связи с известным ингибирующим эффектом гидроксихлорохина на сигнальные пути TLR данный препарат был предложен для превентивной терапии аутоиммунной ВБС [19]. Показано снижение риска возникновения кардиальных нарушений у плодов и новорожденных при назначении гидроксихлорохина беременным с СКВ, позитивным на антитела к SSA/Ro. Дальнейшие исследования подтвердили, что применение гидроксихлорохина снижает частоту рецидивов ВБС при последующих беременностях высокого риска [20]. Данные, полученные Martínez-Sanchez et al. (2017), о более низкой распространенности ВБС плода у матерей, принимающих гидроксихлорохин, подтверждают перспективность применения препарата для превентивной терапии [21].
В настоящее время нет стандартного руководства по лечению аутоиммунной ВБС. Показано, что применение эфферентных методов терапии является эффективным в удалении антител к SSA/Ro и SSB/La, связанных с патогенезом ВБС [22]. Комбинированная терапия, включающая плазмаферез, внутривенный иммуноглобулин и бетаметазон, рассматривается как эффективная и безопасная для лечения ВБС [23].
Тактика лечения аутоиммуноопосредованной брадиаритмии плода включала использование эфферентной терапии (лечебный плазмаферез), применение пульс-терапии системными глюкокортикоидами, назначение глюкокортикоидов (метипред) и гидроксихлорохина (плаквенил) в качестве базисной терапии. Оптимальное количество курсов эфферентных методов терапии и пульс-терапии дексаметазоном определялось в индивидуальном порядке и зависело от степени АВ-блокады плода и динамики титра аутоантител на фоне проводимой специфической терапии. Так, в связи с прогрессированием брадиаритмии плода и нарастанием титра антител к SSA/Ro и SSB/La четырем беременным потребовалось проведение повторного курса эфферентной терапии. При совместном использовании лечебного плазмафереза и специфической иммуносупрессивной терапии под контролем мониторинга частоты сокращений и ритма сердца, динамического эхокардиографического исследования сердца плода в двух случаях отмечались регрессия АВ-блокады и восстановление синусового ритма, несмотря на высокий титр АНА и анти-SSA/Ro антител. В остальных случаях прогрессирование нарушения ритма сердца плода и развитие неиммунной водянки не наблюдались, что позволило пролонгировать беременность до доношенного срока.
Существенный вклад в понимание вопроса профилактики аутоиммуноопосредованной брадиаритмии плода внесли результаты проведенного иммунологического обследования беременных 3-й группы с ревматическими заболеваниями. Так как данные женщины проходили прегравидарную подготовку, в большинстве случаев беременность у них наступила на фоне стойкой ремиссии аутоиммунного заболевания. Женщины с ранних сроков находились под тщательным динамическим наблюдением ревматолога и акушера-гинеколога, получали необходимую иммуносупрессивную терапию в виде монотерапии или комбинации системных глюкокортикоидов и гидроксихлорохина, начиная с прегравидарного этапа, на протяжении всего периода гестации, что, вероятно, позволило избежать необратимого поражения проводящей системы сердца плода.
Заключение
Таким образом, у матерей с брадиаритмией плода отмечаются более высокая частота выявления и титры IgG-аутоантител к антигенам SSA/Ro и АНА, чем у беременных с нормальным сердечным ритмом плода. Эти антитела являются независимым фактором риска брадиаритмии плода, имеют высокое диагностическое значение при АВ-блокаде сердца плода. Антитела к SSA/Ro выявляются при брадиаритмиях значимо чаще, чем антитела к SSB/La. Специфическое лечение ревматического заболевания у матерей способствует нормальному ритму сердца плода. Определение аутоантител к SSA/Ro у бессимптомных носителей – матерей с брадиаритмией плода позволяет выявить группу риска развития аутоиммунной ВБС, провести превентивную терапию для улучшения исхода беременности и состояния плода. Исследования в этом направлении продолжаются.



