Воспалительные заболевания органов малого таза остаются актуальной проблемой гинекологии, и наибольший удельный вес в этой группе принадлежит хроническому воспалению придатков матки (ХВПМ) [1, 2]. Раннее коитархе, большое количество половых партнеров, неадекватная диагностика и лечение инфекций, передающихся половым путем, – все вышеперечисленное является неблагоприятным фоном для развития заболевания. ХВПМ нередко отличается рецидивирующим течением и в ряде случаев осложняется формированием гнойников – тубоовариальных абсцессов (ТОА) [3, 4]. В этих случаях отмечаются выраженные не только функциональные, но и морфологические изменения тканей. К сожалению, клиницисты не всегда своевременно оценивают произошедшие структурные изменения в придатках матки, что приводит к выбору неправильной тактики ведения больных и отсрочке оперативного лечения. Причины вышеизложенного связаны с использованием неинформативных диагностических тестов, ростом аутоиммунных заболеваний, нарушением иммунного ответа организма, несоответствием между клинической картиной ТОА и морфологическими изменениями в них.
Известно, что в основе любого воспалительного процесса и его исхода лежит сложный иммунопатологический процесс, запуск цитокинового каскада, баланс провоспалительных и противовоспалительных цитокинов [5]. Ряд исследователей проводили исследование цитокинов перитонеальной жидкости (ПЖ) при различной гинекологической патологии [6, 7].
В связи с этим изучение концентрации нескольких цитокинов как в сыворотке крови, так и в очаге воспаления заслуживает внимания.
Цель исследования: оценить клинико-морфологические особенности, экспрессию цитокинов в сыворотке крови и в ПЖ у больных с ТОА.
Материалы и методы
Мы провели клинико-статистические, биохимические, иммунологические и морфологические исследования у 476 женщин. Основную группу составили 456 пациенток с ТОА. Группу сравнения составили 20 здоровых женщин, которым была проведена лапароскопическая стерилизация с удалением маточных труб.
Обследование пациенток включало: изучение анамнеза, общеклинические лабораторные, бактериоскопические (исследование мазков влагалищного содержимого), инструментальные (трансвагинальное и трансабдоминальное ультразвуковое исследование органов малого таза), иммунологические, морфологические и статистические методы исследования, определение ДНК микроба с помощью полимеразной цепной реакции. Показатель клеточно-фагоцитарной защиты определяли по формуле О.Н. Бурой (1993) как отношение суммы количества палочкоядерных, сегментоядерных нейтрофилов, моноцитов крови к лейкоцитозу (количеству лейкоцитов), умноженное на 100.
Количественная оценка уровней цитокинов: интерлейкинов (ИЛ)-1β, ИЛ-4, ИЛ-6, фактора некроза опухоли (ФНО)-α, фибронектина в сыворотке крови и ПЖ оценивали с помощью тест-систем ЗАО «Вектор-Бест» (Новосибирск, Россия). Забор ПЖ осуществляли интраоперационно при пункции абсцесса придатков матки в день поступления. В группе сравнения ПЖ собирали во время лапароскопической стерилизации.
Критерии исключения для проведения иммунологического исследования: системные аутоиммунные заболевания, инфекционные генитальные и экстрагенитальные заболевания, доброкачественные и злокачественные опухоли, тяжелые формы экстрагенитальной патологии.
Все больные с ТОА были подвергнуты хирургическому лечению с последующим морфологическим исследованием операционного материала (n=456). Объем операции состоял в одностороннем удалении придатков матки и по показаниям был расширен до гистерэктомии (n=62). В ряде случаев проведены резекция большого сальника (n=39) и аппендэктомия (n=24). Для гистологического исследования материал фиксировали в 10% нейтральном растворе формалина и жидкости Кернца, затем заливали в парафин, готовили срезы с последующей окраской гематоксилин-эозином, пикрофуксином, на фибрин по Маллори, фукселином на эластические волокна. Проводили ШИК-реакцию с амилазным контролем, импрегнацию нервных волокон азотнокислым серебром по Бильшовскому–Грос.
Морфометрическое исследование структурных компонентов операционного материала проводилось по Г.Г. Автандилову (1990) с применением цифровой видеокамеры, входящей в структуру видеокомплекса для микроскопии, и компьютерной программы «Видео-тестморфо», позволяющей учитывать как мерные, так и счетные признаки.
Статистический анализ
Статистическую обработку данных проводили с использованием пакета программ статистической обработки STATISTICA for Windows 10.0. Количественное описание величин представляли в виде среднего арифметического (М) и стандартного отклонения (SD). Учитывая нормальное распределение данных, определение статистически значимых различий между количественными показателями было выполнено с использованием t-критерия Стьюдента. За критический уровень значимости принималось значение p<0,05.
Результаты и обсуждение
Средний возраст больных с ТОА составил 36,4 (1,2) года (от 18 до 54 лет). Наибольшее число женщин – 282/456 (61,8%) находились в активном репродуктивном возрасте (20–40 лет). У 297/456 (65,1%) женщин в анамнезе отмечены неоднократные госпитализации по поводу ХВПМ.
Анамнестически установлено, что почти треть больных занимались самолечением с применением анальгетиков и антибиотиков. 93/456 (20,3%) пациенток проходили длительное амбулаторное лечение у гинекологов и терапевтов в связи с повышением температуры. В этих случаях врачи недооценили серьезность сложившейся ситуации, что привело к поздней госпитализации.
Основными жалобами всех пациенток являлись тазовые боли различной степени выраженности, повышение температуры тела до 38–39,4°С, патологические выделения из половых путей, общая слабость, недомогание, снижение работоспособности, отсутствие аппетита.
Состояние женщин при поступлении в гинекологическое отделение в большинстве случаев было оценено как удовлетворительное, у 91/456 (19,9%) – средней степени тяжести, у 74/456 (16,2%) – тяжелое. При влагалищном исследовании и при ультразвуковом исследовании во всех наблюдениях подтвержден диагноз гнойного придаткового образования.
Изменения периферической крови принято считать одним из объективных диагностических критериев любого воспалительного процесса. Наиболее характерными признаками были анемия, лейкоцитоз с нейтрофильным сдвигом, токсическая зернистость лейкоцитов. У 8/456 (91,75%) больных отсутствовали моноциты, а лимфоцитопения ниже 3% клеток констатирована у каждой десятой больной (47/456 (10,3%)).
Количество лейкоцитов у женщин с ТОА в периферической крови колебалось в пределах 2,9–16,9×109/л, в среднем – 10,88 (0,97)×109/л, палочкоядерный сдвиг достигал 15%. Показатель клеточно-фагоцитарной защиты по формуле О.Н. Бурой составил 680,9 (35,6), что в 1,6 раза ниже, чем у здоровых женщин (1182,6 (64,3)). Это свидетельствует о фагоцитарной недостаточности у пациенток с воспалительными заболеваниями. Мы отметили у всех пациенток с ТОА повышение скорости оседания эритроцитов (СОЭ) – в среднем 35,57 (8,2) мм/ч, а также С-реактивного белка – в среднем 76,3 (9,2) мг/л. Биохимический анализ крови показал изменение белковых фракций даже при нормальном содержании общего белка, гипоальбуминемию, снижение белкового (альбумин-глобулинового) коэффициента до 0,67 в тяжелых случаях. Степень диспротеинемии находилась в зависимости от тяжести воспалительного процесса. Гиперкоагуляция, как правило, сопутствует воспалительному процессу, и в наших исследованиях средний уровень фибриногена у пациенток с ТОА составил 4,96 (0,52) г/л против 2,43 (0,4) г/л в группе сравнения; в тяжелых случаях выявлено его повышение до 16,6 г/л.
По результатам обследования микроценоза влагалища, в основной группе больных обнаружены кандидоз (85/456 (18,6%)), бактериальный вагиноз (79/456 (17,3%)), трихомониаз (18/456 (3,9%)), гонококковая инфекция (7/456 (1,5%)), хламидийная инфекция (28/456 (6,1%)). В 86,8% (396/456) случаев преобладал воспалительный тип мазка: большое количество лейкоцитов и кокковая микрофлора (IV степень чистоты).
Как известно, основой воспалительного процесса любой этиологии является запуск цитокинового каскада. Согласно литературным данным, при воспалительных процессах наблюдается гиперпродукция провоспалительных (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8) и относительная недостаточность синтеза противовоспалительных (ИЛ-4 и ИЛ-10) цитокинов. Поскольку практически все клетки организма имеют рецепторы к ИЛ-1, этот цитокин очень быстро активирует их для участия в локальной воспалительной реакции. Наши исследования показали, что среднее содержание ИЛ-1β в крови здоровых женщин было 14,22 (1,33) пг/мл, а у пациенток с ТОА – почти в 27 раз больше (таблица). В ПЖ уровень ИЛ-1β у больных с ТОА также был значительно повышен, что может быть критерием тяжести воспалительного процесса.
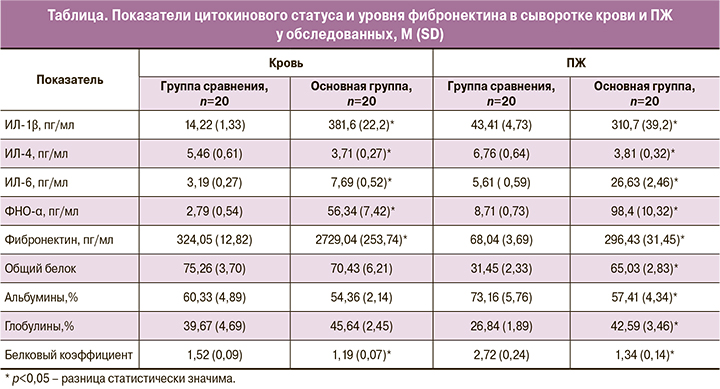
Концентрация ФНО-α, по нашим данным, была увеличена во всех исследованных биологических средах. В ряде экспериментальных и клинических работ было показано, что ФНО-α способен как ингибировать выработку эритропоэтина, так и активировать гепсидин, что может вызывать анемию хронического воспаления [8]. У пациенток с ТОА анемия была выявлена в 146/456 (32,0%) наблюдениях, поэтому при обнаружении анемии у пациенток и отсутствии выраженного болевого синдрома врачу общей практики нужно подумать о возможном наличии воспалительного процесса, в частности, ХВПМ.
ИЛ-1 и ФНО-α являются цитокинами первой волны и обуславливают ряд клинических эффектов: лихорадку, лейкоцитоз, а также потенцируют секрецию ИЛ-6 в макрофагах. Далее ИЛ-6 запускает секрецию острофазовых белков, в первую очередь С-реактивного протеина и фибриногена [9, 10]. В своей работе мы подтвердили увеличение всех вышеназванных молекул как в сыворотке крови, так и в очаге гнойного воспаления.
Анализ содержания ИЛ-4 показал его снижение как в сыворотке крови (в 1,47 раза), так и в экссудате (в 1,77 раза) в сопоставлении с группой сравнения (таблица).
Что касается уровня фибронектина, мы выявили усиление его продукции в основной группе в исследуемых жидкостях. Концентрация фибронектина в экссудате ТОА более чем в 4 раза превышала аналогичный показатель в группе сравнения. Источниками тканевого и плазменного фибронектина являются нейтрофилы, макрофаги, тромбоциты, фибробласты, на поверхности которых он располагается в виде ячеистой сети, а также сосудистый эндотелий, моноциты, тканевые базофилы. Как локальный опсонин, плазменный фибронектин в значительной мере определяет фагоцитарную функцию ретикулоэндотелиальной системы в защите от инфекции; он играет значительную роль в очищении крови от продуктов распада коллагена [11]. Мы считаем, что увеличение сывороточного уровня фибронектина является типичной реакцией организма на воспаление, направленной на элиминацию патогена.
Как мы указывали выше, все больные были подвергнуты оперативному лечению.
Макроскопически ТОА представлял собой единый конгломерат неправильной формы, размерами до 15–20 см в диаметре, багрово-серого цвета. Со стороны наружной поверхности брюшина выглядела тусклой, гиперемированной, с фибринозными наложениями в виде нитей и хлопьев фибрина. Во всех случаях в воспалительный инфильтрат входили матки, прядь большого сальника, а также петли кишечника, стенка мочевого пузыря, которые в большей части наблюдений были покрыты фибрином. Микроскопические исследования подтвердили макроскопические проявления заболевания. Гистологически в стенке ТОА нами выявлен диффузный воспалительный инфильтрат, состоящий из моноцитарно-макрофагальных элементов, лимфоцитов, в отдельных зонах которого были сохранены очаговые инфильтраты с преимущественным включением лейкоцитов, т.е. своеобразные микроабсцессы, свидетельствующие о периодическом обострении процесса и поддерживающие выброс провоспалительных цитокинов, что также согласуется с нашими исследованиями. Характерно выраженное изменение мышечных слоев стенки трубы, которые замещаются соединительной тканью. Согласно данным литературы, фибронектин играет важную роль в формировании внеклеточного соединительнотканного матрикса, так как обладает выраженным сродством к коллагену и фибрину. Мы считаем, что высокая концентрация фибронектина в зоне ТОА приводит к повышенному образованию соединительной ткани в очаге воспаления, что изменяет гистоархитектонику маточной трубы и яичника. Фрагменты этого гликопротеида также являются одним из хемоаттрактантов для макрофагов, мигрирующих в очаг воспаления [11]. Все вышеизложенное, а также наличие бактериальных биопленок, по-видимому, постоянно поддерживает источник воспаления.
Объемная плотность соединительной ткани в стенке ТОА составила, по нашим данным, 51,2 (3,7)%, а содержание мышечной ткани – 6,09 (0,05)%, что в 8,5 раза меньше аналогичного показателя в группе сравнения. Эти признаки являются одним из объективных доказательств потери функции маточной трубы и яичников при хронических гнойных воспалительных заболеваниях придатков матки. Толщина стенок мелких артерий достоверно увеличивалась за счет отложения в них ШИК-положительных веществ и разрастания соединительнотканных волокон, и составила 12,5 (4,3) мкм в основной группе против 6,6 (0,5) мкм в группе сравнения. При увеличении части тканевых структур, находящихся в связи с такими сосудами, и при утолщении их стенок сосуды были не в состоянии обеспечить нормальный тканевый обмен, что, по нашему мнению, является одним из механизмов поддержания перманентности течения воспалительного процесса.
Импрегнация нервных волокон маточных труб в группе сравнения выявила отдельные тонкие нервные волокна с небольшой извитостью. В основной группе отмечены неравномерная толщина, булавовидные утолщения, фрагментация и распад нервных волокон, что, вероятно, было причиной уменьшения болевого синдрома, более стертой клинической картины в ряде наблюдений. Вышеуказанное, возможно, приводило к поздней обращаемости за медицинской помощью и поздней диагностике.
Очевидно, что при естественном течении воспалительного процесса нормализация свойств поврежденных рецепторов, проводников, синапсов, нейронов является важным условием восстановления целости ткани. Повреждение периферической нервной системы, дефрагментация, распад нервных волокон сопровождались беспорядочным разрастанием соединительной ткани, что подтверждали наши морфологические исследования.
Полученные значения уровней цитокинов в очаге гнойного воспаления находятся в соответствии с гистологическими исследованиями. Кроме этого, исследование экссудата показало и выраженное изменение белкового обмена. Содержание общего белка и глобулиновой фракции в гнойном экссудате было практически таким же, как и в сыворотке крови, что свидетельствует о повышенной сосудистой проницаемости (таблица). Белки плазмы крови покидают сосуды в основном через расширенные межэндотелиальные клеточные щели в венулах. Снижение альбуминов при ТОА в экссудате подтверждает точку зрения, что он, как пластический материал, расходуется в большом количестве в зоне воспаления и участвует в образовании грануляционно-воспалительного вала. М.Ф. Мазурик (1984) предложил использовать прогностический коэффициент течения раневого процесса как отношение общего белка плазмы крови к белку раневого отделяемого. В норме он равен 1,2–1,3 и при ухудшении общего состояния снижается. При расчете собственных данных (отношение общего белка плазмы крови к белку экссудата) мы получили, что данный показатель у здоровых женщин в ПЖ был 2,45 (0,14), а при гнойном воспалении – 1,08 (0,07), то есть в 2,26 раза ниже.
Хотим отметить, что наряду с оперативным лечением всем пациенткам проводилась комплексная антибактериальная (карбапенемы, цефалоспорины, полусинтетические защищенные пенициллины и другие антибиотики), дезинтоксикационная, неспецифическая противовоспалительная терапия, а также физиотерапия в послеоперационном периоде. Все женщины выписаны домой в удовлетворительном состоянии.
Таким образом, данное исследование убедило нас в том, что хроническое воспаление – это воспаление, при котором процессы альтерации, экссудации и пролиферации протекают одновременно. Оно может развиться как вследствие острого воспаления, так и протекать бессимптомно, что приводит к поздней диагностике и лечению [12, 13]. На основании полученных нами результатов можно предположить, что в случаях ТОА местная воспалительная реакция как защитная – не совсем эффективна, так как извращаются взаимосвязи между повреждением, воспалением, регенерацией и фиброзом. Воздействие провоспалительных цитокинов ИЛ-1, ФНО-α приводит к активации фибробластов, гладких миоцитов и эндотелия очага воспаления, и их уровни в сыворотке крови и ПЖ представляют собой значимые критерии тяжести клинического течения заболевания. Проведенный анализ отражает глубину патологических деструктивных изменений в очаге воспаления, предложенные тесты позволяют заглянуть через «открытое окно в мезенхиму» [14].
Заключение
Цитокины играют важную роль в развитии воспаления, и диагностическое значение их определения возрастает при их исследовании непосредственно в очаге воспаления. Полученные нами данные свидетельствуют, что у пациенток с ТОА наблюдается усиление продукции провоспалительных цитокинов, наряду со снижением продукции противовоспалительных, что в конечном итоге приводит к развитию осложнений, потере функциональной полноценности придатков матки.
Активация клеток, усиление продукции провоспалительных цитокинов (ИЛ-1, ИЛ-6, ФНО-α и др.) являются необходимыми в начальных фазах воспаления, однако они становятся проблемными, если степень активации перестает быть адекватной, когда первоначально защитный механизм перерастает в патологический, что подтвердили наши морфологические исследования.
Исследование этих показателей дополнительно обосновывает возможность выбора патогенетической терапии, а именно – своевременного хирургического лечения, что, в свою очередь, приведет к нормализации межклеточных взаимоотношений иммунной системы.



