Заболевания, ассоциированные с вирусом папилломы человека (ВПЧ), являются глобальной медико-социальной проблемой, решение которой необходимо для усовершенствования диагностических и лечебно-профилактических подходов.
В Российской Федерации (РФ) официальная регистрация ВПЧ в виде манифестных проявлений – остроконечных кондилом (ОК) – в соответствии с приказом Минздрава РФ № 286 от 07.12.1993 г. начата с 1993 г. Систематизированный анализ показал, что общая годовая заболеваемость ОК в мире (включая новые случаи и рецидивирующие) варьирует от 160 до 289 случаев на 100 тыс., со средним значением 194,5 на 100 тыс. женского населения; средний ежегодный уровень заболеваемости новыми ОК составил 120,5 случая на 100 тыс. женщин. Пик заболеваемости приходится на 24 года [1, 2]. В РФ в 2014 г. аногенитальные бородавки диагностированы с частотой 21,8 на 100 тыс. населения, а в Москве – 33,6 на 100 тыс. [3]. За период 2004–2014 гг. в общей структуре инфекций, передающихся половым путем, в РФ заболеваемость ОК увеличилась с 6 до 11% [4].
Этиологическим фактором ОК чаще всего являются ВПЧ 6, 11 низкоонкогенных типов, но также могут быть ВПЧ среднего и высокого онкогенного риска – 16, 18, 30–33, 35, 39, 41–45, 51–56, 59 типов [5, 6].
Выделяют латентную, субклиническую и клиническую формы папилломавирусной инфекции (ПВИ). Латентная форма ПВИ не диагностируется ни кольпоскопически, ни цитологически. Диагноз ставят на основании выявления ДНК-вируса с помощью полимеразной цепной реакции (ПЦР), Hybrid Capture (гибридизации в растворе).
Субклиническая форма ПВИ не сопровождается клиническими симптомами, может диагностироваться при кольпоскопии и цитологическом исследовании [7].
Одной из клинических форм ПВИ слизистых оболочек и кожи являются ОК, причиной возникновения которых до 100% случаев являются низкоонкогенные ВПЧ 6, 11 типов [8, 9].
ОК представляют собой разрастания соединительной ткани с сосудами, покрытыми плоским эпителием с морфологическими признаками ПВИ, выступают над поверхностью кожи и слизистой, имеют ножку или широкое основание. ОК бывают множественными или единичными. Основание не спаяно с окружающими тканями, подвижно, мягкой или плотной консистенции, цвет на коже белесоватый или коричневый, на слизистых оболочках – от бледно-розового до красноватого. На поверхности возможны признаки ороговения. ОК могут сопровождаться воспалением, нарушением микроциркуляции, отеком [7, 10, 11] и характеризуются высокой частотой рецидивов, которые даже после «успешного» лечения могут достигать 30–40%. Локализуются в основном в местах возможной мацерации: малые половые губы, влагалище, шейка матки, устье уретры, перианальная область [10, 12].
Существуют 3 основных группы лабораторных методов определения ВПЧ: неамплификационные, амплификационные и сигнальные амплификационные. Неамплификационные методы диагностики в настоящее время используются крайне редко. Наиболее распространенным методом выявления ДНК ВПЧ и его типирования является ПЦР, обладающая высокой чувствительностью (позволяет определить от 10 до 100 геномов) [13–16].
ПЦР – качественный анализ содержания ДНК в биологических средах и субстратах. Качественная ПЦР применяется тогда, когда достаточно только выявить наличие фрагментов ДНК, а ПЦР в режиме реального времени – если необходимо получить информацию о вирусной нагрузке, адекватности назначенного лечения или его результативности, о риске обострения заболевания.
Преимуществом метода является то, что при ПЦР амплификации подвергается не вирус, а только ДНК, причем не вся молекула ДНК, а только ее определенный фрагмент, являющийся маркером данного возбудителя. То есть метод ПЦР обладает высочайшей чувствительностью, ведь для выявления ВПЧ достаточно иметь всего лишь фрагменты его ДНК. Поэтому становится возможным обнаружение возбудителей заболеваний даже в тех случаях, когда другими способами их выявление невозможно. Высокая специфичность позволяет определять уникальную последовательность нуклеотидов, характерную только для конкретного возбудителя.
Усовершенствованный метод ПЦР в режиме реального времени значительно повышает точность исследования, наибольшая ценность которого заключается в возможности количественных измерений в широком линейном диапазоне. В настоящее время в развитых странах широко используется метод определения ДНК вируса в материале − Digene-тест. Определение вирусной нагрузки также позволяет прогнозировать элиминацию ВПЧ [17–23].
Материалы и методы
Обследованы 90 пациенток с ОК вульвы, обратившихся в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России в период с 01.10.2013 по 01.09.2017.
Диагноз ОК установлен на основании клинико-визуального обследования, вульвоскопии с проведением пробы с уксусной кислотой, морфологического исследования биоптата ткани ОК, высокочастотного ультразвукового исследования (ВЧ УЗИ) кожи и слизистых вульвы. Всем пациенткам проведено комплексное обследование, включавшее сбор клинико-анамнестических данных в виде специально разработанной нами анкеты-опросника для выявления факторов риска заболеваемости ОК, гинекологический осмотр, ВЧ УЗИ кожи и слизистых оболочек наружных половых органов, расширенную кольпоскопию. ВЧ УЗИ кожи проводили на аппарате DUB – digital Ultraschall Bildsystem – tpm с программным обеспечением DUB-SkinScan, фоторегистрацией ОК. Оценку структуры кожи осуществляли контактным ультразвуковым способом. В исследовании использовали сканирующую головку прибора, генерирующую ультразвуковую волну с частотой до 75 МГц. Эта волна проникает в ткани на небольшую глубину (до 8 мм), что позволяет получить информацию о состоянии эпидермиса и дермы. У всех обследуемых женщин с ОК проводили забор соскобов из цервикального канала (ЦК), с поверхности ОК и биоптатов ткани ОК для ВПЧ-типирования с помощью ПЦР в реальном времени. Биопсию ткани ОК назначали при размерах ОК, позволяющих получить достаточный для гистологического исследования материал (≥3 мм), и осуществляли одномоментно с хирургической деструкцией (n=90). Биологический материал помещали в пробирки с физиологическим раствором. Осаждение клеток проводили путем центрифугирования при 13 000 G в течение 10 мин. Полученные клетки ресуспендировали в 100 мкл физиологического раствора. Для выделения ДНК использовали наборы «Проба ГС» («ДНК-Технология», Россия). Метод основан на использовании для лизиса клеток сильного хаотропного агента с последующей сорбцией нуклеиновых кислот на твердом носителе, последующими отмывками сорбента и элюцией ДНК-сорбента. Объем образцов после выделения составил 100 мкл. Амплификацию типоспецифических фрагментов ДНК ВПЧ и человеческой ДНК (контроль адекватности взятия биоматериала) проводили с помощью комплекта реагентов для выявления, типирования и количественного определения ВПЧ методом ПЦР HPV «Квант-21» («ДНК-Технология», Россия). Амплификацию осуществляли в режиме реального времени с помощью прибора «ДТ-964» («ДНК-Технология», Россия). Измерение уровня флуоресценции проводили на каждом цикле амплификации по каналам FAM, HEX, ROX и Cy5. Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам.
Статистическая обработка данных, построение графиков, анализ результатов выполнены на персональном компьютере с применением программ IBM SPSS версии 22 таблиц Microsoft Excel 2013. Все полученные количественные анамнестические, клинические, лабораторные и инструментальные данные обработаны общепринятыми статистическими методами. Количественные данные представлены в виде среднего арифметического и стандартного отклонения М (SD), качественные – в виде абсолютных (n) и относительных (%) величин. Ввиду нормального распределения количественных переменных в каждой из сравниваемых групп различия между переменными проверялись при помощи t-критерия Стьюдента для двух переменных и при помощи однофакторного дисперсионного анализа для 3 и более переменных. Взаимосвязь качественных признаков проверяли при помощи критерия Хи-квадрат и отношения шансов (ОШ). Результаты признавали статистически значимыми при уровне значимости p≤0,05.
Результаты
Средний возраст исследуемых пациенток составил 27,3 (2,2)* года. Представленные данные демонстрируют, что в исследуемых группах превалировали женщины репродуктивного возраста, которые имели регулярный менструальный цикл; средний возраст менархе составил 12,7 (1,2)* года, коитархе – 18 (1,5)* лет. Барьерную контрацепцию применяли 65,5% женщин.
Расширенную кольпоскопию/вульвоскопию проводили всем пациенткам (n=90). Так как интенсивность изменений эпителия коррелирует со степенью тяжести процесса, выделяют слабовыраженные (нежный ацетобелый эпителий (АБЭ), нежная мозаика или пунктация), выраженные (грубый АБЭ, грубая пунктация, наличие атипических сосудов) изменения. Слабовыраженные изменения были зарегистрированы у 10 (11%) пациенток, выраженные – только у 3 (3,3%). Наряду с расширенной кольпоскопией пациенткам проводили вульвоскопию и пробу с 3% раствором уксусной кислоты. Диагноз ОК при вульвоскопии подтвердился у 90 (100%) пациенток, у 61 (68%) из них было выявлено сочетанное поражение влагалища и вульвы, у 5 (5,5%) – кондиломы на шейке матки.
У всех пациенток (n=90) проводили забор биоматериала из 3 локализаций: мазков из ЦК, соскобов с поверхности ОК и биоптатов ткани ОК для ВПЧ-типирования с помощью ПЦР в режиме реального времени с определением вирусной нагрузки.
Сравнивали частоту выявления типов ВПЧ и вирусную нагрузку между эпителием ЦК, соскобом с поверхности ОК и биоптатом ткани ОК. Проанализированы различия в частоте выявления ВПЧ в данных локализациях, различия в их вирусной нагрузке, а также зависимость величины вирусной нагрузки от локализации ОК (на коже или слизистой наружных половых органов).
По результатам исследования (рис. 1) ВПЧ 6 типа является наиболее часто встречающимся типом во всех локализациях у пациенток с ОК. При анализе частоты выявления типов ВПЧ в биоптатах 6 тип обнаружен у 81 (73,3%) пациентки, 39 и 44 типы – у 12 (13,3%), 18, 58 типы – у 9 (10%). ВПЧ 11, 31, 33, 51, 56, 59 типов в биоптатах обнаружены лишь в 3,3% случаев.
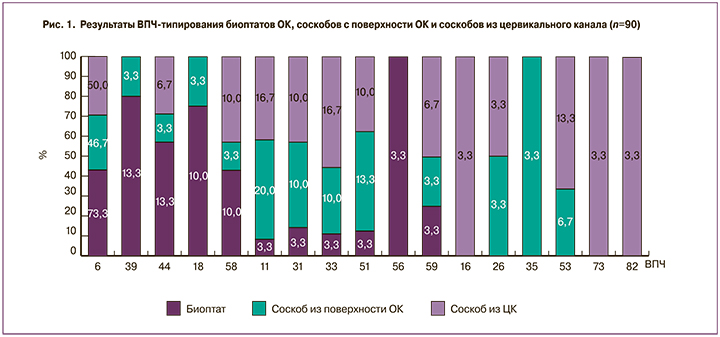
В соскобах с поверхности ОК ВПЧ 6 типа выявлен у 42 (46,7%) женщин, 11 типа – у 18 (20%), 51 типа – у 12 (13,3%), 53 типа – у 6 (6,7%) женщин. Остальные типы ВПЧ в соскобах с поверхности ОК встречались в 3,3% случаев.
В ЦК выявлено следующее распределение типов: ВПЧ 6 типа обнаружен у 45 (50%) женщин, 11 и 33 типов – у 15 (16,7%), 53 типа – у 12 (13,3%), 31, 51 и 58 типов – у 9 (10%), остальные типы встречались менее чем в 10% случаев: 44, 59 типы – у 6 (6,7%), 16, 26, 73, 82 типы – у 3 (3,3%). При этом высокоонкогенные типы ВПЧ 16, 73, 82 типов встречались исключительно в ЦК, не было ни одного случая выявления этих типов вируса в биоптатах и соскобах с поверхности ОК.
Следует отметить, что у 36% пациенток выявили 2 и более различных типов ВПЧ. При анализе частоты выявления типов ВПЧ в положительных образцах эпителиев из разных локализаций выяснилось, что в биоптатах ОК ВПЧ 6 типа встречается в 1,5 раза чаще, чем в ЦК (отношение шансов (ОШ) = 12,3; 95% доверительный интервал (ДИ) 1,3–118; р=0,04) и в 1,6 раза чаще, чем в соскобах с поверхности ОК. ВПЧ 11 типа в соскобах с поверхности ОК встречался в 1,2 раза чаще, чем в ЦК (ОШ=46; 95% ДИ 3,3–634; р=0,002)**, и в 6 раз чаще, чем в биоптатах (ОШ=8,3; 95% ДИ 1,4–47,6; р=0,04)**, ВПЧ 44 типа встречался в биоптатах ОК в 2 раза чаще, чем в ЦК, и в 4 раза чаще, чем в соскобах с поверхности ОК. В биоптатах ОК также были выявлены высокоонкогенные ВПЧ 18, 31, 33, 39, 51, 56, 58, 59 типов, при этом чаще вирусная нагрузка была статистически значимо выше в образцах эпителия ЦК (р<0,05) (рис. 2).
У пациенток с высокоонкогенными типами ВПЧ при кольпоскопии выявлены изменения эпителия различной выраженности.
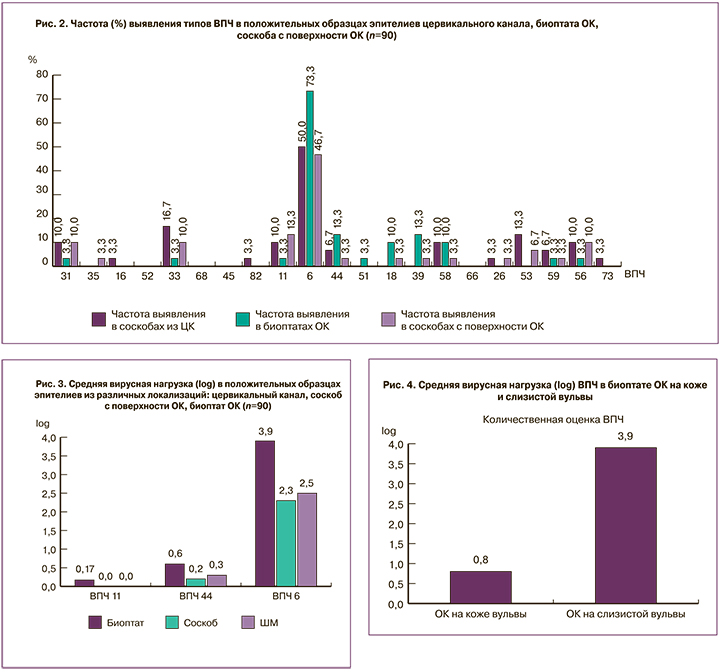
При анализе вирусной нагрузки между образцами эпителиев из 3 локализаций в отношении наиболее часто выявляемого ВПЧ 6 типа выяснилось, что вирусная нагрузка в биоптате ОК оказывалась статистически значимо выше, чем в соскобах с поверхности ОК и в эпителии ЦК (рис. 3).
Средняя вирусная нагрузка составила: в биоптатах ОК – 3,9 (3,3–6,0)**lоg копий вируса в образце, в соскобах с поверхности ОК – 2,33 (1,9–4,3)**lоg копий вируса в образце, в эпителии из ЦК – 2,57 (2–4,7)**lоg копий вируса в образце.
Значение вирусной нагрузки в соскобах с поверхности ОК, локализованных на слизистой вульвы, оказалось статистически значимо выше по сравнению с ОК, локализованными на коже вульвы (р=0,02) (рис. 4).
Обсуждение результатов
Целью данного исследования было изучение распространенности различных типов ВПЧ в трех локализациях: эпителии ЦК, соскобах с поверхности ОК, биоптатах ткани ОК в сравнительном аспекте, различий в частоте выявления ВПЧ в данных локализациях, различий в их вирусной нагрузке, а также зависимость величины вирусной нагрузки от локализации ОК (на коже или слизистой наружных половых органов).
У каждой пациентки (n=90) мы проводили забор биоматериалов из трех локализаций: соскобов из ЦК, соскобов с поверхности ОК и биоптатов ткани ОК для ВПЧ-типирования с помощью ПЦР в реальном времени. Исследование урогенитальных соскобов для определения ДНК ВПЧ является менее инвазивным методом, чем биопсия, но зачастую оно менее информативно при ОК. G.M. Anic, J.L. Messinaи соавт. [24] проанализировали корреляцию различных типов ВПЧ в урогенитальных мазках и биоптатах из патологических участков, выявили высокий уровень корреляции ВПЧ 16, 18 типов в мазках и биоптатах у пациентов с интраэпителиальными неоплазиями полового члена, слабую корреляцию ВПЧ 6 и 11 типов в мазках и биоптатах у пациентов с ОК. Сравнивались выявляемость ВПЧ и вирусная нагрузка между эпителием ЦК, соскобом с поверхности ОК и биоптатом ткани ОК. Нами были проанализированы различия в выявляемости ВПЧ в данных локализациях, различия в их вирусной нагрузке, а также зависимость величины вирусной нагрузки от локализации ОК (на коже или слизистой наружных половых органов). В ходе исследования установлено, что наиболее часто встречающимся типом ВПЧ среди женщин с ОК является ВПЧ 6 типа. Полученные нами данные совпадают с представленными ранее многочисленными данными, согласно которым наиболее частым этиологическим фактором ОК являются низкоонкогенные типы ВПЧ [6, 8, 9, 25–28]. В нашем исследовании у 36% женщин выявлено 2 и более типов ВПЧ. По данным A. Pista, A. Oliveira и соавт. [29] в популяции женщин Южной Европы при цервикальных интраэпителиальных неоплазиях 2 и более типов ВПЧ встречаются в 35,3% случаев. В исследовании M.G. Hawkins., D.M. Winder .и соавт. [30] при ОК наружных половых органов множественные типы ВПЧ были выявлены в 33,3% случаев. Мы также предполагаем, что в популяции российских женщин ВПЧ двух и более типов встречаются чаще.
В биоптатах ОК ВПЧ 6, 44 типов выявлены статистически значимо чаще, чем на шейке матки и в соскобах с поверхности ОК. В биоптатах ОК также встречались высокоонкогенные типы ВПЧ 18, 31, 33, 39, 51, 56, 58, 59 типов, при этом вирусная нагрузка чаще была статистически значимо выше в образцах эпителия ЦК (р<0,05), что подтверждают данные G.M. Anic, J.L. Messina [24] о высокой корреляции высокоонкогенных типов ВПЧ в урогенитальных мазках и биоптатах от пациентов с ОК по сравнению с низкоонкогенными типами ВПЧ. Выявление высокоонкогенных типов ВПЧ описано в исследовании R. Yaghoobi, M. Makvandiи соавт. [31], в ходе которого у 58,7% пациентов с ОК был выявлен ВПЧ 16 типа, в то время как низкоонкогенные ВПЧ 6 и 11 типов были выявлены с частотой 15 и 21% соответственно. P.S. Bhageerathy, M. Cecilia описали клинический случай с выявлением ВПЧ 16 типа в гигантской ОК вульвы [32]. В нашем исследовании высокоонкогенные типы ВПЧ 31, 51, 58 типов выявлены у 10% женщин с ОК.
Заключение
Наиболее часто встречающимся типом ВПЧ среди женщин с ОК во всех локализациях является ВПЧ 6 типа, обнаруженный в 73% обследованных биоптатов ОК, у 36% женщин выявлено 2 и более типов ВПЧ. В биоптатах ОК ВПЧ 6, 44 типов выявлены достоверно чаще, чем в эпителии ЦК и в соскобах с поверхности ОК. В биоптатах ОК также встречались высокоонкогенные типы ВПЧ 18, 31, 33, 39, 51, 56, 58, 59 типов, при этом чаще вирусная нагрузка была статистически значимо выше в образцах эпителия из ЦК (р<0,05).
Средняя вирусная нагрузка ВПЧ в биоптате ОК оказалась статистически значимо выше таковой в эпителии ЦК и соскобов с поверхности ОК. Вирусная нагрузка в соскобах с поверхности ОК оказалась статистически значимо выше в случаях ОК, локализованных на слизистой вульвы, по сравнению с ОК, расположенными на коже наружных половых органов. Из перечисленного выше следует вывод о высокой контагиозности ОК, локализованных на слизистой вульвы. Таким образом, при ОК вульвы зачастую ВПЧ может отсутствовать в эпителии ЦК, при этом сами эти поражения даже при незначительных размерах являются резервуаром ПВИ и способствуют заражению половых партнеров. ОК на слизистой вульвы даже при малых размерах содержат значительно больше копий клеток ВПЧ и обладают более выраженным вирусным потенциалом по сравнению с ОК, локализованными на коже, поэтому, безусловно, они нуждаются в своевременном и эффективном лечении.



