Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011.
Актуальность проблемы оппортунистических вульвовагинальных инфекций (ОВИ) определяется наиболее высокой их распространенностью среди всех генитальных воспалительных заболеваний [1–3]. Многочисленные исследования свидетельствуют о неблагоприятном влиянии вагинальных инфекций на течение и исход беременности, что проявляется высокой частотой преждевременного прерывания беременности на любых сроках, развитием хориоамнионитов и инфекции околоплодных вод, послеродовых гнойно-воспалительных осложнений [4–7]. Дискутабельным остается вопрос о роли иммунной системы при вагинальных инфекциях. По данным ряда исследований, при вагинальных инфекциях происходят изменения в различных звеньях иммунной системы [8], однако расширенного изучения состояния системного и локального иммунитета при вагинальных инфекциях не проведено. В последние десятилетия был открыт новый класс регуляторных молекул, участвующих в передаче сигнала клеткам иммунной защиты и получивших название «антимикробные пептиды» или «дефензины» [9].
Дефензины представляют собой различные группы белков, объединенные на основании их антимикробной активности. В последние годы появились работы о выявлении в эпителии влагалища и цервикального канала дефензинов α и β, обеспечивающих защиту локуса от вагинальных инфекций и действующих как эндогенные антибиотики [9, 10]. Но данные о дефензинах крайне ограничены и требуют углубленного изучения с точки зрения диагностической ценности и роли в механизмах развития вагинальной инфекции и дисбиоза [11].
Цель исследования: изучение взаимосвязи ОВИ с изменением показателей врожденного иммунитета на системном и локальном уровне.
Материалы и методы
В исследование были включены 115 беременных, составивших 2 группы: в 1-ю группу (основная) вошло 59 пациенток с ОВИ, во 2-ю группу (контроль) – 56 пациенток без ОВИ. У всех пациенток было взято информированное согласие на проведения исследования.
В ходе работы были использованы общеклинические (клинико-анамнестические, лабораторные), специальные (ультразвуковое исследование (УЗИ), допплерометрия, кардиотокография (КТГ)), молекулярно-генетические и статистические методы исследования.
 Степень выраженности бактериального вагиноза оценивали по сумме баллов с использованием совокупности клинических симптомов: зуд, жжение, характер и количество выделений, боли при мочеиспускании, диспареуния, дерматит перианальной зоны, отечность, гиперемия и эрозивные поражения стенок влагалища. Каждый симптом оценивали по трехбалльной шкале от 0 до 2.
Степень выраженности бактериального вагиноза оценивали по сумме баллов с использованием совокупности клинических симптомов: зуд, жжение, характер и количество выделений, боли при мочеиспускании, диспареуния, дерматит перианальной зоны, отечность, гиперемия и эрозивные поражения стенок влагалища. Каждый симптом оценивали по трехбалльной шкале от 0 до 2.
Отсутствие симптомов оценивалось в 0 баллов, умеренная выраженность – 1, яркие симптомы заболевания – 2 балла.
Состояние врожденного иммунитета на локальном уровне оценивали по содержанию цитокинов цервикальной слизи и профилю экспрессии генов цитокинов в клетках влагалища, а также по антимикробной активности вагинального отделяемого. На системном уровне для оценки состояния иммунной системы изучали ее гуморальное и клеточное звенья в периферической крови.
Содержание цитокинов в цервикальной слизи и эпителиальных клетках цервикального канала у беременных определяли методом твердофазного иммуноферментного анализа c помощью наборов фирмы «ICN Pharmaceuticals».
Забор материала из цервикального канала проводили специальным стерильным зондом после удаления с шейки матки вагинальных белей. Зонд вводили в канал на глубину не менее 1 см, производя его ротацию в обе стороны с целью взятия слизи и клеточного материала. Затем зонд погружали в буферный раствор с ингибиторами протеаз. Материал немедленно доставлялся в лабораторию для последующего центрифугирования, фильтрации и замораживания.
Исследование локального профиля экспрессии мРНК генов цитокинов проводили методом количественной полимеразной цепной реакции в режиме реального времени с предварительной стадией обратной транскрипции (ОТ-ПЦР), с использованием коммерческих наборов («ДНК-Технология», Россия) согласно инструкции. Для выделения нуклеиновых кислот использовали наборы «Проба ГС» («ДНК-Технология», Россия). Амплификацию проводили на детектирующим амплификаторе ДТ-96 («ДНК-Технология», Россия). Для количественной оценки уровня экспрессии мРНК генов использован метод сравнения индикаторных циклов (метод Δ∆Cq) с нормировкой по пяти референсным генам HPRT1, TBP, B2M, GUSB, ABL. При сравнении групп для каждого гена за 1 было принято значение медианы (Ме) в контрольной группе, что позволило оценить, во сколько раз изменяется экспрессия при бактериальном вагинозе. Определяли мРНК интерлейкина (IL) 1β, фактора некроза опухоли (TNF) α, IL-6, IL-8, IL-18, IL-12α/p35, IL-10, интерферона (IFN) γ, трансформирующего фактора роста (TGF) β1, лейкемия-ингибирующего фактора (LIF), а также общего лейкоцитарного антигена CD45.
Для определения антимикробной активности вагинального отделяемого во влагалище вводили на 10 минут тампон «O.B. Pro comfort», после чего его переносили в пластиковую колонку 15х75 мм и элюировали 7 мл дистиллированной воды с помощью колбы Бунзена, подключенной к вакуумному насосу. Элюат фильтровали через бактериальный мембранный фильтр «Millipore» с диаметром пор 0,22 мкм. Фильтрат лиофильно высушивали и разводили стерильной дистиллированной водой так, чтобы получить 10-кратный концентрат по отношению к исходному фильтрату.
Противомикробную активность определяли следующим образом: клетки 3-суточной тест-культуры Escherichia coli (коллекция ГУ НИИВС им. И.И. Мечникова) инкубировали при температуре 32оС и соотношении 40 мкл вагинального отделяемого на 10 мкл бактериальной суспензии 104 КОЕ/мл. Из данной смеси сразу после смешивания и инкубации в течение 2 часов производили посевы. Результат выражали процентом клеток, убитых в процессе инкубации.
Для оценки клеточного звена иммунитета после соответствующей обработки и центрифугирования крови получали клеточную суспензию, которую инкубировали с флюоресцентно мечеными моноклональными антителами к CD3, CD4, CD8, CD16 и CD19 дифференцировочным антигенам (фирма «Becton Dickinson», США). Для контроля неспецифического связывания иммуноглобулинов использовали нативный мышиный IgG соответствующего изотипа. Фенотипический анализ клеточных популяций лимфоцитов проводили с помощью метода проточной цитометрии на цитофлуориметре «FACScan» фирмы «Becton Dickinson».
Для оценки гуморального звена иммунитета в сыворотке крови исследованы основные классы иммуноглобулинов G, A, M методом радиальной иммунодиффузии по Манчини.
Статистическая обработка полученных результатов была проведена на персональном компьютере при помощи программного пакета SPSS Statistics 17.0 for Windows. Для сравнения средних величин использовались следующие непараметрические тесты: тест Уайта для малых выборок; U-тест по методу Манна–Уитни при сравнении 2 независимых выборок; для определения связи (корреляции) между переменными рассчитывался ранговый коэффициент корреляции по Спирману.
Результаты исследования и их обсуждение
Все пациентки, включенные в исследование, были сопоставимы по возрасту и соматическому здоровью. Возраст беременных, включенных в исследование, колебался от 18 до 41 года и составил в среднем 31,4±0,5 и 28,4±0,5 года соответственно по группам.
У пациенток первой группы имело место достоверное увеличение частоты хронических заболеваний ЛОР-органов – 40,0% (р<0,05) и заболеваний мочевыделительной системы (хронический пиелонефрит – 20,0%, р<0,05, хронический цистит 26,0%, р<0,05).
При изучении структуры гинекологической заболеваемости было отмечено достоверное увеличение в I группе хронического эндометрита (18,0%), хронического сальпингоофорита (20,0%), доброкачественных новообразований яичников (12%), бесплодия (16%) и цервицита (54%) (p<0,05).
Течение беременности у пациенток основной группы достоверно чаще осложнялось плацентарной недостаточностью (4,8 и 0,9%), маловодием по данным УЗИ (9,6 и 4,6%) и хронической гипоксией плода по данным КТГ (9,4 и 1,9%). Также отмечалась высокая частота угрозы прерывания на всех этапах беременности, показатели которой были в 2 раза выше, чем в контроле. Послеродовый период достоверно чаще осложнялся эндометритом (2,2% и 0,3% соответственно).
Особый интерес представляли результаты исхода беременности относительно состояния здоровья новорожденных. Всего родилось 115 детей. Здоровыми родились в основной и контрольной группе соответственно 45,4 и 55,5% детей. Среднее количество заболеваний, приходящихся на 1 больного ребенка, составляло 1,8 в основной и 1,9 в контрольной группе.
Анализ частоты неонатальных заболеваний, в том числе внутриутробной инфекции (ВУИ), не выявил достоверных различий в сравниваемых группах, хотя у новорожденных, матери которых имели вагинальную инфекцию, отмечалась тенденция к увеличению частоты ВУИ, составляющей 10,9 против 6,9% в контрольной группе. В структуре ВУИ превалировала пневмония. Таким образом, клинический анализ течения и исхода беременности у пациенток с генитальной оппортунистической инфекцией и нормальным микроценозом влагалища не выявил достоверного различия между частотой акушерских факторов и заболеваний, осложняющих гестационный процесс, за исключением угрозы прерывания беременности в ранние сроки.
При определении субпопуляционного состава лимфоцитов в периферической крови была отмечена тенденция к снижению уровня CD8+Т-лимфоцитов (цитотоксических) у беременных основной группы, а также более высокий показатель соотношения CD4+/CD8+, что может свидетельствовать о некотором подавлении активности супрессорного звена Т-лимфоцитов.
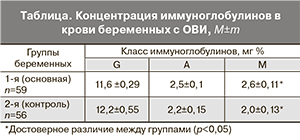
В развитии иммунного ответа непосредственную роль играет и гуморальный иммунитет, поэтому у тех же пациенток был исследован уровень основных классов иммуноглобулинов G, A, M (таблица). Показано статистически значимое повышение уровня IgM в сыворотке беременных с ОВИ по сравнению с группой контроля.
 С целью оценки состояния местного иммунитета был исследован уровень содержания цитокинов в цервикальной слизи и клетках цервикального канала у беременных с бактериальным вагинозом. Уровень цитокинов определялся до лечения в I триместре беременности и затем повторялся в 22–23 и 33–34 недели после лечения одновременно с пациентками группы сравнения. Местный иммунитет до лечения беременных основной группы характеризовался достоверным повышением в 2,7 раза уровня про- и противовоспалительных цитокинов по отношению к их продукции у беременных группы контроля. Наиболее активно среди провоспалительных цитокинов у беременных основной группы возрастала концентрация IL-6 (>3173.3 нг/г), уровень которого превышал верхнюю границу 95% доверительного интервала контрольной группы почти у половины беременных (46,9±8,8% наблюдений) и был достоверно выше остальных провоспалительных цитокинов. Корреляционный анализ выявил тесную отрицательную корреляционную взаимосвязь между уровнем противовоспалительного цитокина IL-10 и провоспалительного цитокина IL-6.
С целью оценки состояния местного иммунитета был исследован уровень содержания цитокинов в цервикальной слизи и клетках цервикального канала у беременных с бактериальным вагинозом. Уровень цитокинов определялся до лечения в I триместре беременности и затем повторялся в 22–23 и 33–34 недели после лечения одновременно с пациентками группы сравнения. Местный иммунитет до лечения беременных основной группы характеризовался достоверным повышением в 2,7 раза уровня про- и противовоспалительных цитокинов по отношению к их продукции у беременных группы контроля. Наиболее активно среди провоспалительных цитокинов у беременных основной группы возрастала концентрация IL-6 (>3173.3 нг/г), уровень которого превышал верхнюю границу 95% доверительного интервала контрольной группы почти у половины беременных (46,9±8,8% наблюдений) и был достоверно выше остальных провоспалительных цитокинов. Корреляционный анализ выявил тесную отрицательную корреляционную взаимосвязь между уровнем противовоспалительного цитокина IL-10 и провоспалительного цитокина IL-6.
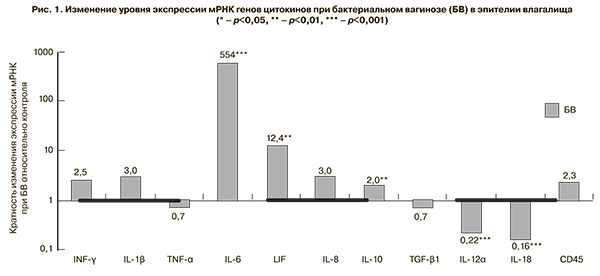
Учитывая, что цитокины являются короткоживущими молекулами, выброс которых обеспечивается активным синтезом, уровень мРНК соответствующего гена пропорционален количеству активного белка. Это позволяет использовать определение уровня мРНК для опосредованной оценки локального цитокинового профиля [12]. Так как определение цитокинов в отделяемом влагалища является достаточно трудоемким и нетехнологичным методом, перспективным представляется использование молекулярно-генетических методов для решения этой задачи. Было проведено исследование профиля экспрессии мРНК ряда генов цитокинов. Отмечено статистически значимое повышение уровня как провоспалительных (IL-6, LIF, IL-8), так и противовоспалительного цитокина IL-10 (рис. 1).
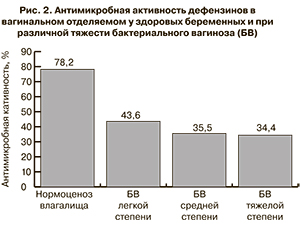
Антимикробная активность вагинального отделяемого у беременных с бактериальным вагинозом была существенно ниже, чем в контрольной группе (рис. 2). При этом статистически значимой зависимости от тяжести течения заболевания выявлено не было.
Таким образом, на основании проведенного исследования установлено изменение показателей врожденного иммунитета у пациенток с дисбиотическими нарушениями влагалищной микрофлоры. Одним из механизмов, приводящих к изменению влагалищного биоценоза, может быть нарушение локального иммунитета, выражающееся в снижении активности дефензинов и дисбалансе цитокиновой регуляции. Снижение локальной иммунологической защиты приводит к бесконтрольному размножению факультативной микрофлоры и замещению облигатной микрофлоры влагалища. Недооценка роли нарушений локального иммунитета в патогенезе вагинальных инфекций в ряде случаев может объяснять неэффективность проводимой антибактериальной терапии и высокую частоту рецидивирования.