Количество здоровых носителей Staphylococcus aureus в верхних дыхательных путях в общей популяции взрослого населения по разным данным составляет от 12 до 50%, среди персонала медицинских организаций достигает 35% [1, 2], что приводит к увеличению вероятности инфицирования пациентов.
Приказ Министерства здравоохранения РФ №302н от 12 апреля 2011 года «Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры (обследования)» регламентирует обследование на носительство золотистого стафилококка медицинского персонала при поступлении на работу и в дальнейшем 1 раз в 6 месяцев [3]. Однако в данном документе отсутствуют мероприятия, которые необходимо применять после выявления золотистого стафилококка у медицинских работников, и нет рекомендаций по способам санации носителей. Необходимость санации определяется врачом-эпидемиологом медицинской организации в соответствии с существующей эпидемиологической ситуацией. Принудительная санация недопустима и может быть расценена как нарушение конституционных прав человека, поскольку S. aureus является представителем нормальной микрофлоры носоглотки. При этом препараты для санации должны быть не только высокоэффективными, но и безопасными.
Учитывая нарастающую антибиотикорезистентность бактериальных патогенов темпы создания новых антибактериальных препаратов с годами стали уменьшаться. В последние годы исследователи всего мира обращают внимание на разработку альтернативных способов лечения и профилактики инфекций, и одним из перспективных направлений является использование препаратов бактериофагов [4].
Механизм действия бактериофагов связан с диффузией фаговых вирионов в макроорганизм, последующим контактом фага с бактериальными клетками и специфической адсорбцией фагов на ней. После возникновения устойчивой связи между рецепторным участком бактериальной клетки и вирионом адсорбция фага становится необратимой. Фаговая ДНК или РНК поступает в цитоплазму бактериальной клетки, вызывал блокирование синтеза ее белков. После репликации и сборки зрелых вирионов наступает лизис клеточной стенки с выходом новых фаговых вирионов во внешнюю среду. Строгая специфичность бактериофагов и их накопление в месте локализации воспалительного процесса – важная особенность фаготерапии, выгодно отличающая ее от этиотропных химиотерапевтических средств, обладающих широкой антимикробной активностью, отрицательной стороной которых является воздействие на нормальную микрофлору организма хозяина и быстрая утрата эффективности из-за развития резистентности возбудителей [5–7].
Ко многим видам бактерий выделено большое количество вирулентных фагов. Они обладают высокой эффективностью in vitro в отношении чувствительных к ним культур бактерий, лизируя их в течение часа. Для реализации лечебного эффекта в организме животных или человека фаг должен достигнуть очага инфекции в количестве, достаточном для размножения [5–7].
В современной клинической практике фаготерапию чаще всего применяют при лечении локальных воспалительных процессов и инфекций желудочно-кишечного тракта [5]. Фаготерапия показывает хорошие результаты при инфекциях, вызванных S. aureus [5, 8].
Можно полагать, что рациональное профилактическое применение бактериофагов в стационаре поможет значительно снизить антибиотический пресс и замедлить процесс формирования полирезистентных штаммов микроорганизмов, а также снизить частоту нежелательных реакций, возникающих при лечении антибиотиками. Свести к минимуму развитие резистентности бактерий к фагам возможно посредством комбинирования нескольких бактериофагов, направленных против конкретного патогена [5, 7]. Вероятно, использование смеси (коктейлей) анти-S. aureus бактериофагов позволяет пролонгировать их клинический эффект, как показано в работе A. Drilling и соавт. у больных с синуситами [8].
В большинстве родовспомогательных учреждений нашей страны S. aureus остается основной причиной вспышек инфекций, связанных с оказанием медицинской помощи (ИСМП). В нашем исследовании были использованы бактериофаги для санации носителей S. aureus среди персонала родильного блока и неонатальных отделений.
Цель исследования – оценить эффективность и безопасность геля с бактериофагами при санации носоглотки у носителей S. aureus, работающих в родильном блоке и неонатальных отделениях.
Материал и методы исследования
Работу проводили в период с августа 2014 года по январь 2015 года на базе отдела микробиологии и клинической фармакологии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России (далее – Центр).
В исследование включено 55 сотрудников неонатальных отделений и родильного блока Центра с бактериологически подтвержденным носительством S. aureus в носоглотке и давших согласие на участие в исследовании.
Для санации использовали гель отофаг (НПЦ «МикроМир», Россия), содержащий комплекс из 32 видов бактериофагов, подавляющих рост 12 видов условно-патогенных микроорганизмов, из них 8 видов бактриофагов, специфичных для S. aureus.
Санацию носителей осуществляли по следующей схеме: сотрудники самостоятельно вводили шприцем интраназально 1 мл геля отофаг 2 раза в день (утром и вечером) в течение 7 дней.
Побочные явления оценивали по субъективным ощущениям медицинских работников, принимающих участие в исследовании.
Микробиологическое исследование мазков со слизистой носа проводили трижды: первое – до санации гелем с бактериофагами отофаг, второе – через 1–2 недели после окончания курса санации, третье – через 1–2 месяца после окончания курса санации.
Взятие мазков из носа осуществляли стерильными ватными тампонами, которые помещали в пробирки с транспортной угольной средой Эймса (Copan, Италия).
 Посев биологического материала проводили на маннит-солевой агар с добавлением желточной эмульсии (HiMedia, Индия). Видовую идентификацию выделенных микроорганизмов выполняли методом MALDI-TOF-MS анализа на масс-спектрометре AutoflexIII (Bruker Daltonics, Германия). Контроль качества чувствительности к исследуемому фагу осуществляли с применением контрольного штамма Microtrol (Becton Dickinson, США) американской коллекции типовых культур (American type culture collection – АТСС) (Манасас, Вирджиния, США) – S.aureus ATCC 25923, образующего чистые зоны лизиса при нанесении исследуемого препарата.
Посев биологического материала проводили на маннит-солевой агар с добавлением желточной эмульсии (HiMedia, Индия). Видовую идентификацию выделенных микроорганизмов выполняли методом MALDI-TOF-MS анализа на масс-спектрометре AutoflexIII (Bruker Daltonics, Германия). Контроль качества чувствительности к исследуемому фагу осуществляли с применением контрольного штамма Microtrol (Becton Dickinson, США) американской коллекции типовых культур (American type culture collection – АТСС) (Манасас, Вирджиния, США) – S.aureus ATCC 25923, образующего чистые зоны лизиса при нанесении исследуемого препарата.
Чувствительность к антибиотикам выделенных изолятов S. aureus определяли диско-диффузионным методом на агаре Мюллера–Хинтон (HiMedia, Индия). Интерпретацию результатов проводили в соответствии с рекомендациями CLSI 2014 года [9].
Выделенные изоляты S. aureus тестировали на наличие метициллин-резистентности (определение чувствительности к цефокситину) и пенициллиназы (с помощью диска с нитроцефином). Использовали стандартные диски цефокситин 30 мкг (BioRad, Франция).
Чувствительность к исследуемому препарату бактериофага определяли на агаре Мюллера-Хинтон по следующей схеме:
- на агар тампоном наносили микробную взвесь мутностью 0,5 МакФарланда (приготовление инокулята осуществляли в соответствии с МУК 4.12.1890-04);
- на поверхность агара помещали одну каплю геля с бактериофагами отофаг;
- инкубировали 18–24 часа в аэробных условиях при температуре 36°С.
Оценивали зоны лизиса в области капли геля через 18–24 часа инкубации. Оценку литической активности фага проводили по методике, описанной в федеральных клинических рекомендациях [4].
«-» отсутствие литической активности;
«+» низкая активность;
«++» образование зоны лизиса с большим количеством колоний вторичного роста бактерий;
«+++» зона лизиса с единичными колониями вторичного роста бактерий;
«++++» прозрачная зона лизиса без колоний вторичного роста бактерий.
Чувствительными (S) считали изоляты с результатами «++++», умеренно-чувствительными (I) – изоляты «+++» и «++», устойчивыми (R) – «+» и «-».
Статистические методы. Полученные данные статистически обрабатывали с помощью программы MS Excel. Оценка статистической значимости различной эффективности применения геля с бактериофагами в группах сотрудников, колонизированных чувствительными и умеренно-чувствительными штаммами S. aureus проводили с расчетом показателя хи-квадрат. Статистически достоверным считали данные с P<0,05.
Результаты исследования
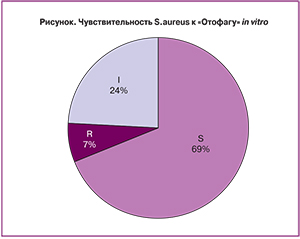
При первичном микробиологическом исследовании мазков из носа выделено 55 метициллин-чувствительных изолятов S. aureus (MSSA). Изоляты, вырабатывающие пенициллиназу, обнаружены у 35 (70%) носителей. При постановке теста на чувствительность к исследуемому препарату in vitro 69% (38 изолятов) оказались чувствительными к фагу, 23,7% (13 изолятов) – умеренно-чувствительными и 7,3% (4 изолята) – резистентными (рисунок). Из исследования были исключены четыре сотрудника, у которых выделены изоляты S. aureus, устойчивые к отофагу.
Первое контрольное обследование сотрудников проводили через 1–2 недели после окончания курса санации фагом. У 48 сотрудников из 51 (94%) наблюдалась элиминация S. aureus из носоглотки.
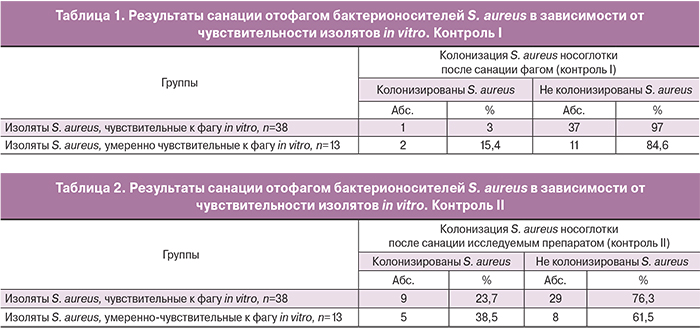
В табл. 1 представлена клиническая эффективность санации в сопоставлении с результатами тестирования чувствительности к фагам изолятов S. aureus, выделенных у носителей. В группе сотрудников, колонизированных чувствительным к препарату S. aureus, у 37 из 38 человек (97%) роста золотистого стафилококка не выявлено, у одного сотрудника (3%) санация не достигнута.
В группе сотрудников, у которых S. aureus был умеренно устойчив к исследуемому препарату, у 11 из 13 (84,6%) не обнаружено роста золотистого стафилококка, а у двух (15,4%) повторно обнаружен S. aureus.
Достоверных различий эффективности применения препарата бактериофагов в группах участников, колонизированных чувствительными и умеренно чувствительными к исследуемому препарату вариантами S. aureus не получено (χ2=1,0, p>0,05).
При повторном контроле (контроль 2), через 1–2 месяца после санации у 38 сотрудников из 51 (74,5%) S. aureus не обнаружены, а у 13 (25,5) вновь выделен S. aureus.
В группе сотрудников, колонизированных чувствительными к исследуемому препарату изолятами S. aureus, у 29 (76,3%) из 38 человек роста золотистого стафилококка не выявлено, но у 9 (23,7%) вновь обнаружено носительство S. aureus. В группе сотрудников, у которых стафилококки были умеренно устойчивы к исследуемому препарату, у 8 из 13 (61,5%) не обнаружено золотистого стафилококка, тогда как у 5 (38,5%) S. aureus обнаружен повторно (табл. 2).
Достоверных различий эффективности применения препарата бактериофагов в группах участников, колонизированных чувствительными и умеренно чувствительными к исследуемому препарату вариантами S. aureus не получено (χ2=0,02 p>0,05).
Побочных явлений при использовании геля с бактериофагами не отмечено. Многие участники исследования отмечали приятную текстуру геля и удобство применения препарата.
Обсуждение
Распространенность S. aureus в медицинских организациях среди пациентов и персонала, а также в воздухе и предметах внутрибольничной среды в значительной мере определяет вероятность и частоту развития случаев инфекций, вызванных S.aureus у пациентов, в первую очередь, у новорожденных. В медицинских организациях родовспоможения S. aureus продолжает оставаться основным возбудителем конъюнктивита, омфалита, гнойничковых поражений кожи и сепсиса у новорожденных.
Носительство золотистого стафилококка в популяции медицинских работников – явление нередкое, при этом особую клиническую значимость оно приобретает в стационарах, с иммунокомпромиссным контингентом больных: новорожденные, пациенты отделений реанимации и интенсивной терапии.
Существует большое разнообразие антимикробных препаратов, которые используют с целью санации, однако эти препараты должны быть не только эффективными, но и безопасными. Более того, препараты не должны становиться причиной селекции устойчивых к антибиотикам штаммов микроорганизмов.
В эксперименте на животных применение коктейлей бактериофагов для профилактики системных и лечения локальных инфекций, вызванных метицилин-резистентными (MRSA), показало хорошие результаты, причем эффект оказался сопоставим с лечением ванкомицином и клиндамицином [5].
В Российской практике применения бактериофагов показана хорошая эффективность в отношении основных возбудителей ИСМП вызванных MRSA и полирезистентными штаммами Pseudomonas aeruginosa [10].
В данной статье представлены результаты клинической апробации геля с бактериофагами отофаг для санации носителей S. aureus среди медицинского персонала. Наши исследования показали, что через 1–2 недели после завершения курса санации у 94% участников S. aureus не был обнаружен и через 1–2 месяца 74,5% сотрудников оставались свободны от носительства S. aureus, то есть через 1–2 месяца после санации реинфицирование S. aureus происходило только у 25,5% участников. Это дает основание предполагать, что гель с фагами может быть применен в предэпидемический период для снижения нагрузки S. aureus в стационаре.
Показателен положительный опыт широкого применения стафилококковых фагов в период эпидемического неблагополучия, вызванного MSSA, несущего комплекс генов, кодирующих синтез лейкоцидина Пантона–Валентайна (MSSA-PVL) в условиях родильного дома. Стафилококковый бактериофаг применяли для санации носителей среди медицинского персонала, лечения и экстренной профилактики инфекции у пациентов, обработки внешней среды, что в комплексе с другими мероприятиями позволило остановить циркуляцию MSSA-PVL [2].
В клинической практике используются вирулентные бактериофаги, которые, уничтожая патогенные бактерии, не нарушают нормофлору и не влияют на органы и системы организма хозяина. Это позволяет применять бактериофаги у всех категорий пациентов как эффективное и безопасное антибактериальное средство профилактики и терапии, в том числе в комбинации с антибиотиками [4].
Удобство интраназального введения гелевой формы препарата повышает у персонала приверженность к фаготерапии. Гель дольше задерживается в полости носа, что позволяет пролонгировать воздействие высоких титров фаговых частиц на колонизированную S. aureus слизистую оболочку.
Заключение
Гель с бактериофагами отофаг является безопасным и эффективным средством для санации носителей стафилококка в родовспомогательных учреждениях. Может быть использован для периодической профилактической санации носоглотки медицинского персонала.



