По данным Всемирной организации здравоохранения (ВОЗ), бесплодны 8% супружеских пар. Примерно в половине случаев причиной бесплодия является мужской фактор [1]. Вследствие неправильного расхождения хромосом в мейозе могут возникать хромосомные анеуплоидии в половых клетках. Было отмечено, что у мужчин с различными видами патозооспермии статистически значимо увеличивается риск анеуплоидии хромосом сперматозоидов по сравнению с мужчинами без нарушения сперматогенеза [2, 3], а также риск анеуплоидии хромосом у полученных эмбрионов в программах экстракорпорального оплодотворения/ интрацитоплазматической инъекции сперматозоида (ЭКО/ИКСИ) [4–6]. Следствием анеуплоидии эмбрионов может быть более низкая частота имплантации и наступления беременности и более высокая частота самопроизвольных выкидышей по сравнению с парами, в которых у мужчин отмечаются нормальные параметры спермограммы [7, 8]. Также повышенный уровень анеуплоидии хромосом сперматозоидов увеличивает риск развития хромосомной патологии у детей [9].
 Нарушения сперматогенеза выражаются в различных видах патозооспермии: олигозооспермии (ОЗС), астенозооспермии (АЗС), тератозооспермии (ТЗС) и др. Эффективность программ вспомогательных репродуктивных технологий (ВРТ) может различаться в зависимости от вида патозооспермии вследствие различного уровня анеуплоидии хромосом сперматозоидов и, как следствие, эмбрионов. В литературе существуют противоречивые данные о преимущественном негативном влиянии того или иного вида патозооспермии на исходы программ ВРТ. Например, в ряде работ были получены данные о важной роли ТЗС в развитии неудач ЭКО [10, 11]. У мужчин с ТЗС часто наблюдается повышение уровня анеуплоидии хромосом в половых клетках [5, 12]. Другие исследователи подчеркивают, что ОЗС и АЗС в большей степени, чем ТЗС, влияют на исходы программ ВРТ вследствие выявленного повышенного уровня анеуплоидии хромосом сперматозоидов в этой группе мужчин [13, 14]. Однако в целом исследований по оценке влияния различных нарушений сперматогенеза на исходы ЭКО/ИКСИ вследствие повышенного уровня анеуплоидии хромосом сперматозоидов недостаточно, они сопряжены со значительными ошибками исследования (недостаточный объем выборки, различные методы оценки параметров спермограммы, различные методы определения анеуплоидии хромосом и исходов ЭКО).
Нарушения сперматогенеза выражаются в различных видах патозооспермии: олигозооспермии (ОЗС), астенозооспермии (АЗС), тератозооспермии (ТЗС) и др. Эффективность программ вспомогательных репродуктивных технологий (ВРТ) может различаться в зависимости от вида патозооспермии вследствие различного уровня анеуплоидии хромосом сперматозоидов и, как следствие, эмбрионов. В литературе существуют противоречивые данные о преимущественном негативном влиянии того или иного вида патозооспермии на исходы программ ВРТ. Например, в ряде работ были получены данные о важной роли ТЗС в развитии неудач ЭКО [10, 11]. У мужчин с ТЗС часто наблюдается повышение уровня анеуплоидии хромосом в половых клетках [5, 12]. Другие исследователи подчеркивают, что ОЗС и АЗС в большей степени, чем ТЗС, влияют на исходы программ ВРТ вследствие выявленного повышенного уровня анеуплоидии хромосом сперматозоидов в этой группе мужчин [13, 14]. Однако в целом исследований по оценке влияния различных нарушений сперматогенеза на исходы ЭКО/ИКСИ вследствие повышенного уровня анеуплоидии хромосом сперматозоидов недостаточно, они сопряжены со значительными ошибками исследования (недостаточный объем выборки, различные методы оценки параметров спермограммы, различные методы определения анеуплоидии хромосом и исходов ЭКО).
На основании этого целью исследования стало изучение эффективности программ ВРТ у пар с различными видами патозооспермии у мужчин в зависимости от уровня анеуплоидии сперматозоидов.
Материалы и методы
В проспективное когортное исследование были рекрутированы 86 супружеских пар с мужским фактором бесплодия, проходящих лечение в отделении ВРТ. Критериями включения со стороны женщины были: нормальный кариотип, возраст до 38 лет, нормальный овариальный резерв, уровень фолликулостимулирующего гормона (ФСГ) менее 12 мМЕ/мл, отсутствие противопоказаний к проведению ВРТ, указание на наличие не более двух неудачных попыток ЭКО в анамнезе. Со стороны мужчины условиями включения в исследование были нормальный кариотип, отсутствие указаний на проведение химио- или лучевой терапии в анамнезе, отсутствие острых воспалительных заболеваний, обструкции семявыносящих путей и приема лекарственных средств со спермотоксичным действием. Критериями исключения были развитие синдрома гиперстимуляции яичников средней или тяжелой степени на фоне стимуляции функции яичников в данном цикле ЭКО, а также другие состояния и осложнения, требующие отмены переноса эмбрионов (ПЭ) в изучаемом цикле. Все пациенты подписали информированное согласие на участие в исследовании.
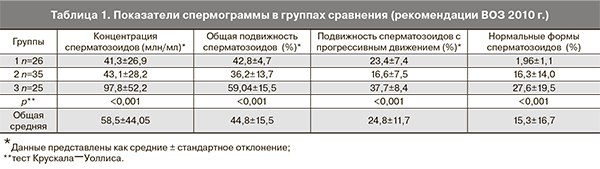
Мужчинам проводился анализ эякулята согласно рекомендациям ВОЗ 2010 года дважды с интервалом в 3 месяца [15]. Эякулят собирался путем мастурбации после 3 дней полового воздержания. В зависимости от результатов спермограммы у мужчин супружеские пары были поделены на 3 группы. Группу 1 составили пациенты с ТЗС (доля патологических форм сперматозоидов более 96%) без других значимых нарушений сперматогенеза. Группа 2 была представлена пациентами с АЗС и/или ОЗС (общая подвижность сперматозоидов менее 40% и подвижность сперматозоидов с прогрессивным движением менее 32%) без ТЗС. Группу сравнения (группу 3) составили пациенты с нормозооспермией (НЗС).
Перед включением в протокол ЭКО пациенты были обследованы согласно приказу Минздрава Российской Федерации от 30.08.2012 № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [16]. Помимо обязательного обследования пациентам проводилось молекулярно-цитогенетическое исследование сперматозоидов. Количество хромосом сперматозоидов оценивалась с помощью флюоресцентной in situ гибридизации (FISH-метода). Проводилось исследование хромосом X, Y и 18. Препараты клеток эякулята готовили по методу Guttenbach (1994) [17]. FISH проводили в соответствии с протоколом, рекомендуемым фирмой – производителем [18]. Для этого использовали ДНК-зонды фирмы Vysis (Abbott Molecular, США), предварительно денатурированные и прямо меченные различными флуоресцентными красителями. По количеству выявленных сигналов судили о количестве исследуемых хромосом. Микроскопический анализ проводили при увеличении 100Х10 с использованием флуоресцентного микроскопа Axioplan 2 фирмы Zeiss. Для каждого пациента были оценены не менее 500 сперматозоидов. У пациентов с выраженной ОЗС были проанализированы все доступные для анализа сперматозоиды.
Стимуляция функции яичников проводилась по единому «короткому» протоколу с применением рекомбинантного ФСГ и антагонистов гонадотропин-рилизинг гормона. Триггер овуляции вводился при наличии в яичниках фолликулов диаметром ≥ 17 мм. В качестве триггера использовался человеческий хорионический гонадотропин в дозе 7500–10000 МЕ. Трансвагинальная пункция яичников осуществлялась через 36 часов после введения триггера овуляции.
Через 48 часов после пункции яичников производилась оценка дробления полученных эмбрионов. Эмбрионы классифицировались согласно их морфологической оценке на 4 группы: А – отсутствие фрагментации, В – <25% фрагментации, С – 25–50% фрагментации и D – более 50% фрагментации. ПЭ в полость матки осуществлялся на 3 – 5-й день культивирования.
Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг/день после трансвагинальной пункции.
 Для статистического анализа использовался пакет статистических программ STATISTICA10 (США). Расчет объема выборки был основан на данных литературы о частоте наступления беременности в программах ВРТ у пар с различными параметрами спермограммы [19]. Для получения валидных данных при принятии уровня альфа 0,05, уровня достоверности исследования 90%, средней 1 (Ср1)=2,6%, средней 2 (Ср2)=1,2%, стандартного отклонения (Со)=1,4% с учетом возможного 15% выбывания пациентов из исследования достаточно включения 27 пациентов в каждую группу.
Для статистического анализа использовался пакет статистических программ STATISTICA10 (США). Расчет объема выборки был основан на данных литературы о частоте наступления беременности в программах ВРТ у пар с различными параметрами спермограммы [19]. Для получения валидных данных при принятии уровня альфа 0,05, уровня достоверности исследования 90%, средней 1 (Ср1)=2,6%, средней 2 (Ср2)=1,2%, стандартного отклонения (Со)=1,4% с учетом возможного 15% выбывания пациентов из исследования достаточно включения 27 пациентов в каждую группу.
Первичной конечной точкой явилось скорректированное отношение шансов (ОШкор) наступления беременности в зависимости от уровня анеуплоидии хромосом сперматозоидов. Имплантация (биохимическая беременность) диагностировалась при повышении уровня β-хорионического гонадотропина человека (β-ХГЧ) выше порогового через 2 недели после ПЭ с последующим его падением без визуализации плодного яйца при ультразвуковом исследовании. Клиническая беременность диагностировалась при визуализации плодного яйца при ультразвуковом исследовании.
Вторичными конечными точками были: средний уровень суммарной анеуплоидии хромосом сперматозоидов и средний уровень отдельных видов анеуплоидии хромосом сперматозоидов, средний уровень фертилизации в сравниваемых группах пациентов, пороговый уровень анеуплоидии в ядрах сперматозоидов, корреляционная зависимость между различными параметрами спермограммы, а также уровнем фертилизации и уровнем анеуплоидии хромосом сперматозоидов.
Статистический анализ проводился с применением χ2-теста для сравнения частотных показателей в 2 и более группах, теста Крускала– Уоллиса для сравнения непрерывных величин в 3 группах, а также многофакторного регрессионного анализа (логистической регрессии) для расчета отношения шансов исходов программ ВРТ и построения ROC-кривой. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Исследование было одобрено этическим комитетом ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Результаты исследования
В исследование были включены 86 супружеских пар: 26 пар с ТЗС, 35 пар с ОЗС/АЗС и 25 пар с НЗС у мужчин. Средний возраст включенных в исследование женщин составил 33,2±4,7, 32,8±3,8 и 33,4±4,3 лет (р=0,8142), возраст мужчин – 36,3±7,5, 36,6±6,8, 38,1±6,8 лет (р=0,5060) в группах 1, 2 и 3 соответственно. При анализе клинико-анамнестических данных как возможных конфаундеров группы не отличались статистически значимо по соматической и гинекологической заболеваемости, менструальной функции и акушерскому анамнезу. Длительность бесплодия была одинаковая в 3 группах пациентов и составила 5,03±3,1, 5,4±3,5 и 6,6±2,9 лет соответственно (р=0,0857). Индекс массы тела (ИМТ) был несколько выше в группе 2 – 22,9±2,6, 25,1±5,1 и 22,01±3,2 (р=0,0286) для групп 1, 2 и 3 соответственно.
Лабораторные показатели также не отличались значимо в 3 группах сравнения. Показатели спермограммы у мужчин выражались в снижении количества, подвижности и повышенном числе морфологически патологических форм сперматозоидов в группах 1 и 2 (табл. 1).
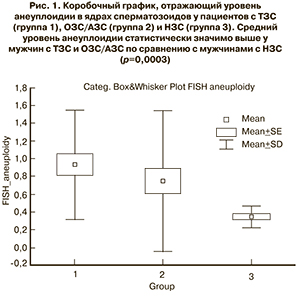
У всех включенных в исследование пациентов была проведена оценка уровня анеуплоидии хромосом сперматозоидов с помощью FISH-метода. Уровень анеуплоидии сперматозоидов статистически значимо отличался в изучаемых группах пациентов и составил 0,93±0,61% в группе 1, 0,74±0,78% в группе 2, и 0,34±0,12% в группе 3 (p=0,0003) ( рис. 1).
 В целом, в когорте наблюдаемых мужчин была выявлена отрицательная корреляция между нормальными формами сперматозоидов и уровнем анеуплоидии (r=-0,21, р=0,047). Количество и подвижность сперматозоидов не имели значимой корреляции с уровнем анеуплоидии (r=-0,19, р=0,068 и r=-0,06, р=0,554).
В целом, в когорте наблюдаемых мужчин была выявлена отрицательная корреляция между нормальными формами сперматозоидов и уровнем анеуплоидии (r=-0,21, р=0,047). Количество и подвижность сперматозоидов не имели значимой корреляции с уровнем анеуплоидии (r=-0,19, р=0,068 и r=-0,06, р=0,554).
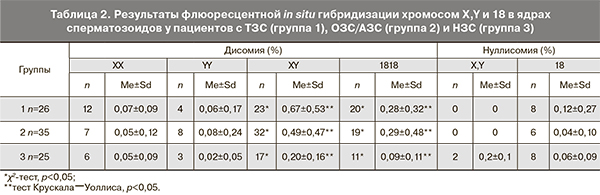
Также была отмечена значимая разница в уровне некоторых видов анеуплоидий ядер сперматозоидов в сравниваемых группах пациентов ( табл. 2). У пациентов с НЗС уровень дисомии XY и дисомии по 18-й хромосоме в ядрах сперматозоидов был статистически значимо меньше, чем у пациентов с нарушениями спермограммы.
В протоколах ВРТ (ЭКО и/или ЭКО+ИКСИ) было получено сходное количество ооцитов и эмбрионов в 3 группах пациенток. У наблюдаемых пациенток было получено 539 ооцитов: 189 в группе 1 (в среднем 7,27±3,76 ооцита на 1 пациентку), 214 в группе 2 (в среднем 6,11±4,24 ооцита на 1 пациентку) и 136 в группе 3 (в среднем 5,44±3,46 ооцита на 1 пациентку) (р=0,0949). Из них зрелых ооцитов было получено 420 (151 в группе 1 (79,9%), 162 в группе 2 (75,8%), 107 в группе 3 (78,7%)), незрелых – 78 (23 в группе 1 (12,2%), 34 в группе 2 (15,8%), 21 в группе 3 (15,5%)), дегенеративных – 41 (15 в группе 1 (7,9%), 18 в группе 2 (8,4%), 8 в группе 3 (5,8%))(p=0,725).
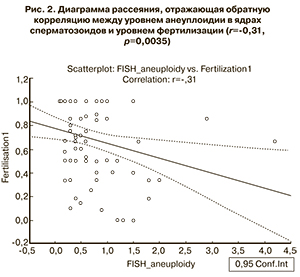
Все 498 ооцита (зрелых и незрелых) были оплодотворены, и из них был получен 271 эмбрион: 103 эмбриона в группе 1 (в среднем 3,96±3,28 эмбриона на 1 пару), 91 эмбрион в группе 2 (в среднем 2,6±1,98 эмбриона на 1 пару), и 77 эмбрионов в группе 3 (в среднем 3,1±1,85 эмбриона на 1 пару) (р=0,3384). При этом общий уровень фертилизации ооцитов составил 58,4±34,7%, 52,8±27,1% и 66,9±27,2% (р=0,1572), а уровень фертилизации зрелых ооцитов составил 65,6±35,7%, 63,5±27,7%, 81,2±26,6% в группах 1, 2 и 3 соответственно (р=0,0402). Наблюдалась статистически значимая отрицательная корреляция между уровнем анеуплоидии сперматозоидов и уровнем фертилизации (r=-0,31, р=0,0035) (рис. 2).
Эмбрионов «хорошего» качества (А и В) было получено 73 (70,8%), 72 (79,1%), 61 (79,2%) в группах 1,2 и 3 соответственно. Эмбрионов «плохого» качества (C и D) было получено 30 (29,2%), 19 (20,9%) и 16 (20,8%) соответственно, что составило в среднем 1,15±1,87, 0,54±1,09, 0,64±1,14 на 1 пациентку в каждой группе (р=0,2793). В каждом цикле проводился перенос 2 эмбрионов сходного качества.
На 14–15-й день после ПЭ была диагностирована 31 биохимическая беременность: 7 беременностей в группе 1 (26,9%), 11 беременностей в группе 2 (31,4%), 13 беременностей в группе 3 (52%) (р=0,1338). Клинически было диагностировано 24 беременности: 4 – в группе 1 (15,4%), 8 – в группе 2 (22,8%), и 12 – в группе 3 (48%) (р=0,0237). Грубое отношение шансов (ОШгр) наступления беременности в зависимости от уровня анеуплоидии составило 4,22, 95% ДИ=1,08, 16,49. При проведении регрессионного анализа с учетом выявленных конфаундеров (концентрации сперматозоидов, ИМТ и количества эмбрионов «хорошего» качества) ОШкор составило 4,51, 95% ДИ=1,09;18,68.
С помощью регрессионного анализа с построением ROC-кривых нами был проведен поиск порогового уровня анеуплоидии ядер сперматозоидов в зависимости от эффективности программ ВРТ, который составил 0,7%. Чувствительность ROC-модели составила 83,3%, специфичность – 41,9%. Площадь под кривой (AUC) составила 62,7% ( рис. 3).
Обсуждение
Тератозооспермия, по критериям ВОЗ, определяется как снижение в эякуляте числа сперматозоидов нормальной формы более 4% [15]. С помощью FISH-диагностики мы определили, что у мужчин с преимущественно этой формой нарушения сперматогенеза отмечается повышенный уровень анеуплоидии в ядрах сперматозоидов по сравнению с мужчинами с ОЗС/АЗС или НЗС. Наши данные согласуются с данными, полученными другими исследователями, изучавшими связь ТЗС с хромосомными аномалиями у мужчин [5, 12].
В данном исследовании мы изучали половые хромосомы X и Y, а также аутосому 18 для разграничения таких нарушений, как дисомии гоносом и диплоидия. Согласно полученным данным, у пациентов как с ТЗС, так и ОЗС/АЗС уровень дисомии X/Y и 18 в ядрах сперматозоидов был в 3 раза выше, чем у пациентов с НЗС. При этом следует отметить, что уровень дисомии по аутосоме 18 в группах мужчин с нарушениями сперматогенеза был статистически значимо выше, чем уровень дисомии по половым хромосомам. У мужчин с НЗС не наблюдалось статистически значимой разницы в этих показателях. Полученные данные не согласуются с данными других исследований, в которых уровень дисомии по половым хромосомам был выше или соответствовал дисомии по аутосомам [20–22]. Однако, в целом, наши данные подтверждают то, что различные нарушения сперматогенеза, особенно ТЗС, коррелируют с повышенным уровнем анеуплоидии в ядрах сперматозоидов.
Вопрос о влиянии различных видов патозооспермии на исходы программ ВРТ и генетическое состояние потомства волнует исследователей с момента внедрения процедуры ЭКО/ИКСИ для лечения пациентов с низким качеством спермы. Мы сравнили исходы программ ВРТ у наблюдаемых пациентов. Уровень фертилизации ооцитов был значительно ниже у пар с нарушениями сперматогенеза по сравнению с группой сравнения. Эти данные соответствуют ранее полученным данным других исследователей [19, 23]. Одной из возможных причин нарушения фертильности у пар с патозооспермией у мужчин может быть повышенный уровень анеуплоидии в ядрах сперматозоидов. В нашем исследовании была выявлена статистически значимая обратная корреляция между уровнем анеуплоидии сперматозоидов и уровнем фертилизации (r=-0,31, р=0,0035).
Не смотря на то что нам не удалось найти статистически значимую разницу в количестве эмбрионов «хорошего» качества и частоте биохимических беременностей в сравниваемых группах пациентов, частота клинически диагностированных беременностей значимо отличалась в 3 группах. Регрессионный анализ показал, что число нормальных форм сперматозоидов и их количества, а также уровень анеуплоидии в ядрах сперматозоидов являются факторами, определяющими вероятность наступления беременности. Шансы наступления беременности у пациентов с НЗС были в 4,5 раза выше, чем у пациентов с нарушениями сперматогенеза. Полученные данные свидетельствуют , что сперматозоиды с нарушением морфологии и анеуплоидией ядер, не смотря на сниженную способность к фертилизации, могут участвовать в получении морфологически качественных эмбрионов. Однако дальнейшее развитие таких эмбрионов нарушается, что приводит к более низкой частоте наступления беременности и более высокой частоте самопроизвольных выкидышей. Одной из наиболее вероятных причин негативных исходов программ ВРТ в этом случае является более высокий риск развития анеуплоидии хромосом эмбрионов у пар с наличием повышенного уровня анеуплоидии ядер сперматозоидов на фоне патозооспермии у мужчин.
Построение ROC-кривой с площадью под кривой 0,63 определило оптимальный порог уровня анеуплоидии ядер сперматозоидов в отношении наступления беременности в программах ЭКО/ИКСИ, который составил 0,7%. Этот уровень анеуплоидии позволяет предсказать наступление беременности с 83% чувствительностью (прогностической ценностью положительного результата 35,7%) и 42% специфичностью (прогностической ценностью отрицательного результата 86,6%).
Таким образом, патозооспермия, особенно ТЗС у мужчин может способствовать повышенному риску неудачных исходов программ ВРТ. Одной из причин подобных исходов может быть повышенный уровень анеуплодии хромосом сперматозоидов. Молекулярно-цитогенетическое исследование эякулята у мужчин с патозооспермией должно быть рекомендовано парам, проходящим лечение бесплодия методом ЭКО/ИКСИ, для принятия решения о проведении преимплантационной генетической диагностики эмбрионов или донации спермы, что может улучшить исходы программ ЭКО и предупредить рождение ребенка с генетическими нарушениями.