Родорозрешение после кесарева сечения (КС) – неизбежный риск. Угрозу несут несовершенство репаративной регенерации миометрия, формирование рубцовой ткани, функциональная несостоятельность оперированной матки [1, 2]. Реституция миометрия возможна, что оправдывает последующее родоразрешение через естественные родовые пути. Предоставление попытки вагинальных родов, обозначаемой в мире аббревиатурой TOLAC (Trial of Labor After Cesarean), требует взвешенного решения. Неинвазивная диагностика полноценности рубца (ультразвуковая, магнитно-резонансная и др.) информативна, но опирается на субъективную оценку [3] и несравнима с точностью гистологического исследования [4]. Прогнозирование состоятельности рубца определяют разнонаправленные факторы: техника КС, использованный шовный материал, методика ушивания матки, особенности послеоперационного периода, особенно – послеродовой эндометрит как результат генерализованной инфекции [5, 6]. Сегодня прослежены генетические пути репарации миометрия после КС, зависимость от неоангиогенеза области раны, иммуногистохимических качеств рубцово-измененного миометрия, других веских факторов [2, 7]. Рубец после КС, как и миометрий в целом, содержит коллаген типа VI, эластин, тяжелую цепь миозина гладких мышц (Smooth Muscle Myosin Heavy Chain, SMMhc), альфа-актин гладких мышц (Alpha Smooth Muscle Actin, aSMA), маркер эндотелиальных клеток CD31 (кластер дифференцировки 31 или молекула адгезии тромбоцитов и эндотелиальных клеток 1 (PECAM1) [7]. Однако коллаген VI типа, эластин, маркер эндотелиальных клеток CD31, aSMA и SMMhc являются активными компонентами как разорвавшейся, так и не разорвавшейся по рубцу матки. Механизм неполноценного заживления разрыва миометрия (его несостоятельности) остается неясным [4]. Принимается во внимание, производилось ли КС до (prelabor Cesarean delivery) или после (early-labor, late labor Cesarean delivery) развития родовой деятельности [8]. Разрабатываются экспериментальные терапевтические стратегии по улучшению регенерации миометрия, деградации коллагена рубца и образования сосудов de novo, основанные, например, на трансплантации амниотических эпителиальных клеток человека [9] и локальном введении мультипотентных мезенхимальных стромальных клеток (ММСК) с трансфицированным геном зеленого флюоресцентного белка (green fluorescent protein, GFP) [10] и др. Однако самые ультрасовременные исследования не заменят анализ клинико-анамнестических сведений – незыблемой основы прогнозирования состоятельности рубца на матке после КС [1, 2, 11, 12]. Сегодня попытка вагинальных родов, к сожалению, предпринимается почти «вслепую», т.к. отсутствие дефекта миометрия по данным ультразвукового исследования (УЗИ) или магнитно-резонансной томографии не гарантирует его состоятельность. Предоперационная гистологическая диагностика оперированного миометрия остается уделом научно-исследовательских центров, но не рутиной.
Цель исследования: выявить гистологические детерминанты (специфику рубца на матке) попытки вагинальных родов после КС.
Материалы и методы
Проведено проспективное многоцентровое когортное исследование в период январь 2013– июль 2019 гг. в родильных домах № 68 и № 29 г. Москвы. Отобраны 272 женщины, категорически настаивающие на естественных родах, но повторно родоразрешенные путем КС: 182 – антенатально (попытка вагинальных родов не была предпринята: либо не предоставлялась (отказ), либо была предпринята, но не состоялась (отсутствие спонтанного начала родов, неэффективная преиндукция/индукция родов)); 90 – интранатально (попытка вагинальных родов была предпринята, но была прервана).
Критерии включения: для всех – КС в анамнезе; поперечный разрез на матке; 1 рубец на матке, независимо от числа КС; доношенный срок беременности; одноплодная беременность; локализация плаценты вне рубца на матке; настойчивое желание родоразрешения через естественные родовые пути. Критерии исключения: более 1 рубца на матке после КС; рубец на матке иного генеза; наличие абсолютных противопоказаний к родоразрешению через естественные родовые пути, предлежание или аномалии инвазии плаценты, многоплодная беременность.
Попытку вагинальных родов производили согласно имеющимся клиническим протоколам [11, 12], исключительно после информированного согласия женщины и принятия решения ex consilio. Роды вели в условиях развернутой операционной, непрерывно мониторируя функциональное состояние плода и сократительную активность матки. При помощи УЗИ оценивали размеры плода, индекс амниотической жидкости, состояние и толщину нижнего сегмента матки в области рубца; на основании допплерометрии определяли индекс резистентности маточных артерий (D – правой, S – левой).
Фрагменты миометрия 117 женщин получали при иссечении рубца во время повторного КС, фиксировали в 10% растворе нейтрального формалина, заливали в парафин. Гистологическое исследование выполняли на серийных депарафинизированных окрашенных срезах. Применяли высокотехнологическое медицинское оборудование с использованием микроскопа Leica DM1000 с камерой Leica EC3, на увеличении 4×/0,10 и 10×/0,25. Использовали окраски: 1) гематоксилин-эозином – в качестве обзорной окраски тканей, в результате которой ядра окрашиваются в синий или фиолетовый, цитоплазма розовая или оранжевая; 2) по Массону – для выявления фиброза, как результат: ядра окрашиваются в черный цвет, протоплазма – в розовый, фибрин – в красный, коллагеновые и ретикулярные волокна – в синий.
Статистический анализ
Для статистического анализа данных применяли компьютерные программы Statistica v12.0 пакета анализа данных Microsoft Excel 2013. Определяли число женщин (n); среднее значение показателя (М) или медиану (Me); стандартное отклонение (SD); верхний и нижний квартили (Q1;Q3); минимальное (Min) и максимальное (Max) значения. Оценивали нормальность распределения вариаций по критерию Колмогорова–Смирнова, распределение считали нормальным при р>0,05. Значимость различий вариаций (p) при нормальности распределения вариаций и однородности дисперсий оценивали по t-критерию Стьюдента, при ненормальности распределения – по U-критерию Манна–Уитни. Для сравнения двух зависимых парных выборок использовали непараметрический одновыборочный критерий Уилкоксона. Значимости различий исходов при воздействии изучаемого фактора определяли на основании критерия хи-квадрат (χ2), при n<10 – χ2 с поправкой Йейтса. Количественную оценку связи между фактором риска и конкретным исходом определяли отношением шансов (ОШ) с 95% доверительным интервалом (ДИ). Применяли шаговую логистическую регрессионную модель (logit-модели) с целью бинарной классификации исхода на основании независимой переменной. Определяли коэффициент регрессии (β-коэффициент) для каждого независимого признака со значениями p, критерий Вальда, а также ОШ и 95% ДИ для ОШ с целью выявления статистически значимых предикторов. Путем построения одномерной логистической кривой устанавливали «пороговое» значение вероятности искомого исхода (y), одному из которых присваивалась переменная отклика 0, другому – 1. В качестве пороговой величины для принятия гипотезы о высокой вероятности исхода принимали значение y=0,5. Для дифференцировки небинарного исхода при множестве независимых переменных использовали метод пошагового дискриминантного анализа. Отбирали высокоинформативные дискриминаторы исхода, рассчитывали показатель Wilks' Lambda (приближение к нулевому значению повышает значимость изучаемого фактора дифференцировать группы), F-критерий, отражающий значимость исключения изучаемого признака из анализа, p-level – уровень его статистической значимости; параметры уравнения дискриминантной функции (k – коэффициент дискриминантной функции, константа), позволяющие вычислить веса классификации (G) по формуле:
G = константа + k1×Y1 + k2×Y2 + ...
где k – коэффициент регрессии, Y – значения исходных переменных.
Подстановка в систему уравнений соответствующих признаку значений и вычисленных коэффициентов позволяют получить итоговое значение G для категориального фактора. Наибольшее из всех значение G указывает, к какой группе относится исход. Демонстрацию различий между группировками основывали на канонических корнях – канонических дискриминантных функциях. Значимость дискриминации подтверждал квадрат расстояния Махаланобиса и его статистическая значимость (F-критерий, p). Информативной принимали точность дифференцировки (% попадания в правильные ответы в обучающей выборке) не менее 80%.
Результаты и обсуждение
Доля женщин с 1 КС в анамнезе оказалась не многим больше половины когорты (61,77%); почти 1/3 (27,94%) женщин перенесли 2 КС, а 1/10 (10,29%) – более 2 (рис. 1).

2 КС в анамнезе в сравнении с 1 КС значительно повышали шанс антенатального КС (соответственно 66 из 76 и 88 из 168, ОШ=6,0; 95% ДИ 2,89–12,46). Показания для антенатального и интранатального КС (индивидуальные или одно из сочетанных) заметно различались (рис. 2).
Основная доля показаний к антенатальному КС была связана с рубцом на матке (например, сочетание с биологической незрелостью шейки матки, отсутствием эффекта от подготовки шейки матки к родам и т.д.), но не напрямую с его несостоятельностью. Ультразвуковые критерии несостоятельности рубца на матке (наличие «ниш», изменения толщины и структуры тканей рубца, присутствие соединительной ткани) явились препятствием для попытки вагинальных родов у 20,88%, а угрожающий разрыв матки прервал ее у 16 (17,78%) женщин. Угрожающий разрыв матки диагностирован у 16 женщин из 90, но почти у 1/2 (n=6) не был подтвержден. У 74 женщин признаки угрожающего разрыва матки отсутствовали, но у 22 из них скрывались под «масками» прогрессирующей гипоксии плода или аномалий родовой деятельности, что потребовало родоразрешения путем КС и обнаружило несостоятельность миометрия. Сопряженность несостоятельности рубца на матке после КС с клиникой угрожающего разрыва матки оказалась высокой, но не абсолютной (OШ=3,94; 95% ДИ 1,28–12,17).
При интранатальном дистрессе (прогрессирующей гипоксии) плода выявлен аналогичный тренд: из 32 женщин с дефектом миометрия дистресс плода отмечен у 8, у 24 отсутствовал; при интактном миометрии (n=58) дистресс плода отмечен у 6, отсутствовал у 52. Сопряженность несостоятельности рубца с функциональными признаками интранатальной гипоксии плода оказалась значимой, но не абсолютной (ОШ=3,27; 95% ДИ 1,02–10,53).
Выделяли 3 варианта гистологической характеристики миометрия в области рубца после КС [3] (рис. 3): преобладание мышечной ткани (A); мышечной ткани с фокусами фиброза (B); преобладание фиброзной ткани (C).
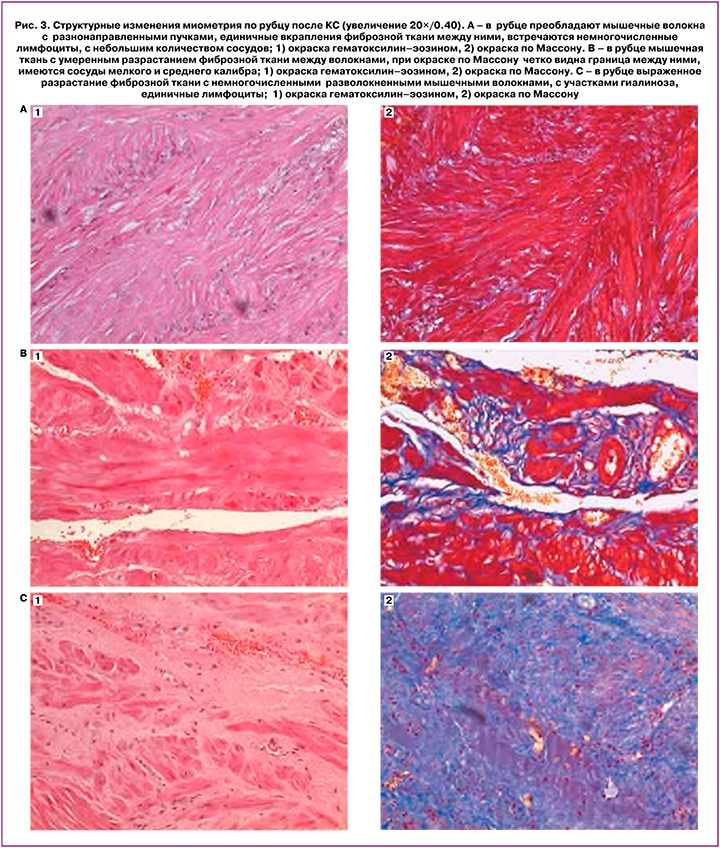
Все 3 гистологических варианта встречались при разном числе КС в анамнезе, при непредпринятой (антенатальном КС) и предпринятой (интранатальном КС) попытках вагинальных родов после КС (рис. 4).
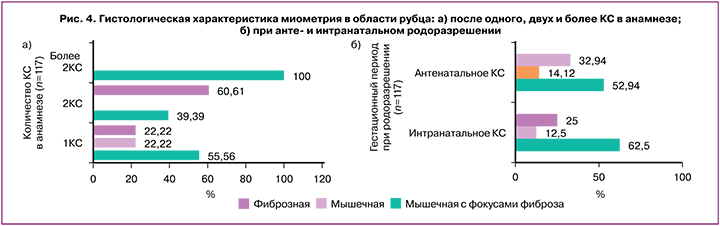
Преобладание мышечной ткани оказалось исключительным маркером одного КС в анамнезе (рис. 4а). Преобладание мышечной ткани с фокусами фиброза значимо не отличало 1 КС от 2 КС (соответственно 40 из 72 и 13 из 33, χ2=2,36; р=0,13). Преобладание фиброзной ткани значимо чаще диагностировано при 2 КС, чем при 1 КС (соответственно 20 из 33 и 16 из 72, χ2=14,80; р<0,001; ОШ=5,39; 95% ДИ 2,21–13,14). К удивлению, у абсолютного числа женщин с более чем 2 КС в анамнезе преобладала мышечная ткань с фокусами фиброза, что оказалось значительно чаще в сравнении с 1 КС (χ2=8,62; p=0,003) и с 2 КС (χ2=13,09; p=0,0003).
Важно, что при непредпринятой (антенатальном КС) и предпринятой (интранатальном КС) попытках вагинальных родов после КС частота преобладания мышечной (χ2=0,01; p=0,94), мышечной с фокусами фиброза (χ2=0,86; р=0,35) или фиброзной ткани (χ2=0,37; р=0,55) была сопоставимой (рис. 4).
Поиск клинико-анамнестических детерминант гистологии рубца наткнулся на тотальное отсутствие точных сведений о хирургических особенностях, воспалительных и послеоперационных осложнениях предыдущего КС. Поэтому ключевое внимание уделяли сопряженности гистологической картины с двумя признанными факторами риска несостоятельности рубца на матке – его ультразвуковой толщиной (минимальной и максимальной) и временным интервалом от предыдущего КС до настоящей беременности. Ожидания оправдались частично. Гистология рубца на матке действительно перекликалась с его ультразвуковой толщиной, как минимальной (F=6,73; p=0,002), так и максимальной (F=8,11; p=0,0007) и обеими (Wilks lambda=0,76; F=5,01; p=0,0009). Однако ультразвуковая толщина рубца оказалась неинформативной для дифференцировки преобладания мышечной ткани от мышечной с фокусами фиброза, т.к. была сопоставима (минимальная – 2,16 (0,42) и 2,17 (0,63) мм, р=0,93; максимальная – 2,19 (0,43) и 2,34 (0,66) мм, р=0,33). Отличие определяло преобладание фиброзной ткани с наименьшей ультразвуковой толщиной в когорте (минимальной – 1,68 (0,43) мм и максимальной – 1,8 (0,35) мм), значимо меньшей в сравнении с преобладанием мышечной (минимальной – р=0,0001) и максимальной – р=0,0002) или мышечной с фокусами фиброза (минимальной – р<0,001 и максимальной – р<0,001) тканями.
Временной интервал в исследуемой когорте оказался не универсальным критерием дифференцировки различной гистологической картины в когорте: был сопоставим при преобладании мышечной ткани и мышечной с фокусами фиброза (6,63 (4,53) и 5,32 (3,48) года, р=0,21), преобладании мышечной ткани и фиброзной (6,63 (4,53) и 6,61 (4,60) года, р=0,99), преобладании мышечной с фокусами фиброза и фиброзной (5,32 (3,48) и 6,61 (4,60) года, р=0,12).
При непредпринятой (антенатальном КС) и предпринятой (интранатальном КС) попытках вагинальных родов данный параметр различался, и у последних не был короче 2 лет. При антенатальном КС наибольший временной интервал характеризовал преобладание мышечной ткани (7,83 (4,65) года), значимо превосходя только показатели мышечной ткани с фокусами фиброза (5,09 (3,87) года, р=0,04). При интранатальном КС, наоборот, преобладание мышечной ткани характеризовалось минимальным временным интервалом (3,00 (0,0) года), значимо более коротким в сравнении как с мышечной с фокусами фиброза (5,80 (2,46) года, р=0,04) так и фиброзной (8,50 (2,45) года, р=0,001) тканями. В отличие от антенатального, при интранатальном КС наиболее продолжительный временной интервал соответствовал преобладанию фиброзной ткани, значимо превышая показатели мышечной с фокусами фиброза (р=0,01).
Благодаря логистической регрессии, были установлены дополнительные прегестационные, гестационные и послеродовые критерии дифференцировки (независимые переменные) одного из исходов – преобладания в рубце после КС мышечной или фиброзной ткани (табл. 1).
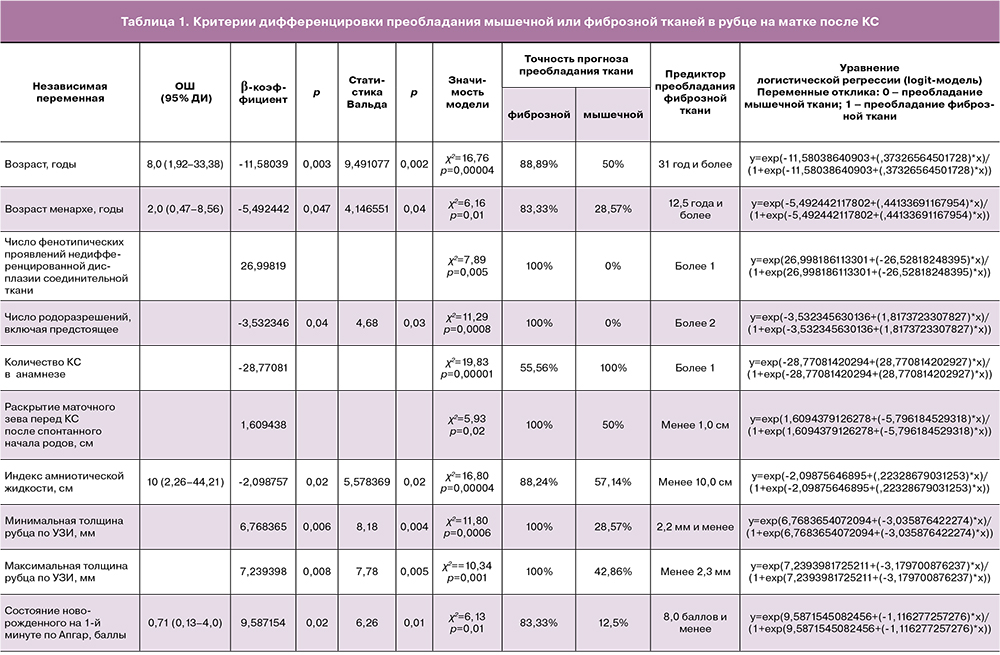
Обращает внимание сопряженность преобладания фиброзной ткани не только с материнскими прегестационными клинико-анамнестическими критериями, незрелостью родовых путей, тенденцией к маловодию, но и с плодовыми – трендом более низкой оценки состояния новорожденного на 1-й минуте по Апгар.
Представляется важной установленная сопряженность гистологии рубца не с одним, а с совокупным множеством крайне разноплановых (клинико-анамнестических, ультразвуковых материнских) факторов. Общий дискриминантный анализ пошагово отобрал 10 высокоинформативных критериев из всех имеющихся, совокупность которых дифференцирует (дискриминирует) женщин с КС в анамнезе по гистологической характеристике рубца (Wilks' Lambda=0,006; F (20,60)=35,96; p<0,001); представил средние значения предикторов для каждого типа ткани; вычислил параметры уравнения дискриминантной функции для прогнозирования (расчета весов классификации) гистологии рубца на матке после КС; оценил его прогностическую значимость (табл. 2).
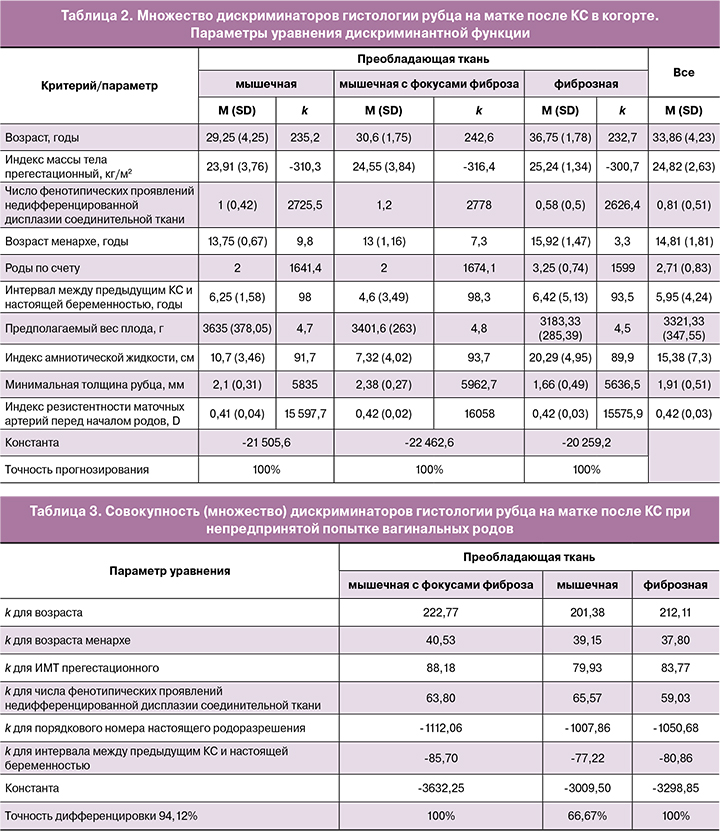
Точность распределения женщин всей когорты с 3 вариантами гистологии рубца на матке по совокупности 10 общих предикторов оказалась абсолютной (100%). Графической визуализацией данных различий является график канонических корней, представленный на рисунке 5а.

Очевидна классификация женщин по гистологическому варианту рубца на матке после КС – незначительное рассеяние точек относительно центроида внутри каждой группировки и достаточное расстояние между центроидами различных группировок. Наилучшая дискриминация отмечена для фиброзной ткани в сравнении как с мышечной с фокусами фиброза (квадрат расстояний Махаланобиса=176,30; F=95,73; р<0,001), так и только мышечной тканью (квадрат расстояний Махаланобиса=125,86; F=58,089; р<0,001); менее выраженная, но статистически значимая – для мышечной и мышечной с фокусами фиброза ткани (квадрат расстояний Махаланобиса=33,72; F=11,53; р<0,001).
Для прегестационных факторов (рис. 5б) максимальная дискриминация соответствовала мышечной ткани в сравнении с мышечной с фокусами фиброза (квадрат расстояний Махаланобиса=1830,88; F=414,26; р<0,001); чуть уступала для мышечной в сравнении с фиброзной тканью (квадрат расстояний Махаланобиса=1051,10; F=276,05; р<0,001); была наименьшей, но значимой, для фиброзной и мышечной с фокусами фиброза (квадрат расстояний Махаланобиса=117,05; F=276,05; р<0,001).
Для гестационных факторов (рис. 5в) наивысшая дискриминация относилась к мышечной с фокусами фиброза ткани в сравнении с фиброзной (квадрат расстояний Махаланобиса=25,39; F=55,11; р<0,001); затем – к мышечной в сравнении с фиброзной тканью (квадрат расстояний Махаланобиса=15,61; F=3,82; р=0,002); менее всего – к мышечной и мышечной с фокусами фиброза (квадрат расстояний Махаланобиса=13,97; F=3,43; р=0,004).
Полученный результат свидетельствует о том, что гистология рубца как отражение индивидуальной репаративной регенерации женщины берет истоки задолго до наступления беременности, имеет крайне разноплановые факторы риска. Преобладание одной из тканей (мышечной или фиброзной) перекликается: со становлением менструальной функции, наличием соединительно-тканного дефекта вне рамок известных генетически обусловленных синдромов (недифференцированной дисплазии соединительной ткани), репродуктивным опытом (числом родоразрешений), интервалом между предыдущим КС и настоящей беременностью. Сопряженность предполагаемого веса плода и индекса амниотической жидкости с гистологией рубца на матке после КС свидетельствуют о связи последнего с функциональным состоянием маточно-плодово-плацентарного комплекса. Подтверждена сопряженность минимальной толщины рубца с гистологией миометрия. Установлена сопряженность гистологии рубца с индексом резистентности правой (D) маточной артерии, отражающая известную гистофункциональную асимметрию кровоснабжения матки.
Очевидно, что детерминанты гистологии рубца после КС не ограничены перенесенной хирургией матки, послеоперационным воспалением. Современные исследования иммуногистохимических характеристик оперированной матки подтверждают это [7]. Вместе с тем представленная дифференцировка оказалась не универсальной. Аналогичная дискриминация женщин с непредпринятой (антенатальным КС) и предпринятой (интранатальным КС) попытками вагинальных родов после КС для последних оказалась безуспешной. Критерии дифференцировки женщин с 3 гистологическими вариантами рубца установлены только для женщин с непредпринятой попыткой вагинальных родов после КС (антенатальным КС). Кроме того, общий дискриминантный анализ отобрал совокупность лишь прегестационных критериев (Wilks' Lambda=0,06; F (12,52)=14,18; p<0,001) (табл. 3), а указанные ранее для всей когорты – предполагаемый вес плода, индекс амниотической жидкости, минимальная толщина рубца и индекс резистентности левой (S) маточной артерии – были «отбракованы» (исключены).
Индивидуальные критерии значимой дифференцировки установлены для преобладания мышечной или фиброзной ткани при непредпринятой (антенатальном КС) и предпринятой (интранатальном КС) попытке вагинальных родов (табл. 4).
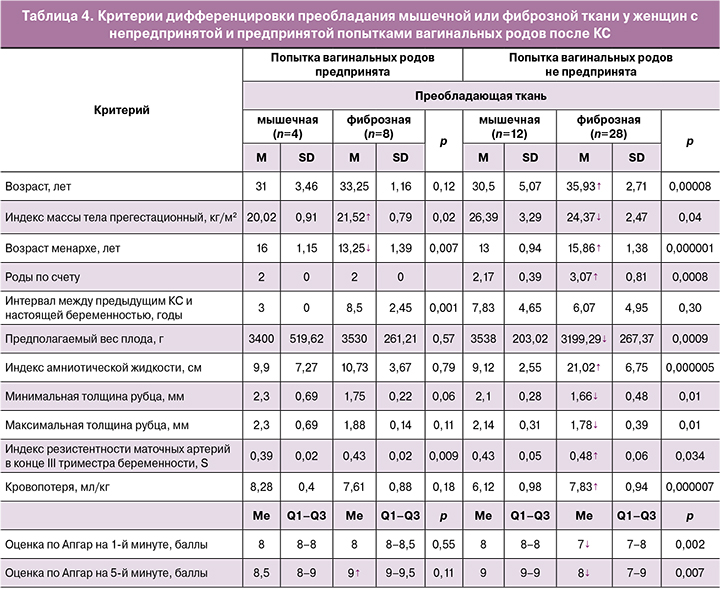
Общими дискриминаторами (р<0,05) преобладания фиброзной ткани в сравнении с мышечной для интранатального и антенатального КС показаны прегестационный индекс массы тела, возраст менархе, индекс резистентности левой (S) маточной артерии, оценка новорожденного по Апгар на 5-й минуте. Исключительно для интранатального КС преобладание фиброзной ткани было сопряжено с меньшим возрастом менархе, большими показателями прегестационного индекса массы тела и оценкой новорожденного по Апгар на 5-й минуте. Только при антенатальном КС преобладание фиброза определяли те же предикторы, но с диаметрально противоположной направленностью различий: больший возраст менархе, меньшие показатели прегестационного индекса массы тела и оценки новорожденного по шкале Апгар на 5-й минуте. Интервал между предыдущим КС и настоящей беременностью имел дифференцирующую значимость только для интранатального КС (р=0,001). Направленность различий факторов риска преобладания фиброзной ткани в сравнении с мышечной в рубце на матке после КС у женщин с непредпринятой (антенатальным КС) и предпринятой (интранатальным КС) попытками вагинальных родов обозначена стрелками в таблице 4.
Интересно, что у женщин с непредпринятой попыткой вагинальных родов (антенатальным КС) преобладание фиброзной ткани предопределяли все отобранные факторы, за исключением интервала между предыдущим КС и настоящей беременностью. Объяснение этому – разноплановость показаний к настоящему КС, большая часть из которых не имела «рубцовых» корней, не была связана с несостоятельностью рубца, числом КС в анамнезе более 2.
Таким образом, фактор послеоперационного воспаления бесспорен и первостепенен по значимости. Но очевидно, что репарация миометрия подвержена спектру факторов, выходящих за рамки послеоперационного воспаления или хирургии матки. Преобладание скрытого течения инфекционно-воспалительных осложнений после КС препятствует оценке рисков при последующем родоразрешении.
Полученные данные свидетельствуют о том, что гистологическую дифференцировку рубца определяет взаимосвязанная совокупность факторов, различных по времени (прегестационные, гестационные и послеродовые), по принадлежности матери или плоду. Гистология рубца на матке после КС отражает континуум от рождения (наличие недифференцированной дисплазии соединительной ткани), в дальнейшем – становление менструальной функции (возраст менархе), репродуктивный опыт, включая КС, вплоть до настоящей беременности и ее прогресса (индекс амниотической жидкости, предполагаемый вес плода, индекс резистентности маточных артерий), в дальнейшем определяет специфику послеродового периода матери (кровопотеря) и новорожденного (оценка по Апгар).
Установленные факторы (возраст менархе, возраст матери при родоразрешении, число родов, число фенотипических проявлений недифференцированной дисплазии соединительной ткани, гестационный срок беременности при родоразрешении, индекс амниотической жидкости, предполагаемый вес плода, индекс резистентности маточных артерий перед родоразрешением, толщина рубца (минимальная и максимальная) являются конфаундерами гистологии рубца на матке и могут быть вмешивающимися факторами для репарации оперированной матки и для показаний или противопоказаний предоставления попытки вагинальных родов после КС.
Заключение
Доля современных женщин, настаивающих на родоразрешении через естественные родовые пути, после 1 КС в анамнезе составляет 61,77%, после 2 КС – 27,94%, более 2 – 10,29%. Непредпринятая попытка вагинальных родов после КС более характерна для 2 КС в анамнезе в сравнении с 1 КС (ОШ=6,0; 95% ДИ 2,89–12,46).
При 1 рубце на матке преобладание мышечной ткани (практически отсутствие фиброзного компонента) возможно после 1 КС в анамнезе и не более. Преобладание мышечной ткани с фокусами фиброза не является критерием дифференцировки женщин с 2 КС от 1 КС в анамнезе (р=0,13), а преобладание фиброзной ткани – является (ОШ=5,39). Перенесенные более чем 2 КС в анамнезе, вопреки стереотипам, не характеризуются более «неблагоприятной» гистологической картиной: преобладание мышечной ткани с фокусами фиброза выявляется значительно чаще в сравнении с 1 КС (p=0,003) и с 2 КС (p=0,0003), а преобладание фиброзной ткани не выявлено вообще, опровергая «страхи» о гарантированно низком качестве регенерации миометрия после неоднократного иссечения рубца в сравнении с 1 КС.
При непредпринятой и предпринятой попытках вагинальных родов после КС установлена сопоставимая частота преобладания мышечной (р=0,94), мышечной с фокусами фиброза (р=0,35) или фиброзной ткани (р=0,55). Детерминанты 3 вариантов гистологии рубца на матке после КС не ограничиваются перенесенной хирургией матки. Выделены высокоинформативные (р<0,05) клинико-анамнестические прегестационные, гестационные и послеродовые (материнские и плодовые) критерии дифференцировки 3 гистологических вариантов миометрия после КС как проявление его индивидуальной репарации. Данная дифференцировка оказалась возможной исключительно для женщин с непредпринятой попыткой вагинальных родов (с антенатальным КС), для которых совокупность критериев имеет исключительно прегестационные истоки (Wilks' Lambda=0,06; p<0,001): возраст женщины, возраст менархе, прегестационный индекс массы тела, число фенотипических проявлений недифференцированной дисплазии соединительной ткани, порядковый номер настоящего родоразрешения, интервал между предыдущим КС и настоящей беременностью. Индивидуальными критериями, значимо различающими преобладание мышечной или фиброзной ткани при непредпринятой (антенатальном КС) и предпринятой (интранатальном КС) попытках вагинальных родов, являются (р<0,05): прегестационный ИМТ, возраст менархе, индекс резистентности левой (S) маточной артерии, оценка новорожденного по Апгар на 5-й минуте. Отмечена разнонаправленность различий большинства данных критериев при предпринятой и непредпринятой попытках вагинальных родов.
Репарация миометрия после КС характеризует организм женщины в целом, что объясняет ее сопряженность с возрастом менархе, количеством прожитых лет, опытом родоразрешения. Установленные конфаундеры взаимосвязаны с тканевыми структурами миометрия. Очевидна параллель между гистологией рубцовой ткани и факторами, формирующимися в динамике беременности, но ее патогенез не до конца ясен. Более объемная кровопотеря при преобладании фиброзной ткани, несмотря на крайне низкую васкуляризацию рубцовой ткани, объясняется сопутствующими факторами риска (крупный плод, преэклампсия и др.). Нельзя не отметить негативную роль преобладания фиброзной ткани в состоянии новорожденного (оценка по Апгар на 1-й и 5-й минутах). Однако гистология миометрия не показана аргументом, оправдывающим или оспаривающим post factum попытки вагинальных родов. Очевидна необходимость рассматривать гистологию рубца на матке после КС, как суммирующую прегестационных, гестационных и интранатальных факторов, выходящих за пределы операционно обусловленных.



