Синдром поликистозных яичников (СПЯ) диагностируется у 8–21% женщин репродуктивного возраста. После пересмотра критериев NIH (1990) в 2012 г. было принято решение о предпочтительном использовании для постановки диагноза СПЯ согласованных критериев ASRM/ESHRE (2003), International PCOS Network (2018) с обязательным указанием клинических вариантов фенотипов СПЯ. Данный подход к диагностике СПЯ поддерживается Российской ассоциацией эндокринологов и Российским обществом акушеров‑гинекологов (РОАГ) в клинических рекомендациях «Синдром поликистозных яичников» (2021) [1, 2].
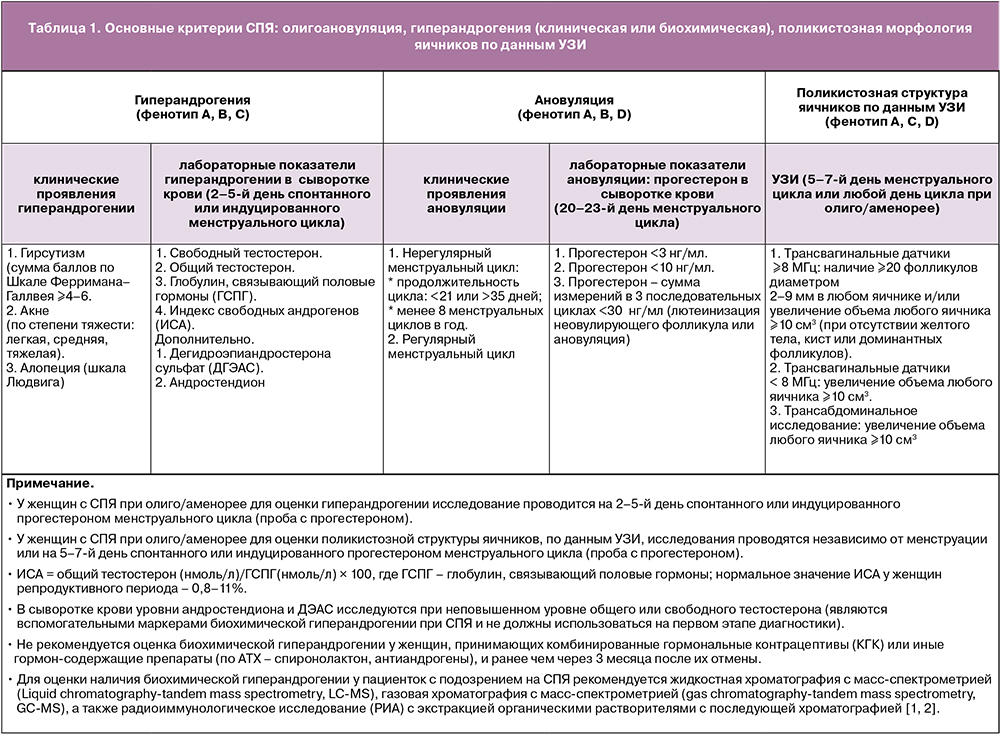
Основными диагностическими критериями СПЯ являются:
- олигоановуляция;
- гиперандрогения (клиническая или биохимическая);
- поликистозная морфология яичников по данным ультразвукового исследования (УЗИ).
У женщин репродуктивного возраста сочетание любых двух из трех основных критериев определяет фенотип СПЯ:
- фенотип A (классический) – наличие гиперандрогении, хронической ановуляции, ультразвуковых признаков поликистозной морфологии яичников (ГА+АНО+ПКЯ);
- фенотип В (ановуляторный) – наличие гиперандрогении и олиго/ановуляции, но без ПКЯ (ГA+AНO);
- фенотип С (овуляторный) – наличие гиперандрогении и ПКЯ, но при регулярном овуляторном цикле (ГA+ПКЯ);
- фенотип D (неандрогенный) – наличие хронической ановуляции и ПКЯ, но без клинических или биохимических проявлений гиперандрогении (AНO+ПКЯ).
Клиническое и лабораторное обследование женщин с СПЯ
СПЯ – полигенное эндокринное расстройство, ассоциированное с репродуктивными, метаболическими и психологическими особенностями.
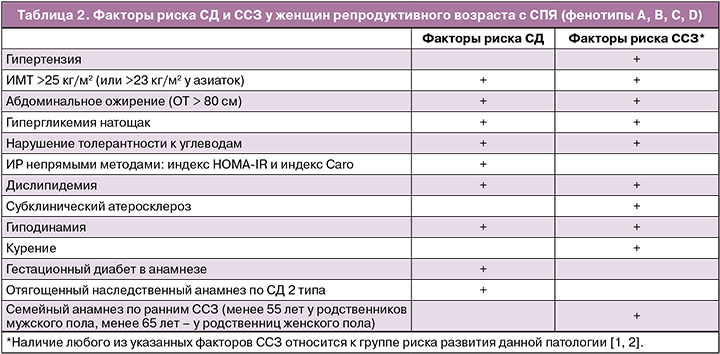
Рекомендуется всем женщинам с СПЯ проводить клиническое и лабораторное обследование для выявления метаболических нарушений и факторов риска развития сахарного диабета (СД), сердечно-сосудистых заболеваний (ССЗ):
1. измерение артериального давления;
2. измерение роста и массы тела с вычислением индекса массы тела (ИМТ) (для диагностики избыточной массы тела или ожирения);
3. измерение окружности талии (ОТ) для диагностики абдоминального (висцерального) ожирения. Показателем абдоминального (висцерального или андроидного) типа ожирения у женщин является ОТ > 80 см;
4. исследование липидного профиля (биохимический анализ крови по оценке нарушений липидного обмена);
5. исследование гликемического статуса:
- уровень глюкозы натощак;
- уровень гликированного гемоглобина в крови;
- проведение перорального глюкозотолерантного теста (ПГТТ);
- определение инсулинорезистентности (ИР) непрямыми методами: индекс HOMA‑IR и Caro:
- индекс Caro – отношение глюкозы (в ммоль/л) к инсулину (в мкМЕ/мл) в плазме крови натощак (нормальное значение ≥ 0,33);
- индекс HOMA‑IR = уровень глюкозы натощак (ммоль/л) × уровень инсулина натощак (мЕд/л) / 22,5.
Согласно клиническим рекомендациям «Синдром поликистозных яичников» (2021), ИР может быть диагностирована при значениях индекса HOMA‑IR более 3,9 [1].
Однако в большинстве современных исследований индекс HOMA‑IR в диапазоне 2,2–2,9 уже рассматривается как ИП [3–7].
Рекомендуется повторное проведение ПГТТ каждые 1–3 года в зависимости от наличия факторов риска развития нарушений углеводного обмена, а также на этапе прегравидарной подготовки, при беременности – в интервале между 24‑й и 28‑й неделями (при отсутствии прегестационного СД) [1, 2].
Рекомендуется при первичном обследовании всем женщинам с СПЯ выявлять факторы риска СД и ССЗ.
Стратегия терапии у женщин с СПЯ
У женщин репродуктивного возраста с СПЯ для улучшения качества жизни рекомендуется использовать терапевтическую многокомпонентную модификацию образа жизни (ТМОЖ), включающую дозированную физическую нагрузку, рациональное сбалансированное питание, а также коррекцию метаболических изменений, нарушений углеводного обмена, избыточной массы тела, ожирения для предотвращения развития ССЗ.
У пациенток с СПЯ, нарушениями менструального цикла и клиническими проявлениями гиперандрогении (гирсутизм и акне) в качестве терапии первой линии рекомендуется проводить терапию КГК: КОК (по АТХ – прогестагены и эстрогены (фиксированные сочетания)), пластырь, интравагинальное кольцо. Женщинам с СПЯ, не заинтересованным в беременности, рекомендуются любые методы контрацепции с учетом критериев приемлемости контрацепции ВОЗ.
В составе КГК рекомендуется использовать низкие эффективные дозы эстрогена (20–30 мкг этинилэстрадиола или его эквивалента) или натуральные препараты эстрогена, уравновешивающие эффективность, профиль метаболического риска, побочные эффекты. Гестаген в составе КГК может быть любым. Однако к предпочтительным относятся гестагены с доказанной метаболической нейтральностью. Низкодозированные КГК (содержащие этинилэстрадиол 20 или 30 мкг / дроспиренон 3 мг и метафолин в дозе 0,451 мг/сут) могут быть рекомендованы пациенткам с СПЯ и дефицитом фолатов, ассоциированным с развитием метаболических и эндотелиальных рисков.
Оценка эффективности лечения КГК проводится не ранее чем через 6 месяцев [1, 2].
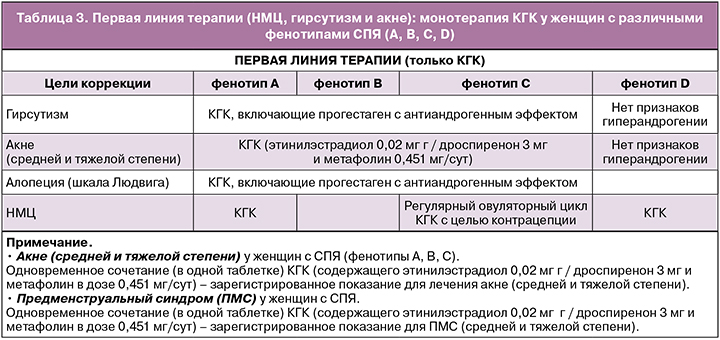
Женщины с СПЯ (фенотипы А, В, С, D), не планирующие беременность
Первая линия терапии (при нарушениях менструального цикла (НМЦ), гирсутизме и акне): монотерапия КГК у женщин с различными фенотипами СПЯ (А, В, С, D)
КГК, метформин и другие фармакологические препараты при СПЯ используются «off label» (без официальных показаний в инструкции). Однако имеется большое число исследований, подтверждающих их эффективность для лечения патологических состояний при этом заболевании. Женщин необходимо информировать о возможных рисках и побочных эффектах, обсуждать эффективность и доказанные преимущества предложенной персонализированной терапии СПЯ.
Рекомендуется проводить монотерапию КГК в качестве терапии первой линии при НМЦ, гирсутизме и акне. Оценка эффективности лечения проводится не ранее чем через 6 месяцев [1, 2].
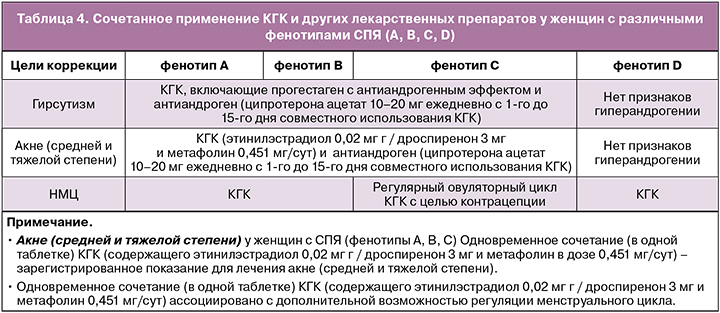
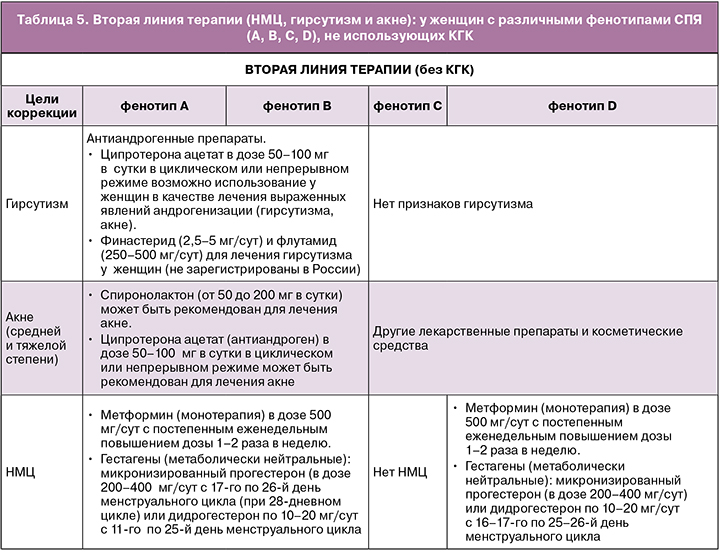
Вторая линия терапии (НМЦ, гирсутизм и акне): у женщин с различными фенотипами СПЯ (А, В, С, D), не использующих КГК
У женщин с СПЯ (фенотипами А, В, С, D), не планирующих беременность, в случае наличия противопоказаний к использованию КГК или их непереносимости возможно в качестве второй линии терапии применение следующих лекарственных препаратов (в зависимости от целей лечения) [1].
Примечание.
• Гирсутизм и акне (средней и тяжелой степени) у женщин с СПЯ (фенотипы А, В, С)
Рекомендуется применение антиандрогенов при гирсутизме и акне (средней и тяжелой степени) в качестве монотерапии только при наличии противопоказаний к применению КГК или при непереносимости КГК.
При назначении антиандрогенных препаратов необходима надежная контрацепция [1, 8, 9].
• Нормогонадотропная ановуляция с НМЦ и/или с регулярным менструальным циклом у женщин с СПЯ (фенотипы А, В, D).
• Метформин в качестве 2-й линии терапии у пациенток с СПЯ и нерегулярными менструациями в случае наличия противопоказаний к использованию КГК или их непереносимости. Метформин (монотерапия) рекомендуется использовать у пациенток с СПЯ и нормогонадотропной ановуляцией для улучшения овуляторной функции яичников. Применение метформина представляется безопасным в долгосрочной перспективе, однако необходимо учитывать, что использование может быть связано с низким уровнем витамина B12 [1, 2].
• Показанием к применению прогестагенов являются состояния, связанные с недостаточностью эндогенного прогестерона (ЛНФ, ановуляция) и нарушениями структуры эндометрия (гиперплазия эндометрия) у женщин с СПЯ (фенотипы А, В, С, D) [1, 10–12].
- Гестагены (метаболически нейтральные): микронизированный прогестерон (в дозе 200–400 мг/сут) с 17-го по 26-й день менструального цикла или дидрогестерон по 10–20 мг/сут с 16-го по 25-й день менструального цикла [11].
- У женщин с СПЯ и гиперплазией эндометрия (ГЭ) рекомендуется после морфологической верификации диагноза ГЭ в качестве медикаментозной терапии использовать локальное воздействие левоноргестрела в форме внутриматочной терапевтической системы (по АТХ – пластиковые спирали с гестагенами). В случае противопоказаний к ЛНГ-ВМС или отказа от ее введения – терапия прогестагенами (по АТХ – прогестагены) в непрерывном или пролонгированном циклическом режимах [12].
Нарушения углеводного обмена у женщин с СПЯ (фенотипы А, В, С, D)
Для лечения метаболических изменений, нарушений углеводного обмена, избыточной массы тела и ожирения у пациенток с СПЯ рекомендуется использовать терапевтическую многокомпонентную модификацию образа жизни (ТМОЖ), включающую дозированную физическую нагрузку, рациональное сбалансированное питание [1, 2].
- Метформин может применяться у женщин с СПЯ для коррекции выявленных нарушений углеводного обмена (ИР, нарушение толерантности к глюкозе (НТГ), СД 2 типа), факторами риска развития СД и/ или избыточной массой тела (ИМТ ≥ 25) кг/м2. Метформин используется в дозе 500 мг/сут с постепенным еженедельным повышением дозы 1–2 раза в неделю). Возможно одновременное сочетание КГК и метформина у женщин с СПЯ для коррекции метаболических нарушений, когда применение КГК и изменение образа жизни не приводят к достижению желаемых целей.
- Лираглутид может применяться у женщин с СПЯ для коррекции выявленных нарушений углеводного обмена (ИР, НТГ, СД 2 типа), факторами риска развития СД и/или избыточной массой тела (ИМТ ≥ 25) кг/м2. Лираглутид применяется в дозе 0,6–1,8 мг/сут. Возможно одновременное сочетание КГК и лираглутида.
- Инозитолы (мио‑инозитол и D‑хиро‑инозитол) возможны для использования у женщин с СПЯ и нарушениями углеводного обмена (ИР, НТГ), а также факторами риска развития СД. Инозитол (в любой форме) в настоящее время следует рассматривать как экспериментальную терапию при СПЯ.
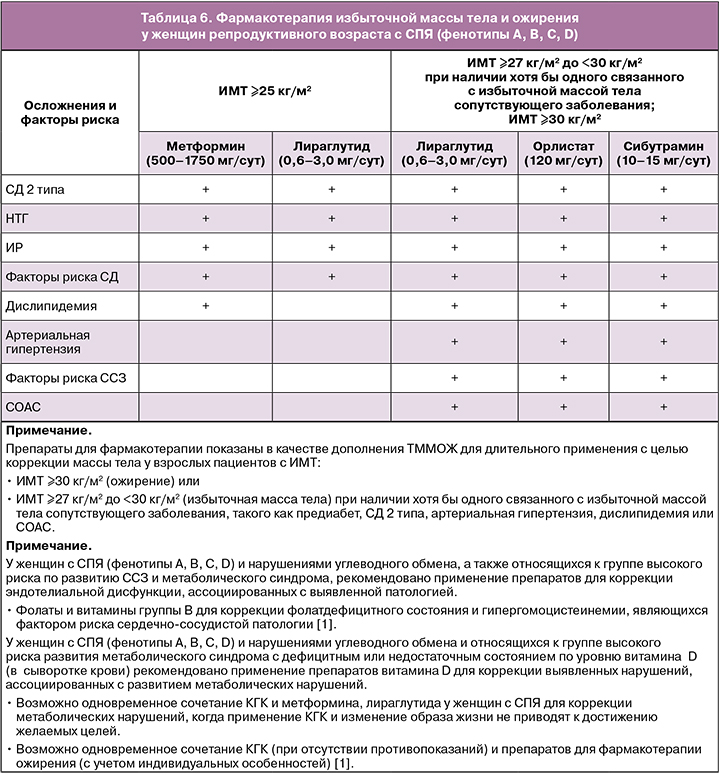
Избыточная масса тела и ожирение у женщин с СПЯ (стратегия терапии)
Для лечения метаболических изменений, нарушений углеводного обмена, избыточной массы тела и ожирения у пациенток с СПЯ (фенотипами А, В, С, D) рекомендуется использовать терапевтическую многокомпонентную модификацию образа жизни (ТММОЖ), включающую дозированную физическую нагрузку, рациональное сбалансированное питание [1, 2].
У женщин с СПЯ с ожирением (ИМТ ≥30 кг/м2) или с ИМТ ≥27 кг/м2, но с наличием одного из следующих осложнений: артериальная гипертензия, дислипидемия, СД 2 типа, синдром обструктивного апноэ сна (СОАС) рекомендуется использование препаратов для фармакотерапии ожирения [1]:
- орлистат в дозе 120 мг/сут;
- сибутрамин в дозе 10–15 мг/сут;
- лираглутид в дозе 0,6–3,0 мг/сут.
У женщин с СПЯ и ИМТ ≥40 кг/м2 или ≥35 кг/м2 при наличии осложнений, связанных с ожирением, рекомендуется применение бариатрической хирургии.
Оценку эффективности лекарственной терапии ожирения следует проводить через 3 месяца от начала лечения. Неэффективным может считаться снижение массы тела менее чем на 5% исходной в течение 3 месяцев [1].
Женщины с СПЯ (фенотипы А, В, С, D), планирующие беременность
Первая линия терапии у пациенток с нормогонадотропной ановуляцией и СПЯ (фенотипы А, В, D), ассоциированных с бесплодием
- Кломифена цитрат (КЦ) применяется по 50–150 мг в день в течение 5 дней, начиная со 2–5‑го дня спонтанного или индуцированного менструального цикла (стартовая доза составляет 50 мг в день) [1, 2, 13].
- Летрозол применяется в дозе 2,5–5,0 мг/сут с 3‑го по 7‑й или с 5‑го по 9‑й дни менструального цикла (стартовая доза составляет 2,5 мг в день). Летрозол может быть рекомендован пациентке только с подписанием информированного добровольного согласия [1, 2, 13].
Вторая линия терапии (при неэффективности применения кломифен цитрата или отсутствии условий для его применения)
- Лапароскопический дриллинг. Для достижения эффекта при СПЯ достаточно 4 пункций яичника, с большим их числом ассоциировано возрастание преждевременной овариальной недостаточности. У 50% пациентов после лапароскопии требуется индукция овуляции. Если через 12 недель после лапароскопии овуляция отсутствует, следует использовать стимуляцию КЦ, а через 6 месяцев применения КЦ возможно применение гонадотропинов [1].
- Стимуляция овуляции гонадотропинами. Продолжительность использования гонадотропинов не должна превышать 6 циклов. При проведении стимуляции гонадотропинами рекомендуется мониторировать овариальный ответ.
Третья линия терапии
Программа ВРТ (при отсутствии беременности в течение 6–9 месяцев)
- Показанием к применению прогестагенов являются состояния, связанные с недостаточностью эндогенного прогестерона (ЛНФ, ановуляция) и нарушениями структуры эндометрия [10–12].
- У женщин с СПЯ с ановуляторным бесплодием, получающих лечение препаратами для стимуляции овуляции, рекомендовано использование препаратов прогестерона для поддержки лютеиновой фазы менструального цикла.
- Микронизированный прогестерон (в дозе 200–400 мг/сут) или дидрогестерон по 10–20 мг/сут, начиная с 14–17‑го дня менструального цикла, которые используют до проведения теста на беременность. При отсутствии беременности данные лекарственные препараты отменяются с началом менструально‑подобного кровотечения.
- У женщин с СПЯ, получающих лечение с помощью ВРТ, после переноса эмбрионов рекомендовано назначить препараты микронизированного прогестерона или дидрогестерон в день трансвагинальной пункции яичников или первые 3 суток после нее для поддержания посттрансферного периода. Длительность назначения в случае наступления беременности определяется врачом‑акушером‑гинекологом в соответствии с инструкцией по применению, особенностями течения беременности и анамнезом пациентки [13].
Метформин в протоколах для стимуляции овуляции
Метформин (монотерапия) рекомендуется использовать у пациенток с СПЯ и ановуляторным бесплодием для улучшения овуляторной функции и в качестве альтернативной схемы стимуляции овуляции [1, 2, 13].
- Метформин в сочетании с КЦ может применяться для преодоления резистентности к КЦ.
- Метформин в сочетании с КЦ может применяться для стимуляции овуляции у женщин с СПЯ и ожирением (ИМТ ≥30 кг/м2).
- Метформин в сочетании с гонадотропинами может использоваться у женщин с СПЯ, ановуляторным бесплодием, резистентностью к КЦ и отсутствием других факторов бесплодия для улучшения овуляторной функции, увеличения вероятности наступления беременности и рождаемости.
- Метформин может снизить риски гиперстимуляции, однако значимо не влияет на уровень живорождения.
- Метформин рекомендуется использовать для предотвращения синдрома гиперстимуляции яичников в качестве адъювантной терапии у женщин с СПЯ, проходящих лечение с помощью ВРТ.
- Метформин назначается в дозе от 1000 до 2500 мг/сут одновременно с препаратами для индукции овуляции [1, 2, 13].
Заключение
Дифференциальный и персонифицированный подход к обследованию женщин репродуктивного возраста с СПЯ, учитывающий фенотип синдрома, является определяющим в выборе стратегии терапии и относится к значимым факторам в профилактике осложнений, связанных с метаболическим синдромом, в первую очередь риском развития сердечно‑сосудистых заболеваний.



