Миома матки (ММ) – наиболее распространенная доброкачественная опухоль матки у женщин репродуктивного возраста, состоящая из гладкомышечных клеток [1, 2]. Согласно статистическим данным, ММ выявляется более чем у 30% женщин репродуктивного возраста и у 30–40% женщин старше 40 лет [3].
Известно, что у каждой 10-й женщины с бесплодием диагностируется ММ [4]. При этом, с одной стороны, интрамуральная ММ не считается однозначной причиной нарушения фертильности, с другой – ее отрицательное влияние на детородную функцию не подвергают сомнению. Метаанализ Pritts E.A. et al. показал статистически значимое снижение вероятности имплантации, количества беременностей и родов наряду с увеличением случаев спонтанных выкидышей у пациенток с интрамуральной локализацией узлов [5]. В 2017 г. Christopoulos G. et al. также доказали снижение вероятности наступления беременности в программах вспомогательных репродуктивных технологий (ВРТ) у пациенток с интрамуральной ММ без деформации полости [6]. Подобные результаты были заявлены также Sagi-Dain L. et al. [7].
В то же время в литературе представлены и совершенно противоположные результаты. Klatsky P.C. et al. показали, что различий в частоте наступления беременности у пациенток с интрамуральной ММ и без нее не выявлено [8]. Схожие данные были получены и другими авторами, анализирующими результаты искусственной инсеминации у пациенток с интерстициальной ММ и неясным генезом бесплодия [9].
Проведенный нами анализ литературных данных позволил сформулировать гипотезу о том, что в случае инфертильности при интрамуральной ММ без деформации полости, помимо локальных факторов, вероятно, существуют какие-то дополнительные клинико-анамнестические саплемент-факторы, ассоциированные с неудачными имплантациями.
Цель настоящего исследования: изучение клинико-анамнестических саплемент-факторов инфертильности при интрамуральной ММ.
Материалы и методы
В соответствии с поставленной целью проведен ретроспективный анализ медицинской документации 370 пациенток репродуктивного возраста с ММ (FIGО 3–6 тип), которым проводились обследование и лечение в период с 2017 по 2020 гг.
В ходе исследования пациентки были разделены на 2 группы. Основную группу составили 240 пациенток с интрамуральной ММ и бесплодием; 130 фертильных пациенток с интрамуральной ММ составили группу сравнения, среди которых 70 пациенток в I триместре беременности и 60 женщин, родивших менее 12 месяцев назад, у которых до беременности и/или во время беременности была диагностирована ММ.
Критерии включения в основную группу: возраст 20–35 лет, ММ (FIGO 3–6 тип), отсутствие беременности более 1 года регулярной половой жизни, регулярный менструальный цикл, отсутствие приема гормональных препаратов в течение последних 6 месяцев, неудачные попытки ЭКО в анамнезе, нормальный овариальный резерв (уровень антимюллерова гормона ≥1,2 нг/мл), отсутствие оперативного лечения по поводу ММ в анамнезе, наличие информированного согласия на участие в исследовании.
Критерии включения в группу сравнения: возраст 20–35 лет, ММ (FIGO 3–6 тип), регулярный менструальный цикл, обращение для планового и диспансерного наблюдения и подбора контрацепции в течение 12 месяцев после родов, диагностирование во время беременности и/или до беременности ММ, I триместр беременности, наличие информированного согласия на участие в исследовании.
Критерии исключения из основной группы: субмукозная ММ (по FIGO 0–2 тип) и субсерозная ММ (FIGO 7 тип), большие размеры миоматозного узла и матки (более 12 недель беременности) [10], наличие острых воспалительных заболеваний органов малого таза, женское бесплодие трубного происхождения, верифицированное на момент исследования, женское бесплодие цервикального происхождения, женское бесплодие, связанное с мужскими факторами, женское бесплодие, связанное с отсутствием овуляции, низкий овариальный резерв (уровень антимюллерова гормона <1,2 нг/мл), опухоли яичников, наличие в анамнезе оперативного лечения по поводу миомы матки, наличие распространенных форм эндометриоза, верифицированных при лапароскопии, онкологические заболевания, наличие у пациенток гиперпролактинемии, ассоциированной с макро- или микроаденомой гипофиза (по данным магнитно-резонансной томографии), дефицита массы тела (индекс массы тела <19,9 кг/м2).
Критерии исключения из группы сравнения: субмукозная ММ (FIGO 0–2 тип) и субсерозная ММ (FIGO 7 тип), большие размеры миоматозного узла и матки (более 12 недель беременности) [10].
Локализацию миомы определяли с использованием классификации FIGO [9], а также особенностей влияния на фертильность узлов больших и небольших размеров (согласно клиническим рекомендациям Минздрава России по ММ (2020), большими следует считать узлы более 12 недель беременности) [1]. Ультразвуковая диагностика проводилась с использованием трансвагинального объемного датчика на аппарате Voluson E 10 Expert. Наличие наружного генитального эндометриоза было верифицировано на основании данных лапароскопии либо магнитно-резонансного исследования; трубный фактор бесплодия – при лапароскопии или гистеросальпингографии. Исследование включало анализ социально-демографических и клинико-анамнестических данных пациенток обследуемых групп.
Cтатистический анализ
Для анализа результатов использовали статистические компьютерные программы SPSS (версия 10.0.7) и Statistica (версия 8.0) for Windows. Различия между группами считали статистически значимыми при р<0,001.
Для каждой группы пациенток распределение количественных показателей было проверено на соответствие нормальному с помощью критерия Колмогорова–Смирнова. При описании нормально распределенных показателей использовали форму представления характеристик в виде среднего арифметического значения и стандартного отклонения М (SD), при распределении признаков, отличающихся от нормального, использовали описание в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3). Качественные показатели представлены как в абсолютных (n), так и в относительных (%) величинах.
При сравнении групп по количественным признакам, имеющим нормальное распределение и равенство дисперсий (по критерию Ливиня), применялся параметрический метод – t-критерий Стьюдента. В противном случае – при невыполнении данных требований – использовался непараметрический критерий Манна–Уитни.
Все имеющиеся заболевания были зашифрованы согласно Международной классификации болезней 10 пересмотра (МКБ-10) и закодированы в двоичном виде, где 1 – есть заболевание, 0 – нет заболевания. При сравнении качественных бинарных показателей в данной научной работе были использованы критерий Хи-квадрат с поправкой максимального правдоподобия, двусторонний точный критерий Фишера, или Z-критерий с поправкой для концевых точек (в случае сравнения 0% или 100%), которые позволяли определить, насколько независимо было распределение показателей в группах. При анализе факторов, влияющих на фертильность у женщин, был рассчитан относительный риск заболевания с указанием 95% доверительного интервала (95% ДИ).
Результаты
Социально-демографические и клинико-анамнестические данные пациенток обеих групп представлены в таблице 1.
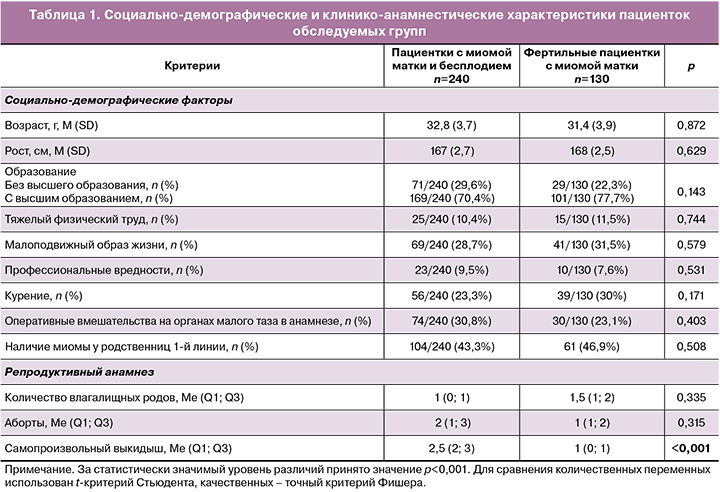
Как следует из представленных данных, пациентки обеих групп не различались по возрасту. У каждой второй пациентки в обеих группах выявляли отягощенный семейный анамнез по ММ. Подавляющее большинство пациенток обеих групп имели высшее образование, отсутствие профессиональных вредностей и вели активный образ жизни. Частота курения статистически значимо не различалась в обеих группах и составила 56/240 (23,3%) и 39/130 (30%) пациенток соответственно.
Количество самопроизвольных выкидышей в анамнезе статистически значимо чаще регистрировалось в группе пациенток с ММ и бесплодием – 2,5 (2; 3) против 1 (0; 1) в группе женщин с ММ и без бесплодия (p<0,001).
В соответствии с поставленными задачами проведен анализ коморбидности пациенток обследуемых групп. Данные представлены в таблице 2.
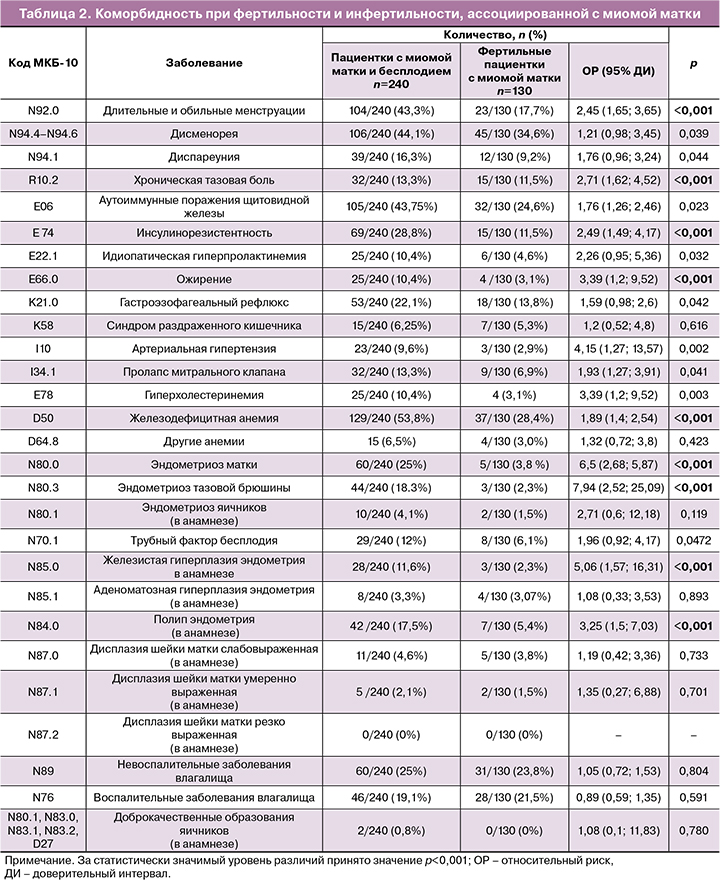
Сравнительный анализ данных показал, что эндокринная патология (ожирение, инсулинорезистентность, аутоиммунные поражения щитовидной железы и гиперпролактинемия) более чем в 2 раза чаще встречались в основной группе женщин с ММ и бесплодием в сравнении с фертильными пациентками группы с ММ.
Сильную взаимосвязь с инфертильностью у пациенток с ММ показала также хроническая тазовая боль. Эндометриоз матки диагностировали в 6 раз чаще у пациенток с ММ и бесплодием в сравнении с фертильными женщинами с ММ. Статистически значимо чаще при бесплодии и ММ также верифицированы пролиферативные заболевания женской репродуктивной системы (гиперплазия/полип эндометрия и эндометриоз тазовой брюшины).
Обсуждение
Настоящее исследование впервые продемонстрировало наличие саплементарных факторов, ассоциированных с бесплодием, при интрамуральной ММ. К ним относятся: симптомность миомы (длительные и обильные менструации, хроническая тазовая боль), самопроизвольные выкидыши в анамнезе, железодефицитная анемия, ряд эндокринных заболеваний (инсулинорезистентность, ожирение), а также сочетание ММ с пролиферативными заболеваниями репродуктивной системы (гиперпластические процессы/полип эндометрия, эндометриоз матки и тазовой брюшины).
Проведенное исследование показало, что в отсутствие деформации полости матки при ММ женщина может быть как фертильной, так и инфертильной; при этом из исследования были исключены пациентки с низким овариальным резервом, а также сопутствующими факторами бесплодия (мужской, эндокринный и трубно-перитонеальный на момент исследования).
Анализ полученных данных, а также попытка их систематизировать привели к формулировке следующей концепции. На сегодняшний день известно, что значительное количество иммунологических, неопластических, инфекционных заболеваний и даже развитие атеросклероза связаны с патологическим воспалительным процессом, способствующим «вечному» повреждению тканей, что приводит к формированию хронических заболеваний [11]. Рядом исследователей доказано, что хронический воспалительный процесс играет существенную роль в формировании доброкачественных заболеваний женской половой сферы, в том числе ММ [12]. Получены данные о том, что при ММ повышено количество CD68+ макрофагов в сравнении с неизмененным миометрием, что подтверждает роль локального воспаления при данном заболевании [13, 14]. Системные проявления воспаления также доказаны при миоме: установлено повышение содержания фактора некроза опухоли в сыворотке крови, в том числе зависимое от размеров опухоли [15]. На сегодняшний день, к сожалению, неясно, где и как развивается патологическое воспаление, на системном или локальном уровне, либо формируется параллельно [16]. Подобные провоспалительные изменения доказаны и при эндометриозе [17].
Рядом авторов показано также наличие хронического воспалительного процесса в жировой ткани у пациенток с ожирением [18]. Полученные нами данные свидетельствуют о том, что заболевания и состояния, имеющие в составе своего патогенеза воспалительный компонент, такие как ожирение и инсулинорезистентность, аденомиоз, меноррагия и диспареуния, самопроизвольные выкидыши в анамнезе, ассоциированы с бесплодием при интрамуральной ММ.
Известно, что повышенный индекс массы тела сам по себе ассоциирован с увеличением вероятности гинекологических заболеваний, в том числе ММ [19]. Повышение содержания лептина доказано при ММ, эндометриозе и артериальной гипертензии [20]. Известно также, что сам по себе лептин нарушает стероидогенез и непосредственно влияет на качество эмбриона, снижая, таким образом, вероятность имплантации [21]. Возникает «замкнутый» порочный круг, где все изменения взаимосвязаны и до бесконечности влияют друг на друга, поддерживая патологический процесс.
Результаты исследования выявили увеличение частоты артериальной гипертензии у пациенток с инфертильностью при интрамуральной ММ в сравнении с контрольной группой (в 3 раза). С другой стороны, при наличии гипертензивных расстройств повышена вероятность формирования миомы [22]. Более того, полиморфизм генов, регулирующих тонус сосудов и артериальный кровоток посредством ангиотензин-превращающего фермента и ангиотензинового рецептора, также ассоциирован с наличием фибромиомы [23]. C одной стороны, известно, что гипертензия способствует повреждению гладкомышечных клеток посредством механического стресса, включающего кровоснабжение миометрия, индуцируя пролиферацию и рост миоматозных узлов. С другой, локально повышенное кровяное давление индуцирует провоспалительный сдвиг и дисрегулирует синтез экстрацеллюлярного матрикса [24].
В 1983 г. Walters C.A. et al. было показано, что пролактин экспрессируется эндометрием и миометрием при ММ [25]. Современными исследователями подтвержден ряд случаев гиперпролактинемии при ММ, содержание пролактина снижалось после миомэктомии [26]. Известно также, что содержание пролактина в сыворотке крови коррелирует с размерами миомы [27]. Однако настоящее исследование не выявило статистически значимых отличий наличия гиперпролактинемии, не ассоциированной с макро- или микроаденомой гипофиза, между группами.
В ключе выявленного в настоящем исследовании статистически значимого увеличения сочетания пролиферативных заболеваний женской половой сферы с бесплодием при ММ уместно упомянуть также хорошо изученный ядерный антиген пролиферирующих клеток – белок и протеом, определяющий жизненные процессы внутри клетки. Доказано, что его повышенная экспрессия ассоциирована с ММ, эндометриозом, гиперпластическими процессами эндометрия и бесплодием [28].
Не исключено, что общая нестабильность генома и нарушения в одних и тех же генах способствуют формированию особого паттерна изменений в макроорганизме, выражающегося в развитии комплекса саплемент-факторов при ММ, и приводит к формированию такого симптома, как бесплодие.
Заключение
Проведенное исследование позволило выявить комплекс саплемент-факторов при интрамуральной ММ, ассоциированных с инфертильностью. По всей вероятности, выявленные сочетанные гинекологические и экстрагенитальные патологические изменения при интрамуральной ММ могут быть классифицированы как факторы риска инфертильности при данном заболевании. Вклад каждого из факторов в генез бесплодия при ММ еще предстоит уточнить.



