Согласно международной классификации нарушение менструального цикла, проявляющееся в болезненных менструациях, обозначается как «дисменорея». В переводе с греческого языка это дословно означает «затрудненное менструальное истечение». В отечественной литературе нередко и до настоящего времени используются устаревшие синонимы «альгодисменорея» или «альгоменорея».
Дисменорея представляет собой циклический патологический процесс, при котором в дни менструации появляются выраженные боли внизу живота, что сопровождается комплексом вегетативных, обменно-эндокринных, эмоционально-психических симптомов. Болевой синдром сопровождается развитием вегетативных и вегетативно-сосудистых реакций. Иногда ведущим симптомом может быть одна из вышеперечисленных жалоб, которая беспокоит больную больше, чем боль. Сильная боль истощает нервную систему, способствует развитию астенического состояния, снижает память и работоспособность [1, 2].
Дисменорея является одной из значимых проблем не только с медицинской, но и с социальной точки зрения: болевой синдром – частая причина временного снижения трудоспособности в женской популяции. По данным разных авторов, дисменорея встречается у 8–80% менструирующих женщин [1–3]. По данным литературы, около 30–50% женщин детородного возраста страдают от дисменореи, при этом от 10 до 15% женщин каждый месяц в течение 1–3 дней нетрудоспособны [4]. Частота и структура дисменореи зависят от возраста. Среди подростков от 10 до 20 лет первичная дисменорея встречается, по разным данным, с частотой 43–90%, причем частота повышается с гинекологическим возрастом и достигает пика на 5-м году после менархе. Менструальная боль обычно сохраняется в возрасте 20–24 лет, а исчезает после родов либо постепенно уменьшается с течением времени у женщин старше 25 лет. В репродуктивном возрасте дисменорея чаще является результатом приобретенных заболеваний органов малого таза и встречается практически у каждой третьей женщины.
Дисменорея подразделяется на первичную I) спазматическая функциональная) и вторичную II) (органическая).
Первичная дисменорея – это патологический, циклически повторяющийся синдром, характеризующийся болезненностью в гипогастральных отделах во время менструации при отсутствии патологических изменений со стороны половых органов. Первичная дисменорея широко распространена, возможно, она встречается больше чем у 50% женщин и бывает тяжелой приблизительно у 5–15% женщин. В противоположность этому при вторичной дисменорее боли являются следствием каких-либо заболеваний органов малого таза [3].
Этиология и патогенез тяжелой тазовой боли в отсутствие органического субстрата оставалась загадкой вплоть до второй половины XX века. В 950-х гг. была предложена концепция о дисменорее как о результате изменения активности процесса отторжения эндометрия. Вскоре были выделены и идентифицированы простагландины Е2 и F2a. Высокий уровень этих веществ в менструальной крови, эндометрии, миометрии и системном кровотоке либо же увеличение соотношения ПГF2а/ПГЕ2 обнаруживаются у женщин с дисменореей [5, 6]. Вместе с лейкотриенами простагландины относятся к классу эйкосаноидов и являются производными арахидоновой кислоты. Простагландины известны как мощные стимуляторы сократительной деятельности миометрия. ПГF2a обладает при этом свойствами вазоконстриктора, а ПГЕ2 – вазодилататора. При высоком уровне простагландинов увеличивается сократительная активность матки, а изменение соотношения их фракций приводит к сосудистому спазму и локальной ишемии. В итоге возникает гипоксия клеток, накопление биологически активных веществ, сенсибилизация нервных окончаний к действию брадикининов и других медиаторов воспаления, боль. Снятие спазма разрывает данный порочный круг, тем самым способствуя устранению боли [7] (рисунок).
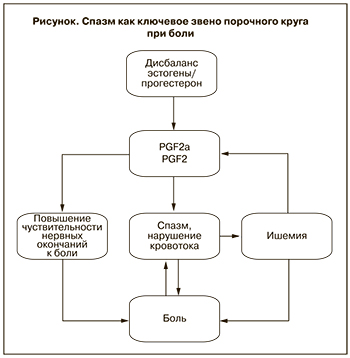 У пациенток с дисменореей внутриматочное давление, амплитуда и частота маточных сокращений в 2–2,5 раза превышают соответствующие показатели здоровых женщин [8, 9]. Простагландины и лейкотриены сами не способны вызывать болевой импульс, но они потенцируют эффекты истинных медиаторов боли. Таким образом, боль при дисменорее имеет двоякое происхождение: она возникает в результате маточных сокращений и вторичной ишемии, а также в результате повышения чувствительности тканей к медиаторам боли.
У пациенток с дисменореей внутриматочное давление, амплитуда и частота маточных сокращений в 2–2,5 раза превышают соответствующие показатели здоровых женщин [8, 9]. Простагландины и лейкотриены сами не способны вызывать болевой импульс, но они потенцируют эффекты истинных медиаторов боли. Таким образом, боль при дисменорее имеет двоякое происхождение: она возникает в результате маточных сокращений и вторичной ишемии, а также в результате повышения чувствительности тканей к медиаторам боли.
Установлено также, что снижение синтеза прогестерона желтым телом приводит к разрушению лизосом эндометриальных клеток и высвобождению фосфолипазы А2 [10]. Таким образом, очевидно, что высокая концентрация прогестерона в нормальном менструальном цикле является одним из факторов, препятствующих гиперпродукции простагландинов и формированию дисменореи.
Важную этиологическую роль в гиперактивности миометрия играет гормон задней доли гипофиза – вазопрессин. Ряд исследований свидетельствует об увеличении уровня вазопрессина в перименструальный период у женщин с дисменореей. Нарушение соотношения окситоцин/вазопрессин может привести к дисритмии маточных сокращений. Наконец, в последнее время появляются публикации, в которых дисменорея рассматривается как проявление дисморфизма соединительной ткани, часто связанного с врожденным или приобретенным дефицитом внутриклеточного магния [11].
Таким образом, патогенез боли при первичной дисменорее в своей основе имеет гиперпродукцию простагландинов с возможным нарушением их соотношения. Увеличению секреции простагландинов способствует недостаточность концентрации прогестерона в лютеиновую фазу менструального цикла. Формирование болевого синдрома завершается при участии вегетативной нервной системы, вносящей свой вклад в разнообразие симптоматики сопутствующих жалоб. Дополнительные факторы развития дисменореи в настоящее время активно изучаются.
Вторичная дисменорея – результат органической патологии органов малого таза – имеет, тем не менее, много общих патогенетических черт с дисменореей первичной. Прежде всего, следует подчеркнуть, что генез боли и формирование болевого синдрома проходят одинаковый патофизиологический путь вне зависимости от наличия или отсутствия органического субстрата.
Возможными причинами вторичной дисменореи могут оказаться: наружный генитальный эндометриоз, воспалительные заболевания внутренних половых органов, кисты яичников, внутриматочная контрацепция, пороки развития матки и влагалища, стеноз шейки матки, миома матки, полипы эндометрия или эндоцервикса, аденомиоз, варикоз тазовых вен [12].
Основные принципы лечения дисменореи – это фармакотерапия, направленная на нормализацию менструального цикла и снижение уровня простагландинов. При этом лечение должно быть строго индивидуализировано в зависимости от выявленных особенностей женского организма (характер боли, необходимость контрацепции, характер экстрагенитальных заболеваний) и эффективности предшествующей терапии.
Для уточнения диагноза рекомендуется проводить пробу с нестероидными противовоспалительными средствами (НПВС). С целью проведения пробы чаще всего используется диклофенак в дозе 50 мг 3 раза в день в течение 5 дней. Быстрое снижение выраженности боли после приема препарата с сохранением положительного эффекта в последующие дни наблюдается у больных с первичной дисменореей. Сохранение болей, несмотря на продолжающийся прием препарата, с ослаблением их интенсивности к 5-му дню пробы характерно для пациенток с эндометриозом. Если после приема первой таблетки выраженность болей уменьшается, но при дальнейшем выполнении пробы сохраняется на том же уровне, можно предположить воспалительный процесс гениталий. Отсутствие динамики болевых ощущений на протяжении всей пробы встречается при пороках гениталий, а также при хронических психосоматических нарушениях.
НПВС считаются патогенетически оправданным вариантом терапии больных с первичной дисменореей. Блокируя синтез простагландинов, препараты действуют на основной механизм возникновения боли. Эффективность НПВС составляет 77–80% [9, 11]. В качестве вспомогательного метода лечения НПВС могут применяться при воспалительных заболеваниях органов малого таза. В последнее время рекомендуется использование нимесулида – селективного блокатора циклооксегеназы-2, позволяющего избежать большинства побочных эффектов неселективных НПВС. Дозировки и кратность приема зависят от выбора препарата. НПВС назначаются за 2–3 дня до появления болезненных симптомов (профилактическая схема) либо при появлении болей (симптоматическая схема). Длительность приема препарата с целью лечения дисменореи обычно не превышает 7 дней. Необходимо учитывать противопоказания и побочные действия НПВС. Принимая во внимание, что профилактическая и симптоматическая терапия используется в каждом менструальном цикле, НПВС принимают в среднем 50 дней в год. Необходимо контролировать прием этой группы препаратов, а сочетание с другими препаратами или их замена позволит, не увеличивая дозу, повысить эффективность лечения.
Для лечения первичной дисменореи чаще всего используют спазмолитики (но-шпа), блокаторы кальциевых каналов, неспецифические анальгетики, аналоги гонадотропин-рилизинг-гормонов, проводят коррекцию магниевого дефицита препаратами магния (магне В6 и магне В6 форте).
Препараты, относящиеся к группе спазмолитиков, являются одними из самых востребованных и назначаемых врачами различных специальностей. Дисфункция гладкомышечных клеток внутренних органов лежит в основе как хронического, так и острого болевого синдрома, при различных заболеваниях органов пищеварения, мочевыводящей системы органов малого таза [1, 2]. Наиболее частой причиной развития боли при патологии внутренних органов, имеющих слой гладкомышечных клеток, является их избыточное сокращение. Симптомы спастической дисфункции органов пищеварения встречаются в 30% случаев при отсутствии органического поражения желудка или кишечника, что обусловливает частое самостоятельное (без врачебного назначения) применение спазмолитических препаратов. Широкое применение препаратов этой группы диктует необходимость постоянно напоминать об их клинической фармакологии, особенно свойствах и переносимости, во избежание как недооценки, так и переоценки лечебных возможностей.
В целом, абдоминальная боль в большинстве случаев бывает вызвана спазмом гладкой мускулатуры. Важно, что, ликвидируя или предотвращая спазмы гладкой мускулатуры, спазмолитики хотя и оказывают выраженное анальгетическое действие, нормализуя функционирование органа, но при этом не вмешиваются в механизмы боли. В отличие от ненаркотических и опиоидных анальгетиков они не представляют существенной угрозы «стирания» симптоматики при тяжелом органическом поражении (маскирование картины и затруднение в верификации диагноза).
Процесс сокращения мышечной клетки определяется концентрацией ионов кальция в ее цитоплазме, попадающих из внеклеточного пространства через кальциевые (медленные) каналы клеточных мембран. Другой источник кальция – внутриклеточные депо, в большей степени представленные в гладкой мускулатуре толстой кишки и значительно меньше – в тонкой кишке, в том числе 12-перстной. Высвобождение этой фракции ионов кальция приводит к фазовому сокращению мышечной клетки [3]. Одним из наиболее распространенных медиаторов, влияющих на процесс мышечного сокращения, является ацетилхолин. При его взаимодействии с мускариновыми холинорецепторами (М-холинорецепторами) происходит открытие натриевых каналов, вход ионов натрия в клетку и, как следствие, деполяризация мембраны. Деполяризация, в свою очередь, приводит к открытию кальциевых каналов и поступлению кальция внутрь клетки, повышению его внутриклеточной концентрации и мышечному сокращению. Активация ацетилхолином М-холинорецепторов приводит к повышению тонуса, сокращению гладкомышечной клетки, а блокада – к снижению тонуса и расслаблению гладкомышечной клетки, что лежит в основе назначения в качестве спазмолитиков М-холиноблокаторов [4, 5].
Описанные выше механизмы регуляции концентрации кальция внутри мышечной клетки, которые нарушаются при патологических условиях и приводят к спазму гладкомышечных клеток внутренних органов, подразумевают наличие нескольких мишеней фармакологического воздействия [7, 8, 13]: блокада нейротропного воздействия, то есть блокирование эффекта ацетилхолина на М-холинорецептор (атропин, гиосцина бутилбромид); торможение активности ФДЭ IV (дротаверин (но-шпа)); блокада входа ионов кальция (блокаторы кальциевых каналов); блокада выхода кальция из внутриклеточных депо (мебеверин).
Ингибиторы фосфодиэстеразы (иФДЭ). На подавлении активности ФДЭ IV основан эффект традиционных широко применяемых спазмолитиков, таких как дротаверин (но-шпа). Таким образом, одним из необходимых условий сокращения мышечного волокна является высокая активность ФДЭ, а для расслабления, наоборот, нужна ее низкая активность. По данным экспериментальных исследований установлено около 7 различных семейств ФДЭ. Гидролиз цАМФ в клетках гладких мышц внутренних органов (матки, желудочно-кишечного тракта (ЖКТ), желчевыводящих путей, мочеточников, сосудов), а также в клетках других тканей (секреторные клетки, центральная нервная система и др.) происходит главным образом при помощи фермента ФДЭ IV типа. Механизм выраженного спазмолитического действия препарата реализуется за счет селективного ингибирования фосфодиэстеразы IV. Но-шпа снимает причину боли – спазм, тем самым устраняет боль, вызванную спазмом [7].
Но-шпа, наряду со спазмолитическим действием на гладкую мускулатуру матки, обладает и сосудорасширяющим эффектом, улучшает кровоснабжение тканей, устраняет ишемию, что в целом способствует купированию боли при дисменорее. Важно и то, что избирательность действия ингибиторов ФДЭ отражается в реализации системных эффектов, в частности со стороны сердечно-сосудистой системы. В кардиомиоцитах и гладкомышечных клетках сосудов представлена преимущественно ФДЭ III типа. Ингибирование этого изофермента повышает уровень цАМФ и внутриклеточной концентрации Са2+ в миокардиоцитах, что вызывает ряд электрофизиологических эффектов, включая положительный инотропный эффект, и может быть причиной развития аритмий. В отличие от других ингибиторов ФДЭ (папаверина), селективность препарата но-шпа в отношении ФДЭ IV минимизирует кардиоваскулярный эффект. Серьезных побочных эффектов, связанных с применением препарата, в проведенных исследованиях не выявлено. Общая частота побочных эффектов в соответствии с классификацией Всемирной организации здравоохранения не превышает 0,9% [14].
По сравнению с НПВС препарат имеет меньше противопоказаний и лекарственных взаимодействий, а выраженность его спазмолитического эффекта на гладкую мускулатуру матки превосходит другие спазмолитические препараты [9]. Поскольку ФДЭ IV представлена в гладкомышечных клетках по всей длине кишечника, желче- и мочевыводящих путей, то ее блокада дротаверином (но-шпа) оказывает универсальное спазмолитическое действие независимо от степени контракции или причины, ее вызвавшей. Дротаверин, в отличие от гиосцина бутилбромида и других миотропных спазмолитиков, обладает противоотечным и антивоспалительным эффектами (ФДЭ IV типа активно участвует в процессе развития воспаления). Терапевтическая концентрация дротаверина в плазме при приеме внутрь наблюдается в течение 45 мин. После однократного перорального приема 80 мг максимальная концентрация в плазме достигается через 2 часа, а биодоступность при приеме внутрь составляет 60%. Препарат хорошо проникает в различные ткани, метаболизируется (окисляется) почти полностью до монофенольных соединений, метаболиты быстро конъюгируются с глюкуроновой кислотой. Период полувыведения составляет 16 часов. Около 60% дротаверина при пероральном приеме выделяется через ЖКТ и до 25% с мочой. Наличие лекарственной формы как для энтерального, так и парентерального введения делает возможным широкое использование препарата при различной степени выраженности боли.
В связи с этим ряд исследований проводился с целью изучения эффективности и безопасности дротаверина (но-шпа) в лечении дисменореи. В 4-летнем проспективном исследовании оценивалась эффективность использования дротаверина у 1400 пациенток с гинекологическими заболеваниями (нарушениями менструаций, воспалением органов гениталий, овуляционной болью и др.), в том числе у 175 женщин с дисменореей.
Препарат но-шпа применялся в виде инъекций или перорально в дозе 120 мг/сут. Эффективность препарата но-шпа у больных дисменореей была отмечена в 57,1% наблюдений [8, 13]. Суммарная эффективность препарата при различных гинекологических заболеваниях составила 81%. Следует отметить, что суточная доза препарата может составлять 240 мг.
В ретроспективном исследовании изучалась эффективность спазмолитического действия препарата но-шпа у 358 женщин с заболеваниями репродуктивной системы (главным образом дисменореей) [11, 12]. Препарат вводили внутримышечно или внутривенно в дозах 40 мг (65%) и 80 мг (29%). У 85% больных отмечено полное купирование боли, у 10% – частичное; у 85% пациенток эффект отмечался в течение 30 мин.
В многоцентровом рандомизированном двойном слепом исследовании в двух параллельных группах (протокол DOROTA) проведено сравнение эффективности и переносимости 80 мг препарата но-шпа и 400 мг ибупрофена у 345 женщин с дисменореей, сопровождающейся сильными и умеренными болями. Оба препарата показали свою эффективность. Суммарное снижение выраженности боли за 6-часовой период составило: -1,2±-1,18 на приеме но-шпа, -1,7±-0,99 на приеме ибупрофена.
В период с 1964 по 1998 гг. было проведено 37 клинических исследований при участии 12 111 пациентов, пролеченных но-шпа, с частотой встречаемости нежелательных явлений в соответствии с классификацией ВОЗ лишь 0,9% [11]. Серьезных побочных эффектов, связанных с применением но-шпа, не было выявлено. Соотношение польза/риск при лечении препаратом но-шпа благоприятно. Анализ данных клинических исследований показал, что но-шпа может быть рекомендована как эффективный и безопасный препарат для комплексной терапии первичной дисменореи, особенно при сочетании данного заболевания с патологией ЖКТ (колит) и желчевыводящих путей, распространенность которых среди пациенток с дисменореей составляет около 40% [9]. Рекомендуется назначение препарата по следующей схеме: по 120–240 мг в сутки (3 таблетки препарата но-шпа форте по 80 мг), разделенных на 2–3 приема.
Патогенетически оправданным вариантом лечения дисменореи также является гормонотерапия. С целью лечения дисменореи гормонотерапия применяется в двух видах: комбинированные оральные контрацептивы (КОК) и прогестагены. Преимущества КОК очевидны, если женщина преследует цель предохранения от беременности. Если же такая цель не стоит, то препаратами выбора становятся производные прогестерона. Механизм действия комбинированных оральных контрацептивов и гестагенов при дисменорее заключается в том, что они снижают концентрацию эстрогенов, снижают митотическую активность клеток и их количество, препятствуют пролиферации эндометрия, вызывают секреторную трансформацию эндометрия, снижают локальный уровень простагландинов в эндометрии, снижают сократительную активность миометрия. Под влиянием прогестерона снижается выработка простагландинов не только в эндометрии, но и в структурах центральной нервной системы и других тканях. Тормозящее действие прогестерона на сократительную активность миометрия обусловливает уменьшение или исчезновение болезненных маточных сокращений. Дополнительным фактором является нормализующее действие прогестерона на тонус вегетативной нервной системы. В настоящее время существуют две большие группы гестагенов, используемых в гинекологии: производные прогестерона и 19-нортестостерона [10]. Натуральный прогестерон малоэффективен при пероральном приеме, так как быстро разрушается при прохождении через желудочно-кишечный тракт. Аналог прогестерона – дидрогестерон – является структурным ретроизомером натурального прогестерона; препарат применяется перорально. Производные 19-нортестостерона являются сильными гестагенами, но при этом обладают в разной степени выраженной андрогенной, эстрогенной, анаболической активностью. Однако не следует забывать, что все гормональные препараты обладают целым рядом побочных эффектов и противопоказаний. Следует взвесить оправданность назначения гормональной терапии, если выраженность дисменореи незначительна, а продолжительность невелика (например, 1–2 дня).
Учитывая, что при проведении плацебо-контролируемых исследований некоторые больные чувствовали улучшение на фоне плацебо, что указывает на участие корковой регуляции в данном процессе, по-видимому, имеет смысл назначать многокомпонентное лечение. В частности, витамин B6, который нормализует корково-гипоталамические взаимоотношения. Витамин B6 назначают по 50–100 мг перорально в течение 3–4 мес ежедневно, во время менструации дозу увеличивают до 200 мг [10].
Эффективна и психотерапия, воздействующая на реактивный компонент боли. Поскольку дисменорею можно рассматривать как эмоционально-болевой стресс, патогенетически оправдано в целях уменьшения боли применять антиоксиданты, в частности, витамин Е по 150–200 мг в сутки перорально, за 3–4 дня до менструации.
Весьма важно в лечении дисменореи использование природных и физических факторов. При генитальном эндометриозе используется сочетанный электрофорез йода и магния (предпочтительнее диадинамическими и синусоидальными модулированными токами), радонотерапия. При тазовом перитонеальном процессе могут быть назначены ультразвуковая физиотерапия, грязелечение. При первичной дисменорее, появившейся вскоре после менархе, рекомендуется диадинамотермия, гальванизация зоны «воротника» по Щербаку, эндоназальная гальванизация и ароматические ванны. Все вышеуказанные методы назначаются курсами по 2–3 цикла, начиная с первого дня менструации на протяжении 5–7 дней.
Таким образом, подбирая лечение отдельно взятой пациентке с дисменореей, врач должен руководствоваться индивидуальными особенностями протекания менструального цикла у данной больной, выраженностью и продолжительностью болей, фактами наличия или отсутствия сопутствующих гинекологических заболеваний, психоэмоционального состояния пациентки. Лечение должно быть направлено на патогенез заболевания и улучшать качество жизни пациенток.



