Клиническое наблюдение
Доношенный мальчик у женщины К. 28 лет от 1 беременности, наступившей самопроизвольно
Особенности течения беременности, I триместр: ОРВИ в 4–5 нед, без повышения температуры (виферон); II триместр – без особенностей; III триместр – в 28–29 нед в связи с пищевым отравлением госпитализирована в ГКБ г. Москвы (лечение симптоматическое, этиология отравления не установлена); на 31 нед – низкая плацентация, многоводие; у плода: гепатомегалия, кардиомегалия, кардиомипатия (на фоне отравления нитритами?), направлена в НМИЦ АГиП им. В.И. Кулакова.
Родоразрешение в сроке 39 нед (к/с), родился живой доношенный мальчик с массой тела 2830 г, с оценкой по шкале Апгар 8–9 баллов.
Реанимационных мероприятий при рождений не потребовал, транспортирован в ОХРИТН (Р) для дальнейшего наблюдения, обследования и лечения.
Состояние ребенка после рождения (первые сутки жизни)
Ребенок находится в ОХРИТН (Р) под интенсивным наблюдении на самостоятельном дыхании.
Клинико-лабораторные маркеры инфекции – отрицательные.
НСГ – без патологии; УЗИ органов брюшной полости и почек – небольшое увеличение печени.
ЭХО-КГ – данных за ВПС нет, отмечается дилатация всех полостей сердца, снижение сократительно способности миокарда (ФВ ЛЖ 47%), повышенная трабекулярность миокарда желудочков, сепарация листков перикарда на верхушке, подчеркнутость эндокарда левого желудочка.
Через 3,5 ч после рождения – резкое ухудшение состояния – появление и нарастание дыхательной недостаточности на фоне легочно-гипертензионного криза, ИВЛ с дотацией до О2 до 100%; кардиопатическая терапия – допамин, добутрекс, симдакс, адреналин; дотация оксида азота ингаляционно, таргетная терапия легочной гипертензии.
Учитывая прогрессивное ухудшение состояния ребенка после рождения, наличие у ребенка признаков дилатационной кардиомиопатии, была начата клеточная терапия (в/в+п/к инъекции).
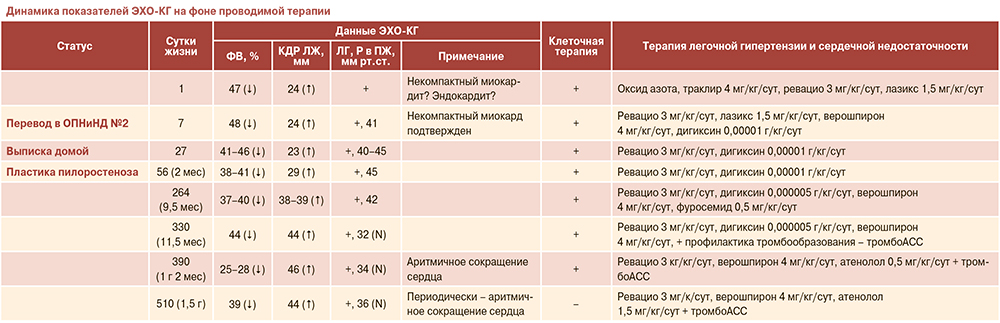
Дальнейшее наблюдение
Подобрана базовая терапия сердечной недостаточности и легочной гипертензии (верошпирон, лазикс, дигоксин, траклир, ревацио).
На фоне проводимой терапии к 4 с.ж. ребенок на самостоятельном дыхании, без кардиотонической терапии.
На 7 с.ж. – повторное проведение клеточной терапии (в/в+п/к инъекции) – фетальные кардиомиоциты и мезенхимальные мультипотентные стромальные стволовые клетки.
На 10 с.ж. в стабильном состоянии ребенок переведен в ОПНиНД №2 для дальнейшего наблюдения, обследования и терапии.
Диагностический генетический поиск (MYH7, MYBPC3, TPM1, TNNT2, TNNI3, TAZ, MYL2, MYL3, ACTC1, LDB3 (ZASP), LMNA, DTNA, DES)
Молекулярное кариотипирование на ДНК-микроматрицах: arr(1-22 )x2,(XY)x (XY)x1 – нормальный мужской генотип, анеуплодии не выявлены. Патогенных микроделеций не обнаружено.
Дилатационная кардиомиопатия (ДКМП) – заболевание миокарда, характеризующееся увеличением полостей сердца и нарушении функции левого или обоих желудочков.
Этиология: генетическая, иммунная, постмиокардитная, идиопатическая.
Распространенность: от 0,65 до 1,24:100 000 живорожденных.
Прогноз: 63% плодов и новорожденных с ДКМП погибают в перинатальном периоде, около 40% выживших детей умирают в течение 2 лет, в перспективе – необходимость трансплантации сердца.
NB! – донорство детских органов в РФ запрещено.Некомпактный миокард – орфанное врожденное генетически гетерогенное заболевание, характеризующееся выраженной туберкулезностью и глубокими межтрабекулярными полостями в толще миокарда желудочков.
Этиология: генетическая, идиопатическая; формируется на 5–8 нед гестации при прекращении превращения миокарда из свободно лежащей трабекулярной сети в компактную форму.
Распространенность: от 0,05 до 0,24% живорожденных, 7:7 000 новорожденных.
Генетическая предрасположенность: семейные случаи – в 60% случаев,
в 20% – наличие гена.
Прогноз: летальность на 1 году жизни на фоне прогрессирующей сердечной недостаточности стремится к 60%; в перспективе – необходимость трансплантации сердца.
NB! – донорство детских органов в РФ запрещено.
Высокопроизводительное секвенирование экзома (прямое секвенирование по Сэнгеры): обнаружены замены неясной клинической значимости:
- В гене FLNC NM_001458 4c 3933G>A (n766127245) в гетерозиготном состоянии, которая приводит к замене аминокислоты pAlu1979Thr – обнаружена у ребенка и матери. Описана в базах данных как крайне редкая без указания на ее клиническую значимость. Мутации в гене FLNC ассоциируются с аутосомно-доминантной ДКМП. Однако наличие замены у здоровой матери и больного ребенка не подтверждает и не исключает связь между заменой в гене FLNC и ДКМП у ребенка;
- В гене CLCN1 NM_0000836:2:с.501С>G (n149729531) в гетерозиготном состоянии, которая приводит к замене аминокислоты рPhe167Leu – обнаружена у ребенка и у отца. Описана в базах данных как крайне редкая с различной интерпретацией, вероятно, патогенная, с неясной клинической значимостью. Мутации в гене CLCN1 ассоциируются с миотонией, в клиническую картину (отличающуюся от таковой у пациента) иногда входит в ДКМП. Данная замена оценивается как неясной клинической значимости;
- В гене RYR1 NM_000540.2:е:2933С>Т (n200124278) в гетерозиготном состоянии, которая приводит к замене аминокислоты рPro978Leu – обнаружена у ребенка и у матери. Описана в базах данных как крайне редкая без указания на ее клиническую значимость. Мутации в гене RYR1 ассоциируются с рядом нервно-мышечных заболеваний, в клиническую картину (отличающуюся от таковой у пациента) у которых иногда входит ДКМП. Данная замена оценивается как неясной клинической значимости.
Выводы
Традиционная терапия сердечной недостаточности в сочетании с новейшими технологиями (клеточной терапией) позволяет не только стабилизировать состояние ребенка с ДКМП, достичь клинической ремиссии, но и обеспечивает полноценный рост и развитие ребенка.
В случаях манифестации ДКМП в раннем неонатальном периоде своевременно начатая таргетная терапия позволяет отдалить срок трансплантации сердца.
Дальнейшие исследования необходимы для определения возможности и объема таргетного терапевтического вмешательства у плода.



