1. Методология
 Доказательной базой для рекомендаций служат публикации, вошедшие в базы данных PubMed и Cochrane. Для оценки качества и силы доказательств использовались рейтинговые схемы (табл. 1a и 1b).
Доказательной базой для рекомендаций служат публикации, вошедшие в базы данных PubMed и Cochrane. Для оценки качества и силы доказательств использовались рейтинговые схемы (табл. 1a и 1b).
Код МКБ-10 О26.6
Поражение печени во время беременности, родов и в послеродовый период
2. Определение внутрипеченочного холестаза беременных (ВХБ)
Внутрипеченочный холестаз беременных (ВХБ) – это холестатическое заболевание печени, характерное только для беременности, проявляющееся появлением кожного зуда и повышением уровня общих желчных кислот в крови. ВХБ развивается в конце второго или в начале третьего триместра беременности и спонтанно прекращается через 4–6 недель после родов [4, 8, 11].
Клиническое значение ВХБ заключается в потенциальном риске для плода (спонтанные или ятрогенные преждевременные роды, асфиксия во время родов, антенатальная гибель плода) [11, 28, 34]. По данным ряда последних исследований, уровень перинатальной смертности (9/1000) сопоставим с таковым среди общей популяции, что, возможно, связано с совершенствованием тактики ведения беременности [10]. Зуд, особенно сильный по ночам, влияет на качество жизни матери [7, 8].
3. Эпидемиология
Распространенность ВХБ варьирует в широких пределах от 0,1 до 27% в зависимости от расы и этнической принадлежности, являясь второй по частоте причиной желтухи у беременных (после вирусного гепатита) [10]. Наиболее часто эта патология встречается на Кавказе (до 27,6%), в Чили и Боливии (15,1%), в скандинавских странах (2,8%) [13].
В странах Европы, Азии, Северной и Южной Америки, Австралии распространенность составляет менее 1% [7, 8]. Были отмечены сезонные колебания в виде увеличения частоты встречаемости ВХБ в Швеции, Финляндии и Чили в зимние месяцы [13]. Это может свидетельствовать о вкладе средовых факторов в развитие заболевания [4, 17].
К факторам риска развития ВХБ относят дефицит селена, витамина D, многоплодную беременность, возраст женщины старше 35 лет [20]. Вероятность повторения ВХБ при последующих беременностях составляет 60–70% [25, 26]. Немаловажным фактором риска является наследственная предрасположенность к развитию данного заболевания [7, 8, 23, 24].

4. Этиология и патогенез
Этиология и патогенез данного заболевания носят мультифакторный характер и до конца не исследованы. В настоящее время выделяют три основные группы этиологических механизмов: генетические, гормональные, средовые [8, 23].
Генетические факторы способны объяснить семейные и этнические случаи ВХБ [23]. Гетерогенные мутации гена ABCB4, кодирующего белок множественной лекарственной резистентности 3 (MDR3), были обнаружены в семьях, женщины которых страдали от ВХБ [12, 13, 16, 18]. В европейской расе частота этих мутаций среди пациенток с ВХБ составила 16% [7, 8, 30]. С развитием данного заболевания связывают мутации и в других генах каникулярных транспортеров в гепатоцитах. Описана генетически обусловленная повышенная чувствительность гепатоцитов и билиарных канальцев к половым гормонам [4, 23, 24].
Эстрогены могут играть роль в генезе ВХБ, о чем свидетельствует развитие этого осложнения в основном в третьем триместре, когда концентрация этих гормонов в крови достигает своего пика, большая заболеваемость у женщин с многоплодной беременностью [13, 20, 27]. Также ВХБ может быть связан с изменением в метаболизме прогестерона [27]. Образование большого количества сульфатированных метаболитов прогестерона приводит к перегрузке транспортных систем гепатоцита у генетически предрасположенных женщин [8, 27].
Возможны врожденные дефекты синтеза ферментов, ответственных за транспорт компонентов желчи из гепатоцитов в желчные протоки. У беременных с ХГБ чаще обнаруживают заболевания ЖКТ и эндокринной системы [4].
Беременные с ВХБ в 93,8% случаев до беременности или во время нее применяли препараты с потенциальным гепатотоксическим эффектом (антибиотики, комбинированные пероральные контрацептивы) [31]. По данным некоторых исследований обнаружена взаимосвязь развития ВХБ с приемом препаратов прогестерона [7, 8, 31].
Предполагают связь ХГБ с хронической и острой инфекцией. У таких пациенток выявляются высокие титры IgM и IgG к ЦМВ, ВПГ, а также рецидивирующая аденовирусная инфекция [4, 10].
Реализация ВХБ происходит в результате сочетанного действия генетически обусловленных и врожденных дефектов обмена компонентов желчи, экзогенных и эндогенных факторов [7, 8]. Основными звеньями патогенеза ВХБ являются: чрезмерное поступление элементов желчи в кровь, снижение количества секретируемой желчи в кишечнике, токсическое воздействие компонентов желчи на гепатоциты и билиарные канальцы [4, 10].
ВХБ характеризуется интраглобулярным холестазом. При этом происходит снижение текучести (отсутствие пор) базолатеральных и/или каналикулярных мембран гепатоцитов, ингибирование Na+,К+-АТФазы и других мембранных переносчиков, транслокация их с билиарного на синусоидальный полюс гепатоцита, а также повреждение цитоскелета гепатоцита, нарушение целостности канальцев и их функции [4, 15].
У беременных с ВХБ обнаружены изменения синтеза стероидов плода. В частности, снижена способность печени плода к 16α-гидроксилированию ДГЭА-С с образованием неактивного метаболита – эстриола. В результате количество ДГЭА-С увеличивается и в плаценте метаболизируется по патологическому пути с образованием активного гормона эстрадиола, в результате этого увеличивается вероятность преждевременных родов [11].
При ХГБ отмечают увеличение случаев послеродового кровотечения, что связано с дефицитом витамина К при тяжелом или длительном холестазе. Адекватная абсорбция витамина К из кишечника зависит от секреции достаточного количества желчных кислот. В свою очередь синтез печенью факторов коагуляции II, VII, IX, X возможен только при достаточном содержании в тканях витамина К [8].
5. Клиническая картина
ВХБ обычно дебютирует во II–III триместрах, чаще на 30–32-й неделе беременности [7, 8, 17].
Основным симптомом ВХБ является кожный зуд (при исключении других причин). Первоначально он локализуется преимущественно на стопах и ладонях [28]. Затем кожный зуд приобретает генерализованный характер [17]. По интенсивности он может быть от легкого до «мучительного», «нестерпимого». Чаще усиливается в ночное время, приводит к бессоннице, повышенной утомляемости, эмоциональным расстройствам [4, 28].
Кожный зуд обычно появляется за некоторое время до отклонений в лабораторных показателях [10]. Болевой абдоминальный синдром, тошнота и рвота не характерны для ВХБ [13].
При объективном осмотре выявляются экскориации, желтушность склер и кожного покрова [17]. Энцефалопатия или другие стигмы печеночной недостаточности, как и гепатоспленомегалия, не характерны для ВХБ и должны наводить на мысль о других возможных заболеваниях печени [7, 8].
Повышение уровня общих желчных кислот ≥10 мкмоль/л является критерием диагностики ВХБ [12, 17, 28]. В биохимическом исследовании крови могут быть и другие отклонения, характерные для синдрома холестаза: повышение уровня 5-нуклеотидазы (не относится к рутинным исследованиям в России), общего билирубина за счет прямой фракции [17]. Важно отметить, что уровень γ-глутамилтранспептидаза (ГТП) остается в пределах нормы или незначительно повышается. Повышение уровня щелочной фосфатазы неинформативно во время беременности, так как оно обусловлено плацентарной фракцией [10].
Сывороточные аминотрансферазы могут достигать значений более 1000 Ед/л [17]. Протромбиновое время, как правило, остается в пределах нормативных значений. Его повышение может быть при дефиците витамина K [7, 8].
Отмечают умеренное повышение α- и β-глобулинов, билирубина, β-липопротеидов, холестерина, триглицеридов при умеренном снижении концентрации альбумина [10].
Желтуху относят к непостоянным симптомам. Она наблюдается в 10–15% случаев за счет конъюгированного билирубина [1].
При ультразвуковом исследовании печени при ВХБ не обнаруживаются какие-либо изменения в паренхиме органа или расширение желчных протоков при отсутствии предшествующей патологии [10].
В течение 7–14 дней после родов купируется кожный зуд, происходит нормализация лабораторных показателей [17]. Ряд авторов предлагает проводить повторные лабораторные исследования через 6–8 недель после родов, чтобы убедиться в отсутствии каких-либо изменений [11].
6. Осложнения беременности
Наибольшую опасность ВХБ представляет для плода [12, 13, 19, 28]. К основным осложнениям относят преждевременные роды, гипоксию плода и внутриутробную гибель плода, а также респираторный дистресс-синдром новорожденных [11, 19, 29, 33, 36]. Плацентарная недостаточность не характерна для этого заболевания. На долю ВХБ как причины преждевременных родов приходится 1,2% [7, 8].
Риск осложнений при ВХБ статистически увеличивается при уровне общих желчных кислот ≥40 мкмоль/л и раннем до 33 недель развитии заболевания [12, 13, 19, 29]. По данным разных исследований в группе пациенток с уровнем общих желчных кислот ≥100 мкмоль/л внутриутробная гибель плода встречалась в 10–15% случаев [7, 8, 19].
При ВХБ частота перинатальных потерь в среднем составляет 4,7% [33]. Риск смерти плода при рецидивирующем холестазе в 4 раза выше, чем при физиологической беременности [11, 19, 33].
Прогноз для матери благоприятный. ХГБ, даже при рецидивах во время последующих беременностей, не оставляет каких-либо изменений в печени матери [11].
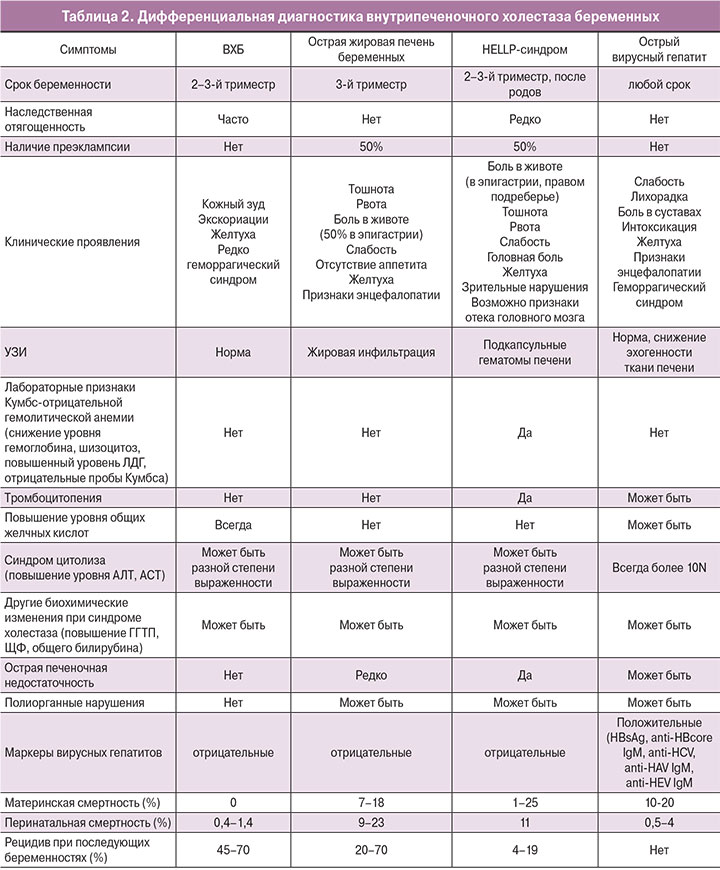
7. Дифференциальная диагностика
Во всех случаях следует проводить дифференциальную диагностику, так как ВХБ может быть диагностирован только при отсутствии других причин, которые могут вызвать поражение печени [1, 4, 5]. В первую очередь необходимо исключить заболевания, при которых высока вероятность крайне неблагоприятных исходов для матери и плода (табл. 2) [12, 13, 29].
Всем женщинам рекомендовано проведение ультразвукового исследования органов брюшной полости для исключения подпеченочной желтухи различной этиологии. Чаще всего при беременности встречается желчнокаменная болезнь [7, 8].
Кроме того, необходим тщательный сбор лекарственного анамнеза с целью исключения лекарственного поражения печени. Показана консультация дерматолога с целью исключения кожных заболеваний, которые могут проявляться зудом кожного покрова [4].
Если после родов симптоматика не разрешается в течение 6–8 недель, следует думать о других заболеваниях печени и направить женщину на консультацию к профильным специалистам [5, 17].
8. Лечение
8.1. Медикаментозная терапия
Лечение ВХБ направлено на купирование симптомов у матери и снижение частоты развития перинатальных осложнений для плода [8, 22].
Наибольшее количество доказательных данных получено в отношении урсодезоксихолевой кислоты (УДХК) [14, 17, 21, 35]. Урсодезоксихолевая кислота относится к препаратам желчных кислот [4, 9].
Этот препарат назначается в дозе 10–20 мг/кг. Суточную дозу препарата можно принимать два раза в день или однократно на ночь [9]. Применение препаратов УДХК приводит к уменьшению кожного зуда и улучшению лабораторных показателей у матери [14, 21]. Предполагается, что механизм действия данной группы препаратов связан с замещением пула гидрофобных желчных кислот в желчи [17, 37].
Это может уменьшать токсическое повреждение мембран гепатоцитов, усиливать транспорт желчных кислот от плода в плаценте [9, 21, 35]. К сожалению, в настоящее время недостаточно данных касательно профилактики неблагоприятных исходов для плода при приеме препаратов УДХК [7, 8, 22].
Ни у матерей, ни у новорожденных не зафиксировано побочных эффектов применения УДХК. Во время грудного вскармливания прием препарата не рекомендован, в то же время следует отметить, что в грудном молоке не обнаружено значительное содержание УДХК [8].
При неэффективности УДХК в стандартных дозах возможно присоединение к терапии S-аденозилметионина (SAM), который является аминокислотой [13, 37]. Однако стоит помнить, что биодоступность этого препарата при пероральном применении низкая, поэтому рекомендовано его парентеральное введение в виде внутривенных инфузий в суточной дозе 800 мг [21, 37]. Рекомендуемая начальная доза составляет 5–12 мг/кг в сутки в/в или в/м [8].
Этот препарат относится к группе гепатопротекторов. SAM расщепляет жиры и способствует выведению их из печени, принимает участие в синтезе биологически активных веществ и фосфолипидов, обладает регенерирующими и детоксикационными свойствами, как следует из аннотации к препарату. К концу 1-й недели использования проявляет также выраженное антидепрессивное действие [13].
8.2. Эфферентные методы терапии ВХБ
Показания для проведения плазмафереза у беременных с ХГБ: выраженная клиническая картина ХГБ, отсутствие стойкого клинического эффекта от традиционных медикаментозных методов терапии; значительное повышение уровня печеночных ферментов: АЛАТ, АСАТ, ЩФ; желчных кислот, холестерина, билирубина, нарушения в системе гемостаза, проявляющиеся в активации внутрисосудистого свертывания [2, 3, 6, 32].
Методы экстракорпоральной гемокоррекции в лечении ВХБ, или эфферентные методы лечения, в сочетании с инфузионной терапией представляют комплекс лечебных воздействий при осложнениях беременности, сопровождающихся нарушением функций нескольких органов и систем, чаще всего такие состояния возникают при ХГБ, преэклампсии, HELLP-синдроме и других осложнениях, которые сопровождаются развитием системной воспалительной реакции, эндотоксикозом, нарушением функции печени и почек, гиперкоагуляцией, тромбофилией, нарушением микроциркуляции, реологии крови, метаболических процессов, синтезом различных аутоантител, активацией цитокинов, что приводит к тяжелым осложнениям, полиорганной недостаточности, ухудшением исходов для матери и плода [2, 3, 5, 6]. Многочисленные экспериментальные и клинические исследования последних лет показали обоснованность и эффективность применения плазмафереза в комплексной терапии холестатического гепатоза беременных с целью предупреждения осложнений [3]. Лечебный эффект плазмафереза обусловлен многими механизмами: удалением из кровеносного русла токсических веществ, аутоантител, иммунных комплексов (антиген-антитело), продуктов метаболизма, компонентов разрушенных тканей и клеток; деплазмированием клеточных «очищающих» систем и форменных элементов крови; повышением функциональной активности и изменением жизнедеятельности кроветворных, стромальных, иммунокомпетентных клеток; деблокированием естественных органов «очищения» и фагоцитирующей системы; устранением феномена оптической мутности плазмы; экстракорпоральным воздействием на реинфузируемые форменные элементы крови [6].
Плазмаферез обеспечивает и антиоксидантный эффект, удаляя из организма продукты свободнорадикального окисления, что приводит к увеличению активности факторов антиоксидантной защиты [3]. Плазмаферез оказывает реокоррегирующий эффект, уменьшая вязкость крови, снижая периферическое сопротивление, улучшая тем самым процессы микроциркуляции, нормализуя измененный тканевый метаболизм и иммунный ответ [6].
Противопоказания для проведения плазмафереза у женщин с ХГБ: выраженная недостаточность сердечно-сосудистой системы; выраженная гипотония (АД 80/40 мм рт. ст.); гипокоагуляция, тромбоцитопения; тяжелая анемия (гемоглобин менее 80 г/л); острые инфекционные заболевания [2, 3, 6].
Процедуры плазмафереза проводятся пациенткам в специализированном отделении сертифицированными специалистами. Оптимально лечебный плазмаферез беременным с ХГБ следует проводить с использованием современных аппаратов [3, 32].
Аппаратный плазмаферез проводится на аппарате «MCS+» или «PCS2» фирмы «Haemonetics» (США). В качестве антикоагулянта используется раствор АСД-А (кислая декстроза), подаваемый автоматически в соотношении к крови 1/12. Перед началом процедуры пациентке вводится внутривенно гепарин из расчета 25ЕД на кг массы тела. Скорость подачи крови в аппарат 25–40 мл в минуту в зависимости от пропускной способности катетера и возможности вены, объем плазмоэксфузии за процедуру составляет 25% ОЦП. Скорость вращения центрифуги «MCS+» или «PCS2» 7500 оборотов в минуту, плазма удаляется со скоростью 15–30 мл/мин в зависимости от скорости подачи крови [2].
При нормальном исходном уровне общего белка крови удаление 25% ОЦП может быть компенсировано сочетанным введением коллоидных и кристаллоидных растворов в отношении к объему удаленной плазмы 2:1. В качестве коллоидных растворов используется раствор гидроксиэтилированного крахмала (ГЭК) 6% с молекулярным весом 130/04. Первые 200 мл удаляемой плазмы замещают кристаллоидными растворами, проводя на этом фоне биологическую пробу на планируемый к инфузии коллоидный раствор [8]. В качестве кристаллоидных растворов используют физиологический раствор или раствор Рингера, Хартмана. Показанием для применения белковых препаратов при плазмовозмещении является исходный низкий уровень общего белка крови (менее 60 г/л). При этом использется 10 или 20% раствор альбумина 100–50 мл. Курс лечения включает 3–4 сеанса плазмафереза. Перерыв между сеансами составляет 2–4 дня, повторные курсы – через 2–3 недели [3]. Для расчета объема удаляемой плазмы определяется объем циркулирующей крови (ОЦК) с учетом массы тела, роста, конституционального типа по таблице Moore:
ОЦК= М × Кк,
где М – масса тела в кг; Кк – количество крови в мл/кг массы тела в зависимости от пола и типа телосложения (от 55 до 70 мл/кг).
Далее рассчитывается гематокрит, который составляет утроенный уровень гемоглобина в г/л: Ht = Hb х 3, где Ht – гематокрит в %; Hb – содержание гемоглобина в г %. Затем по расчетному ОЦК и гематокриту определяется ОЦП:
ОЦП = ОЦК × (100% – Ht)
Установлено, что уже после первой процедуры отмечается значительное уменьшение кожного зуда, улучшение самочувствия, сна, аппетита, постепенное снижение ЖК, АСАТ, АЛАТ, ЩФ [6, 8].
Контролируемые показатели: клиническая картина, уровень ферментов, ЖК, гемостазиограмма, УЗИ плода и допплерометрия [3].
В послеродовом периоде при наиболее тяжелых формах ХГБ также возможно продолжение терапии с проведением 2–3 процедур плазмафереза в течение 7–10 дней после родоразрешения [8].
Возможные побочные эффекты эфферентных методов
Основными побочными действиями при проведении плазмафереза являются: аллергические реакции (показано введение антигистаминных препаратов и кортикостероидов), коллаптоидное состояние (показано проведение инфузионной терапии кристаллоидами, коллоидными и белковыми препаратами), нарушение электролитного состава крови, проявляющиеся сердечной аритмией (обязательно контроль уровней электролитов и коррекция возникших нарушений) [2].
9. Профилактика и прогнозирование осложнений беременности
Профилактикой осложнений беременности является своевременная диагностика и лечение ВХБ. Ведущую роль в прогнозирование осложнений отводят определению концентрации общих желчных кислот в крови у матери (см. раздел «Осложнения беременности») [11].
Наиболее неблагоприятный прогноз течения ВХБ отмечают при выраженном желтушном и цитолитическом синдромах, при раннем (25–27 недель) развитии заболевания [11, 34].
Показания к дополнительному обследованию и проведению дифференциальной диагностики: повышение активности аминотрансфераз (АЛТ, АСТ), концентрации билирубина более чем в 2–3 раза, подозрение на сахарный диабет, наличие дерматита, чесотки, экземы и других дерматологических заболеваний [13].
Показания к госпитализации:
Появление кожного зуда и биохимических маркеров холестаза.
С целью проведения терапии эфферентными методами.
При возникновении осложнений беременности.
При сохраняющихся симптомах холестаза или его рецидиве после лечения в 36 и более недель для родоразрешения.
10. Выбор срока и метода родоразрешения
Досрочное родоразрешение (до 37 нед.) показано в случае тяжелого течения ВХБ с нарастанием интенсивности зуда, желтухи и содержания желчных кислот, при нарушении состояния плода и неэффективности терапии [25, 26].
При положительном эффекте от проводимой терапии родоразрешение показано в 38 нед. Предпочтительно родоразрешение через естественные родовые пути. Кесарево сечение – по акушерским показаниям. Преиндукция и индукция родов проводится согласно принятым протоколам. Применение препаратов группы анигестагенов и простагландинов не противопоказано [8].
Рекомендации:
Критериями диагноза ВХБ является наличие кожного зуда и повышение уровня общих желчных кислот в сыворотке крови при отсутствии других причин повреждения печени. Диагноз считается подтвержденным после нормализации печеночных проб в послеродовом периоде.
Специфичным изменением в лабораторных исследованиях является повышение уровня общих желчных кислот в сыворотке крови ≥10 мкмоль/л. Синдром цитолиза от минимально выраженного до значительного (повышение уровня АСАТ, АЛАТ, гаммаглутамилтранспептидазы, гипербилирубинемия) может сочетаться с ВХБ. Повышение уровня щелочной фосфатазы считается неинформативным и неспецифичным.
Наибольшую опасность ВХБ представляет для плода и связан с увеличением частоты антенатальной гибели, преждевременных родов, гипоксии и асфиксии плода. Риск неблагоприятных перинатальных исходов значимо увеличивается при развитии ВХБ до 33 недель и/или при уровне общего количества желчных кислот ≥40 мкмоль/л. ВХБ существенно влияет на общее состояние и качество жизни женщины вследствие возможного повреждения кожного покрова и нарушения сна из-за выраженного кожного зуда.
В случаях раннего или атипичного дебюта ВХБ необходимо проводить дифференциальную диагностику с преэклампсией, HELLP-синдромом, острой жировой печенью беременных, острым вирусным гепатитом.
Препаратом первой линии для лечения ВХБ следует считать препараты УДХК в дозе 10–20 мг/кг в сутки.
В качестве дополнительных методов лечения может применяться S-аденозилметионина (SAM) и эфферентные способы терапии.
Сроки и методы родоразрешения определяются индивидуально. Досрочное родоразрешение (до 37 недель) показано в случае тяжелого течения ВХБ с нарастанием интенсивности зуда, желтухи и содержания желчных кислот, при нарушении состояния плода. При положительном эффекте от проводимой терапии родоразрешение показано в 38 недель. Предпочтительно родоразрешение через естественные родовые пути. Кесарево сечение – по акушерским показаниям.



