Инфекции мочевыводящих путей (ИМП) относятся к наиболее распространенным инфекционным заболеваниям у женщин. Во время беременности ИМП могут приводить к развитию серьезных осложнений у матери и плода, таких как анемия, артериальная гипертензия, сепсис, преждевременные роды, рождение детей с низкой массой тела [1].
Возбудителями ИМП в подавляющем большинстве случаев являются уропатогенные энтеробактерии – бактерии семейства Enterobacteriaceae, главным образом Escherichia coli и Klebsiella spp. Наиболее широко для лечения ИМП, особенно во время беременности, используются бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы) ввиду их активности против энтеробактерий и безопасности при беременности [1]. В последние годы наблюдается устойчивый рост резистентности уропатогенных энтеробактерий к бета-лактамным антибиотикам, что в первую очередь обусловлено продукцией ферментов бета-лактамаз, осoбеннo бета-лактамаз рaсширеннoгo спектрa действия (БЛРС) [2]. Самыми распространенными типами бета-лактамаз являются TEM, SHV и CTX-M [3]. Среди ферментов этих типов могут быть бета-лактамазы как ширoкoгo, так и расширеннoгo спектрa, которые различаются между собой единичными аминокислотными заменами. Еще один механизм бета-лактамной резистентности обусловлен образoванием хромосомных или плазмидных бета-лактамаз типа AmpC, не ингибирующихся клавулановой кислотой и другими ингибиторами бета-лактамаз [2, 3]. Важной проблемой, которая требует пристального внимания, является появление у энтеробактерий устойчивости к карбапенемам, oпoсредованной металло-бета-лактамазами или приобретенными карбапенемазами, обеспечивающими устойчивость к большинству или всем доступным бета-лактамам [2].
Во время беременности выбор препаратов для терапии тяжелых форм ИМП (пиелонефрита) ограничен аминопенициллинами и цефалоспоринами, в том числе ингибиторозащищенными; в популяциях с множественной резистентностью применяют карбапенемы, а в случаях тяжелого сепсиса могут дополнительно использоваться аминогликозиды [1, 4, 5]. Пероральный фосфомицин считается безопасным препаратом для беременных женщин, он широко используется для лечения ИМП нижних отделов мочевыводящих путей (цистита и бессимптомной бактериурии) и обладает высокой активностью против большинства уропатогенов, однако его не используют для лечения инфекций в почках, так как при этой форме препарата терапевтическая концентрация в почках не достигается. Недавно были проведены клинические испытания парентеральной формы фосфомицина по сравнению с пиперациллином/тазобактамом [6] и меропенемом или цефтриаксоном [7], показавшие высокую эффективность парентерального фосфомицина для лечения осложненных форм ИМП. Необходимо отметить, однако, что в обоих испытаниях беременность и лактация были критериями исключения, поэтому до внедрения данной терапии в акушерскую практику необходимо проведение надлежащих испытаний в популяции беременных женщин.
Антибактериальная терапия ИМП начинается, как правило, эмпирически, и в последующем корректируется, если необходимо, на основании результатов культурального исследования мочи. Однако высокая резистентность энтеробактерий к бета-лактамным антибиотикам может приводить к неэффективности терапии и, как следствие, неблагоприятным клиническим исходам. Кроме того, широкое использование эмпирической терапии в условиях высокой резистентности к данным антибиотикам способствует дальнейшему росту резистентности. В связи с этим ограничение использования эмпирической терапии в пользу этиотропной с учетом профиля антибиотикорезистентности является актуальной клинической задачей.
В настоящее время определение антибиотикорезистентности уропатогенов основывается на культуральном исследовании мочи, включающем выявление клинически значимой бактериурии (≥103 при цистите, ≥104 при пиелонефрите и ≥105 КОЕ/мл при бессимптомной бактериурии [4]) и определение чувствительности выявленных уропатогенов к антибиотикам. Культуральный анализ мочи трудоемок и длителен (48–72 ч). В последние годы получил распространение подход, при котором сначала производят количественный посев мочи в питательные среды для определения клинической значимости выявленного возбудителя, после чего культура исследуется быстрыми методами (например, полимеразной цепной реакцией (ПЦР)), для выявления генов резистентности [8, 9]. Данный способ позволяет сократить продолжительность анализа примерно на 24 ч с сохранением этапа количественного культурального исследования мочи. Прямое исследование мочи на гены антибиотикорезистентности представляется проблематичным, так как в результате могут выявляться гены антибиотикорезистентности в клинически не значимых бактериях. В последние годы для быстрого определения клинически значимой бактериурии было предложено несколько методик, основанных на полуколичественной ПЦР для обнаружения ДНК основных уропатогенов [10–12] в клинически значимом количестве, эквивалентном таковому при культуральном исследовании.
Целью данного исследования была разработка способа быстрого анализа мочи на гены бета-лактамной резистентности уропатогенных энтеробактерий и определение его диагностических характеристик по сравнению с фенотипическим (диско-диффузионным) методом.
Материалы и методы
Обследуемая популяция и клинический материал
В исследовании были использованы образцы мочи, полученные в период с 2019 по 2022 гг. от беременных и небеременных пациенток амбулаторных и стационарных отделений НИИАГиР им. Д.О. Отта и направленные в лабораторию клинической микробиологии для рутинного исследования на значимую бактериурию. От каждой пациентки включали только один (первый) образец мочи. В исследование не включались пациентки, находившиеся в стационаре по любому показанию в течение последних 3 месяцев до развития текущего эпизода инфекции, а также получавшие антибиотики менее чем за сутки до получения мочи для бактериологического исследования.
Культуральное исследование мочи на значимую бактериурию и чувствительность выделенных уропатогенов к антибиотикам
Культуральное исследование мочи проводилось с использованием хромогенной питательной среды для выделения возбудителей ИМП (Brilliance UTI Clarity Agar, Oxoid, Великобритания). Видовую идентификацию проводили методом матрично-активированной лазерной десорбционно/ионизационной времяпролетной масс-спектрометрии (MALDI-TOF MS) (Microflex, Bruker Daltonics, Германия). Значимую бактериурию определяли как количество уропатогена ≥104 КОЕ/мл.
Тестирование выделенных уропатогенов к антибиотикам проводили с применением диско-диффузионного метода в соответствии с требованиями Европейского комитета по определению чувствительности к антимикробным препаратам [13]. Все выделенные уропатогены были протестированы на чувствительность к аминопенициллинам (ампициллину, амоксициллину/клавуланату, пиперациллину/тазобактаму), цефалоспоринам 3–4 поколений (цефотаксиму, цефтазидиму, цефтриаксону, цефподоксиму, цефиксиму, цефепиму), карбапенемам (меропенему, имипенему), аминогликозидам (гентамицину, амикацину) и фосфомицину с использованием дисков (Oxoid, Великобритания). Для контроля качества анализа использовали штамм E. coli ATCC 25922. Все протестированные изоляты бактерий относили к одной из трех категорий: чувствительные, умеренно-резистентные (чувствительные при увеличенной экспозиции) и резистентные. Фенотип уропатогена относили к резистентному в случае его принадлежности последней категории.
Все изоляты энтеробактерий были протестированы на БЛРС с применением метода «двойных дисков». Для этого использовали набор дисков производства ФБУН «НИИ эпидемиологии и микробиологии имени Пастера» (Санкт-Петербург). Параллельно с анализом исследуемых культур тестировали контрольный штамм E. coli ATCC 25922, не продуцирующий БЛРС.
Выделение ДНК из проб мочи и культур уропатогенов
Для выделения ДНК из проб мочи и культур использовали набор реагентов РИБО-преп (ФБУН ЦНИИ эпидемиологии, Москва), анализ проводили в соответствии с инструкцией производителя. До анализа пробы ДНК хранили при -20°С.
Определение значимой бактериурии методом количественной ПЦР в реальном времени
Для анализа мочи на значимую бактериурию методом количественной ПЦР в реальном времени использовали набор реагентов «АмплиСенс ИМП-монитор-FL» (ФБУН ЦНИИ эпидемиологии, Москва). Анализ проводили в амплификаторе Rotor-Gene 6000 (Qiagen, Австралия). Набор предназначен для количественного определения таких аналитов, как общая бактериальная ДНК, ДНК Enterobacterales, ДНК E. coli, ДНК Klebsiella pneumoniae, ДНК Proteus spp., ДНК Pseudomonas aeruginosa, ДНК Enterococcus spp., ДНК Staphylococcus spp., ДНК Streptococcus spp., ДНК Streptococcus agalactiae. Анализ и интерпретацию результатов проводили с применением программного обеспечения, прилагаемого к набору реагентов. Рассчитывали количество геномных эквивалентов (ГЭ) соответствующих микроорганизмов в 1 мл образца мочи.
Выявление генов антибиотикорезистентности в образцах мочи и штаммах уропатогенов методом ПЦР в реальном времени
Гены бета-лактамной резистентности mec A (к метициллину, оксациллину), TEM, CTX-М-1, SHV (аминопенициллинам и цефалоспоринам), DHA (ингибиторозащищенным аминопенициллинам и цефалоспоринам), OXA-10-like, OXA-40-like, OXA-48-like, ОXA-23-like, OXA-51-like, IMP, KPC, GES, NDM, VIM (карбапенемам) выявляли с использованием наборов реагентов «БакРезиста GLA» («ДНК-Технология», Москва), «РЕЗИСТОМ.OXA10» и «РЕЗИСТОМ.DHA» («Литех», Москва). Анализ выполняли согласно инструкциям производителей в амплификаторе «ДТпрайм» («ДНК-Технология», Москва).
Выявление вагинальных бактерий в образцах мочи методом количественной ПЦР в реальном времени
Тестирование проводили с использованием набора реагентов «АмплиСенс Флороценоз-Бактериальный вагиноз» (ФБУН ЦНИИ эпидемиологии, Москва). Тест предназначен для количественного определения ДНК Gardnerella vaginalis, Atopobium vaginae, Lactobacillus spp. и общего количества бактерий. Амплификацию проводили в детектирующем амплификаторе Rotor-Gene 6000 (Qiagen, Австралия).
Расчет количества ДНК G. vaginalis, A. vaginae, Lactobacillus spp. и общей бактериальной ДНК проводили с применением программы «АмплиСенс Флороценоз-Бактериальный Вагиноз» (ЦНИИ Эпидемиологии).
Статистический анализ
Методы описательной статистики включали определение медианы и межквартильного интервала для количественных показателей (концентрация ДНК бактерий в моче), после проверки их распределения на нормальность, которая показала отклонения от нормального распределения. Для частотных показателей (частота выявленных в моче бактериальных видов и частота резистентных фенотипов и генотипов энтеробактерий) рассчитывали 95% доверительный интервал (95% ДИ). Минимальный размер выборки для определения диагностических характеристик разрабатываемого способа был определен исходя из предполагаемой частоты бета-лактамной резистентности в обследуемой популяции равной 20% (по данным литературы), статистической мощности 80% и уровнем значимости p<0,05 [14]. Рассчитанный размер минимальной выборки составил 100 пациентов со значимой бактериурией, обусловленной уропатогенными энтеробактериями. Оценку диагностической точности количественных тестов (концентрация ДНК уропатогенов в моче) проводили с применением ROC-анализа (ROC – receiver operating characteristic). Определяли площадь под ROC кривой, а также чувствительность, специфичность, прогностическую значимость положительных и отрицательных результатов при оптимальном пороге, которым являлась координата ROC-кривой с максимальным значением суммы чувствительности и специфичности. Показатели диагностической точности (чувствительность, специфичность, прогностическая значимость положительных и отрицательных результатов) для неколичественных показателей (наличие резистентного генотипа) рассчитывали путем построения таблиц сопряженности, для каждого показателя рассчитывали 95% ДИ. Для статистического анализа результатов использовали программу Analyse-It 5.11 (Analyse-it Software, Leeds, UK).
Результаты
В ходе исследования были получены пробы мочи от 214 женщин. По результатам культурального исследования значимая бактериурия была обнаружена у 111 женщин. В подавляющем большинстве случаев были выявлены энтеробактерии (94/111; 85% [95% ДИ 77–90%]), из них 76 штаммов E. coli, 14 штаммов Klebsiella pneumoniae, 1 штамм Klebsiella oxytoca, 1 штамм Klebsiella aerogenes (до недавнего времени Enterobacter aerogenes), 2 штамма Proteus mirabilis. Кроме энтеробактерий были выявлены Enterococcus faecalis (7/111; 6,3% [95% ДИ 3–12%]), S. agalactiae (5/111; 5% [95% ДИ 2–10%]), Staphylococcus saprophyticus (4/111; 4% [95% ДИ 1–9%]), Staphylococcus haemolyticus (1/111; 0.9% [95% ДИ 0–5%]).
Пробы мочи от всех женщин были протестированы с использованием метода количественной ПЦР в реальном времени (табл. 1). Медианные значения концентраций ДНК специфических бактерий/групп бактерий превышали 2×106 ГЭ/мл, тогда как неспецифических – варьировали от 0 до 3×103 ГЭ/мл. Медианные концентрация бактерий/групп бактерий в образцах без клинически значимой бактериурии варьировали от 0 до 1×105 ГЭ/мл.
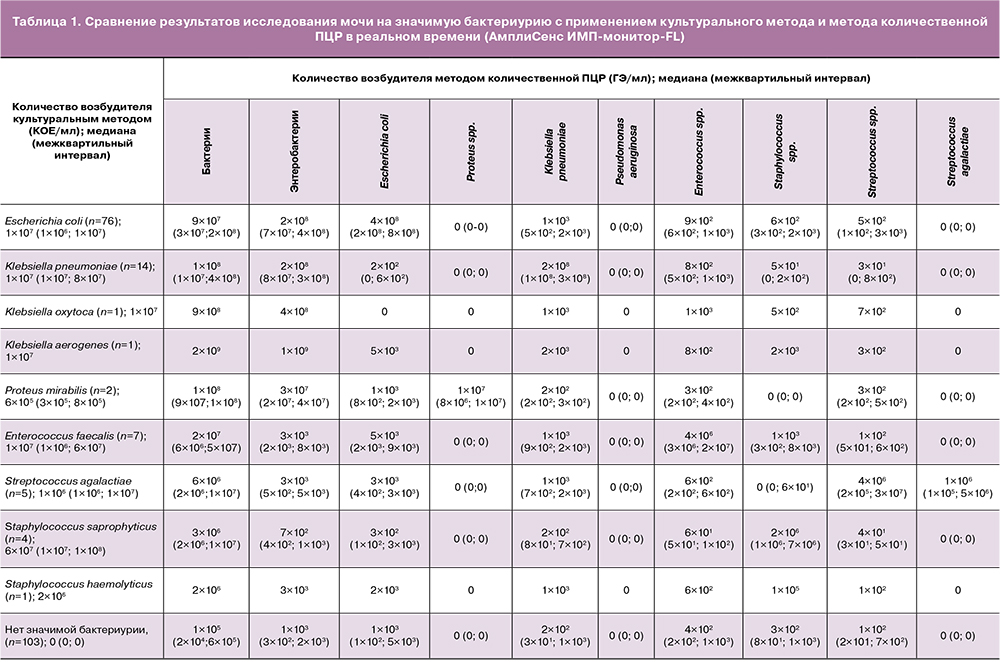
Для аналитов теста «АмплиСенс ИМП-монитор-FL» с применением ROC анализа были определены показатели дискриминационной способности (площадь под ROC кривой) и диагностической точности (чувствительность, специфичность, прогностическая значимость положительных и отрицательных результатов при оптимальном пороге) (табл. 2). В анализ не были включены Proteus spp. и Pseudomonas aeruginosa, ввиду недостаточного (<5) количества образцов. Для большинства аналитов теста установлены высокие показатели чувствительности (93–100%), специфичности (90–100%), прогностической значимости положительных (83–100%) и отрицательных (92–100%) результатов.
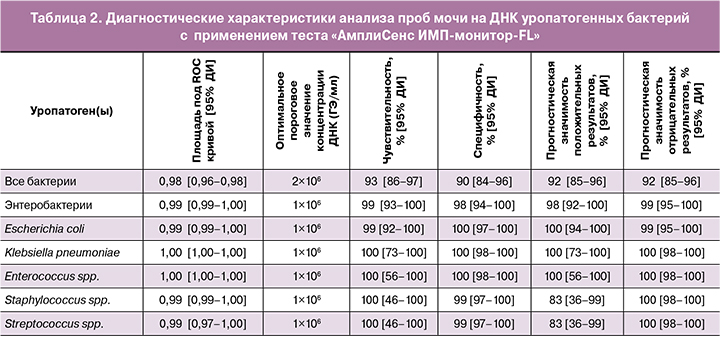
С целью оценки вклада вагинальных бактерий в общую бактериальную массу в моче все пробы мочи с незначимой бактериурией были протестированы с применением теста «АмплиСенс Флороценоз-Бактериальный вагиноз». Концентрация Lactobacillus spp. в пробах мочи с незначимой бактериурией составила 9×103 (8×102; 6×104) ГЭ/мл, G. vaginalis – 0 (0; 1×101) ГЭ/мл, A. vaginae – 0 (0; 0) ГЭ/мл. На рисунке 1 представлены пробы мочи с незначимой бактериурией (установленной культуральным методом), в которых концентрация ДНК всех бактерий составляла ≥105 ГЭ/мл. Видно, что во всех 5 пробах с общей концентрацией бактериальной ДНК ≥106 ГЭ/мл и в большинстве проб (22/35, 62,6%) с общей концентрацией бактериальной ДНК ≥105 ГЭ/мл концентрация ДНК лактобацилл была очень высокой, а именно, сопоставимой с концентрацией всей бактериальной ДНК в пробе, а в пробах с низкой концентрацией лактобацилл часто присутствовали G. vaginalis и A. vaginae. Таким образом, несмотря на ограниченный спектр исследуемых вагинальных бактерий в примененном тесте, данный подход свидетельствует о существенном вкладе вагинальных бактерий в общую бактериальную массу в моче, что необходимо учитывать при анализе результатов молекулярных тестов.
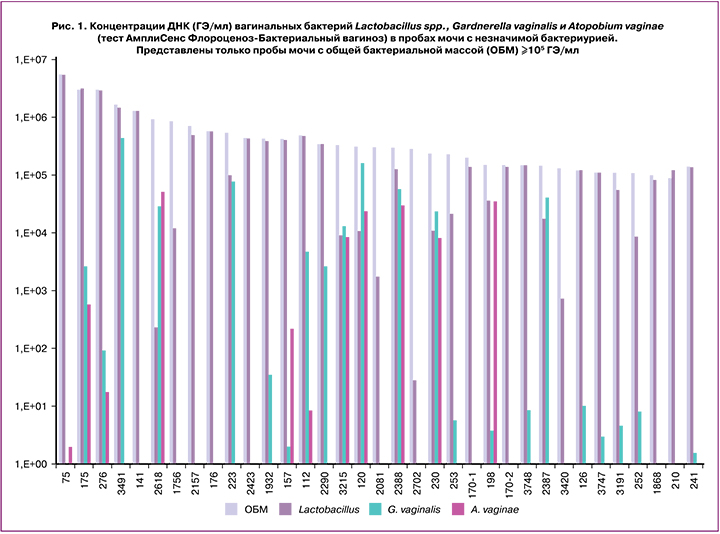
Анализ выделенных уропатогенных бактерий на антибиотикорезистентность показал, что из 76 штаммов E. coli к ампициллину были резистентны 44 штамма (58% [95% ДИ 47–68%]), к амоксициллину/клавуланату – 26 штаммов (34% [95% ДИ 25–45%]), к пиперациллину/тазобактаму – 1 штамм (1% [95% ДИ 0–8%]), цефалоспоринам 3–4 поколений – 12 штаммов (16% [95% ДИ 9–26%]), гентамицину – 2 штамма (3% [95% ДИ 1–9%]), фосфомицину – 1 штамм (1% [95% ДИ 0–8%]) (табл. 3). Все штаммы кишечной палочки были чувствительны к меропенему, имипенему и амикацину. Из 15 штаммов Klebsiella spp. (K. aerogenes не включали в анализ ввиду природной резистентности к пенициллинам), 5 штаммов (33% [95% ДИ 13–61%]) обладали резистентностью к амоксициллину/клавуланату, 2 штамма (13% [95% ДИ 2–42%]) – к пиперациллину/тазобактаму, 1 штамм (7% [95% ДИ 0–34%]) – к цефалоспоринам. Все штаммы Klebsiella spp. были чувствительны к меропенему, имипенему, гентамицину и амикацину. Все грамположительные уропатогены (энтерококки, стафилококки и стрептококки) были чувствительны к бета-лактамным, аминогликозидным антибиотикам и фосфомицину (данные не включены в таблицу).
Гены CTX-M были выявлены в 10 образцах мочи с бактериурией, обусловленной E. coli, в 2 – K. pneumoniae и 1 – K. oxytoca (табл. 3). Гены TEM были обнаружены в 15 образцах мочи, содержащих значимое количество E. coli, и в 3 – K. pneumoniae. Гены DHA были выявлены в 2 образцах мочи, содержащей E. coli. Гены SHV (обусловливают природную резистентность к пенициллинам в K. pneumoniae и приобретенную резистентность в E. coli), были обнаружены во всех образцах с K. pneumoniae и отсутствовали во всех образцах с E. coli. Таким образом, частота приобретенных генов резистентности – CTX-M, TEM и DHA – составила 13/91 (14% [95% ДИ 9–23%]), 18/91(20% [95% ДИ 12–30%]) и 2/91 (2% [95% ДИ 0–8%]) соответственно. Общее число образцов, в которых были выявлены один или несколько из этих генов, составило 25/91 (27% [95% ДИ 19–37%]).
В одном образце мочи со значимой бактериурией, обусловленной E. coli, был обнаружен ген mecA в концентрации 4,1 lg (при концентрации ОБМ 9,0 lg). Соответствующий изолят был отрицательным на данную детерминанту. Данный ген часто встречается в метициллин-резистентных Staphylococcus aureus. С применением теста «АмплиСенс» в данном образце мочи была выявлена ДНК Staphylococcus spp. в концентрации 7×105 ГЭ/мл; и это позволяет предполагать, что выявление гена mecA было связано с присутствием в пробе мочи метициллин-резистентных S. aureus в клинически незначимом количестве. Кроме этого случая, все детерминанты резистентности, выявленные в моче, были также обнаружены в соответствующих изолятах уропатогенов.
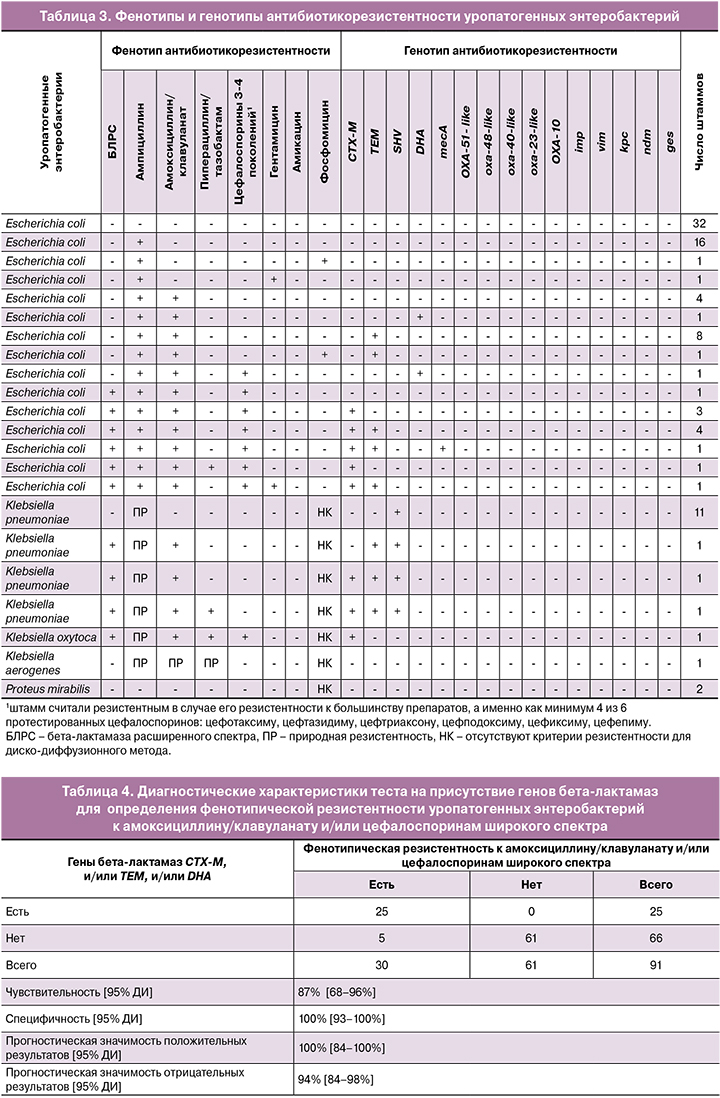
Для оценки диагностической точности ПЦР-тестирования образцов мочи на гены бета-лактамной резистентности с целью предсказания фенотипической резистентности основных уропатогенных энтеробактерий (E. coli и Klebsiella spp., исключая K. aerogenes) к наиболее широко применяемым для лечения пиелонефрита у беременных женщин бета-лактамным антибиотикам (амоксициллину/клавуланату и цефалоспоринам) сравнили результаты ПЦР с результатами культурального исследования антибиотикорезистентности (табл. 4). Фенотипически резистентность к амоксициллину/клавуланату и цефалоспоринам была выявлена в 30 изолятах энтеробактерий – 26 изолятах E. coli и 4 изолятах Klebsiella spp. В 25 из этих 30 изолятов были выявлены гены исследуемых типов бета-лактамаз (CTX-M, TEM, DHA) по отдельности или в сочетаниях. Ни в одном из 61 штамма с чувствительным фенотипом гены резистентности не выявлялись. Таким образом, чувствительность, специфичность, прогностическая значимость положительных и отрицательных результатов составили 87, 100, 100, 94% соответственно.
Для дальнейшей оценки аналитических характеристик теста на резистентность уропатогенных энтеробактерий к амоксициллину/клавуланату и/или цефалоспоринам мы протестировали на гены резистентности 17 образцов мочи и выделенные из них штаммы уропатогенов, не принадлежащих семейству Enterobacteriaceae. Все пробы мочи и выделенные из них изоляты были отрицательными на гены резистентности. Далее мы дополнительно протестировали на детерминанты резистентности 75 образцов мочи без значимой бактериурии, и ни в одной исследуемой пробе не обнаружили генетические детерминанты резистентности.
Полученные нами результаты послужили основанием для разработки алгоритма быстрого анализа мочи на ДНК уропатогенных микроорганизмов и гены бета-лактамной резистентности уропатогенных энтеробактерий (рис. 2). Ввиду того, что выбор антибиотиков для лечения ИМП при беременности ограничен бета-лактамными антибиотиками, особенно у женщин с пиелонефритом, наибольшую практическую значимость данный алгоритм может иметь при ведении беременных женщин.
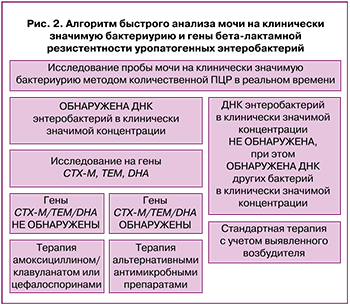
Алгоритм предполагает исследование проб мочи, полученных от женщины с клинико-лабораторными признаками инфекции верхних отделов мочевыводящих путей, на клинически значимую бактериурию методом ПЦР (рис. 2). В случае обнаружения ДНК энтеробактерий в клинически значимом количестве (>1×106 ГЭ/мл) проводят ПЦР-анализ на гены бета-лактамаз CTX-M, TEM и DHA, и по результатам этого теста делают выбор антибактериальной терапии. Если данные детерминанты не выявляются, лечение амоксициллином/клавуланатом или цефалоспоринами будет эффективным с вероятностью 94% (прогностическая значимость отрицательных результатов предлагаемого способа).
Если энтеробактерии не выявляются в клинически значимом количестве, но выявляются другие бактерии (как правило, представители грамположительной микрофлоры, которые в большинстве случаев чувствительны к бета-лактамам), выбор терапии осуществляют с учетом возбудителя.
Обсуждение
В данном исследовании впервые разработан способ быстрого анализа мочи, основанный на определении клинически значимого количества уропатогенов методом количественной ПЦР и, в случае выявления энтеробактерий, ПЦР-анализе проб на гены бета-лактамной резистентности. Способ может применяться в любых популяциях пациентов, однако наиболее востребованным клиническим приложением способа представляется выбор терапии для беременных женщин с тяжелыми ИМП ввиду ограниченности выбора антибиотиков в данной популяции. Предлагаемый подход позволяет полностью исключить этап культурального исследования мочи и, как следствие, значительно сократить время исследования (с 48–72 до 3–4 ч).
Целью нашей работы было разработать способ быстрого ПЦР-анализа проб мочи для выявления значимой бактериурии и детерминант антибиотикорезистентности, значимых в обследуемой популяции. Данная цель определила структуру работы. Во-первых, мы охарактеризовали спектр возбудителей ИМП в обследуемой популяции и обнаружили высокую частоту генов бета-лактамаз среди энтеробактерий в отсутствие проблемы резистентности других уропатогенов к стандартным препаратам. Далее мы определили гены бета-лактамной резистентности, которые наиболее точно предсказывали резистентные фенотипы выделенных изолятов бактерий. Наконец, мы показали, что в пробах мочи и выделенных из них штаммов уропатогенов выявляются одни и те же генетические детерминанты резистентности.
В последние годы для диагностики ИМП был разработан ряд молекулярных тестов, преимущественно с применением полуколичественной ПЦР на ДНК основных уропатогенов [10–12]. В нашем исследовании был использован коммерческий тест («АмплиСенс ИМП-монитор-FL»), основанный на количественной ПЦР в реальном времени для оценки уропатогенов в моче. С применением этого теста мы определили оптимальные пороговые значения концентрации бактерий/групп бактерий, использование которых позволяет определять бактериурию с порогом ≥104 КОЕ/мл с чувствительностью 93% и специфичностью 90%.
В данной работе мы впервые исследовали вопрос о вкладе вагинальных бактерий (ДНК лактобацилл и/или G. vaginalis и A. vaginae) в общую бактериальную массу в моче. Было установлено их высокое содержание в большинстве проб мочи с незначимой бактериурией, но при этом с высоким содержанием общей бактериальной ДНК. Результаты анализа убедительно подтверждают важность тщательного туалета половых органов перед получением образца мочи для молекулярного анализа на значимую бактериурию, особенно когда интерпретируют концентрацию общей бактериальной ДНК.
Прогнозирование клинической эффективности антибактериальных препаратов можно проводить на основе оценки фенотипа (антибиотикограммы), а также основываясь на результатах определения наличия или отсутствия генов резистентности (оценка генотипа) данного патогена [15]. В последние годы активно разрабатываются ПЦР-тесты для выявления генов антибиотикорезистентности у ряда клинически значимых бактерий, включая гены бета-лактамной резистентности у уропатогенов [8, 9, 16]. Использование молекулярных методов вместо традиционных фенотипических методов ставит новые задачи, включающие решение проблемы несоответствия между фенотипом и генотипом [15].
В нашем исследовании в популяции женщин репродуктивного возраста с внебольничными ИМП путем сравнения результатов диско-диффузионного и молекулярного анализа штаммов уропатогенных энтеробактерий был определен набор генов бета-лактамаз (CTX-M, TEM, DHA), с достаточно высокой точностью предсказывающих фенотип бета-лактамной резистентности. Чувствительность, специфичность, прогностическая значимость положительных и отрицательных результатов данного подхода составили 87, 100, 100, 94% соответственно. В клиническом контексте высокая прогностическая значимость отрицательных результатов (94%) означает, что у пациентов, в пробах мочи которых не обнаружены гены CTX-M, TEM, DHA (в обследованной нами популяции частота таких случаев превышала 70%), с высокой долей вероятности эффективными будут и амоксициллин/клавулановая кислота, и цефалоспорины.
Ограничением нашего исследования является то, что в анализ антибактериальной активности был включен узкий спектр ингибиторозащищенных пенициллинов (амоксициллин/клавуланат и пиперациллин/тазобактам). К тому же данные по пиперациллину/тазобактаму не были включены в анализ диагностической эффективности предлагаемого подхода. Обоснованием нашего выбора явилось то, что амоксициллин/клавуланат гораздо более широко используется в отечественной клинической практике.
Распространенность энтеробактерий, продуцирующих БЛРС, существенно варьирует в зависимости от региона и обследуемой популяции. В недавнем международном исследовании самый высокий уровень БЛРС-продуцирующих E. coli был отмечен в России (15,7%), тогда как самый низкий (0%) наблюдался в Финляндии [17]. Согласно данным последнего многоцентрового исследования ДАРМИС-2018, отмечено увеличение частоты БЛРС-продуцирующих энтеробактерий у взрослых с 8,5 до 27% [18]. Очевидно, что ввиду большого разнообразии генов бета-лактамной резистентности и широко варьирующей в различных популяциях структуре, молекулярные тесты на гены антимикробной резистентности должны разрабатываться с учетом текущей региональной эпидемиологии и целевой популяции. Так, для пациентов с нозокомиальными ИМП высокую актуальность будут иметь тесты на детерминанты резистентности к карбапенемам.
Заключение
Таким образом, мы разработали количественные критерии значимости выявленной ДНК уропатогенов с применением ПЦР в реальном времени и определили набор наиболее клинически значимых и диагностически точных генетических детерминант бета-лактамной резистентности уропатогенных энтеробактерий. Это позволило нам разработать способ быстрого анализа мочи на гены бета-лактамной резистентности уропатогенных энтеробактерий и предложить диагностический алгоритм выявления клинически значимой бактериурии и антибиотикорезистентности возбудителей инфекций мочевыводящих путей с большим потенциалом применения в акушерской практике. Данный диагностический подход призван способствовать как улучшению клинических исходов, так и сдерживанию роста антибиотикорезистентности.



