Эндометриоз – хронический патологический процесс, при котором определяется наличие ткани, по морфологическим и функциональным свойствам подобной эндометрию, вне полости матки [1–9]. Этиология и патогенез заболевания до настоящего времени окончательно не выяснены [4].
Эндометриоз имеет серьезные неблагоприятные последствия для здоровья и качества жизни женщин [1–10]. Наиболее значимыми клиническими проявлениями заболевания являются тазовая боль (дисменорея, диспареуния, дисхезия и хроническая тазовая боль), бесплодие, нарушения менструального цикла, аномальные маточные кровотечения [1–10].
С развитием медицины стало понятно, что необходим персонализированный подход к ведению пациенток с эндометриозом. Стратегия ведения женщин должна быть направлена на улучшение их качества жизни путем уменьшения болевого синдрома, лечения бесплодия, снижения частоты рецидивов заболевания и повторных хирургических вмешательств [1–9].
При лечении эндометриоза применяют хирургические методы и медикаментозную терапию. Основным видом медикаментозного лечения, согласно международным и российским клиническим рекомендациям, является гормональная терапия при отсутствии противопоказаний [1–4]. В силу хронического характера заболевания гормональная терапия назначается длительно и может быть продлена до менопаузы, а в ряде случаев применяться и после нее при наличии клинической целесообразности [11–14]. Выбор конкретной схемы лечения зависит от потребностей пациентки, выраженности симптомов и реакции на лечение [1–9, 12–14].
Своевременное назначение рационально подобранной терапии приводит к снижению неблагоприятных проявлений эндометриоза, что благотворно сказывается на качестве жизни женщин, при этом уменьшаются негативные социальные, демографические и экономические последствия заболевания (потеря трудоспособности, снижение репродуктивного потенциала женщин, дополнительные расходы на лечение) [10, 11].
Эндометриозом страдают примерно 190 млн (10%) женщин во всем мире [10]. Несмотря на наличие международных и российских клинических рекомендаций, проблема и необходимость улучшения лечения сохраняется. Согласно исследованию UBP‑WRS, у 67% женщин с эндометриозом нарушается качество жизни, т.е. они нуждаются в терапии [10]. В России примерно 2 млн женщин, страдающих эндометриозом, примерно 1,1 млн из которых нуждается в гормональной терапии, и из них только 24% реально получают ее [10]. Причины разные: низкая информированность пациенток о заболевании, боязнь врачей и отсутствие четких алгоритмов назначения терапии, преемственности между стационарным и амбулаторным звеньями, нежелательные явления препаратов, самостоятельная отмена женщинами назначенного лечения.
Разработанные алгоритмы являются эффективным инструментом для ежедневной клинической практики врача, они позволят персонализировать терапию эндометриоза, что будет способствовать успешному ведению пациенток с симптомами и предоставит возможность внести личный вклад в общую цель национального благополучия и процветания. Врач, владеющий технологией персонализации терапии эндометриоза, может значительно улучшить качество жизни женщины и помочь ей реализовать жизненные планы. Представленные пошаговые алгоритмы отражают согласованную позицию экспертов Российского общества акушеров‑гинекологов (РОАГ) с учетом актуальных клинических рекомендаций [1–9, 15–17], передовых научных данных и реального российского клинического опыта [12, 18–23].
Оказание помощи пациенткам с эндометриозом на амбулаторном и стационарном этапах
Пациентка с жалобами, связанными с эндометриозом, чаще всего обращается в амбулаторное звено, где происходят первичная диагностика и подбор лечения. Гормональная терапия эндометриоза предлагается в качестве самостоятельного лечения либо как второй этап после операции [1–11].
В здравоохранении Российской Федерации предлагаются организационные меры по увеличению частоты приема гормональной терапии среди тех женщин, которым она показана: информирование женщин, обучение врачей, активное выявление пациентов, своевременная диагностика и выбор метода лечения, контроль за ходом лечения, составление регистров женщин, нуждающихся в терапии [10].
При наличии показаний к проведению хирургического лечения эндометриоза организация медицинской помощи пациенткам состоит из нескольких этапов (рис. 1). После амбулаторного обследования пациентка направляется в стационар для хирургического лечения по поводу эндометриоза. Далее рекомендовано амбулаторное динамическое наблюдение и гормональная терапия (рис. 1). Повышение приверженности женщин к назначенному лечению требует преемственного подхода между амбулаторным и стационарным звеньями в связи с высоким риском рецидивов заболевания.
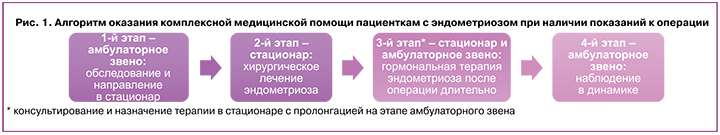
Выделяют 4 подхода для определения рецидива эндометриоза [5]: 1) на основании данных анамнеза; 2) на основании данных визуализации (УЗИ, МРТ); 3) на основании данных лапароскопической визуализации без гистологического подтверждения; 4) на основании гистологического исследования операционного материала.
Лечение эндометриоза комплексное, и включает медикаментозное и хирургическое [1–4]. Хирургическое лечение рекомендовано преимущественно с использованием лапароскопического доступа у пациенток с генитальным эндометриозом (при наличии условий и отсутствии противопоказаний) с целью определения степени распространения заболевания и удаления очагов [24–26]. Хирургический и медикаментозные методы лечения не должны противопоставляться. Преимущества и недостатки каждого метода должны быть тщательно взвешены до начала лечения с учетом индивидуальных особенностей случая. Это позволит свести до минимума отрицательные результаты и, напротив, максимально достичь положительных [27].
Проблема рецидива эндометриоза рассматривается как одна из самых сложных во всем мире [1–10, 28]. В Руководстве ESHRE по эндометриозу (2022) рецидиву посвящена отдельная глава, что подчеркивает особую важность данной проблемы [1–3]. Частота рецидивов эндометриоза после хирургического лечения составляет 15–21% через 1–2 года, 36–47% – через 5 лет и 50–55% – через 5–7 лет [11]. К рецидиву эндометриоза может привести отказ пациентки от гормональной терапии в связи с нежелательными эффектами и/или непониманием важности этапа медикаментозного лечения после операции. По данным швейцарского исследования, 39,3% женщин с эндометриозом самостоятельно отменяли прием диеногеста по причине нежелательных эффектов либо неэффективности терапии [29].
Информирование женщин до начала лечения о заболевании, необходимости продолжительной терапии, возможных нежелательных явлениях при приеме препаратов и путях решения этих проблем позволит снизить риск самостоятельного отказа от приема препаратов и последующих рецидивов эндометриоза [13, 28].
Для этого на этапе стационарного и амбулаторного звеньев для максимального снижения риска рецидивов эндометриоза целесообразно:
1. информировать пациентку о том, что эндометриоз – хроническое заболевание, обычно требующее длительного лечения до менопаузы с перерывами на реализацию репродуктивной функции и лактацию, наблюдения в динамике;
2. объяснить пациентке риски хирургического лечения, осложнений при отсутствии лечения либо отказе от приема назначенных препаратов;
3. провести беседу с пациенткой о важности послеоперационного амбулаторного этапа наблюдения и лечения с использованием гормональной терапии по показаниям;
4. максимально учесть потребности и пожелания пациентки при выборе гормональной терапии эндометриоза;
5. информировать пациентку о возможных нежелательных явлениях во время приема гормональной терапии и путях решения проблемы.
Медикаментозная терапия эндометриоза
Для купирования болевого синдрома кратковременно могут быть использованы нестероидные противовоспалительные препараты как в виде монотерапии, так и в сочетании с гестагенами. При наличии центральной сенситизации (нейропатической боли) рекомендовано использование нейромодуляторов в качестве эмпирической медикаментозной терапии (без хирургической верификации диагноза) при отсутствии кистозных форм эндометриоза и других опухолей и опухолевидных образований гениталий [4, 17, 30].
Для снижения эндометриоз‑ассоциированной боли в настоящее время применяются: гестагены, гормональные контрацептивы, агонисты или антагонисты гонадотропин‑рилизинг‑гормона (Гн‑РГ) (антагонисты не зарегистрированы в России) [1–4]. Использование даназола у пациенток с эндометриозом ограничено в связи с высокой частотой побочных эффектов [4]. При отсутствии эффекта от гормональной терапии возможно назначение ингибиторов ароматазы, в том числе в комбинации с пероральными контрацептивами, гестагенами, агонистами или антагонистами Гн‑РГ [1–3].
Следует подчеркнуть, что руководство ESHRE по эндометриозу (2022) отмечает доказанную пользу всех представленных выше гормональных препаратов [1–3].
В соответствии с позицией РОАГ (2020) комбинированные оральные контрацептивы (КОК) предназначены в первую очередь для контрацепции [4, 31] при отсутствии противопоказаний. Известно, что риск развития глубокого инфильтративного эндометриоза у женщин, ранее принимавших КОК по поводу первичной дисменореи, увеличивается [32], а большие дозы эстрогенов в КОК могут способствовать прогрессированию заболевания [33].
Согласно современным подходам, при выборе гормональной терапии рекомендовано использовать совместный подход к принятию решений, учитывать индивидуальные особенности и предпочтения женщины, нежелательные эффекты, индивидуальную эффективность, стоимость и доступность препаратов [1–3].
Наиболее часто во врачебной практике на территории РФ применяются гестагены, которые в клинических рекомендациях РОАГ (2020) относят к терапии первой линии эндометриоза и применяют в качестве гормональной терапии после хирургического вмешательства для профилактики рецидивов заболевания [4, 10]. Прием гестагенов возможен в непрерывном и пролонгированном циклическом режимах для обеспечения атрофии железистого эпителия, децидуализации стромального компонента и в циклическом режиме во вторую фазу цикла у пациенток с эндометриозом, планирующих беременность [4]. Гестагены рекомендуются экспертами ESHRE (2022) для лечения эндометриоз‑ассоциированной боли и для профилактики рецидивов после хирургического лечения [1–3].
Среди гестагенов, зарегистрированных в России для лечения эндометриоза, наиболее изучены дидрогестерон, диеногест, норэтистерон. При отсутствии значимых различий по эффективности гестагены обладают разным профилем безопасности и возможностью персонализации терапии [1–9, 14, 18, 34–36]. С учетом длительности терапии при назначении гестагенов важно учитывать их профиль безопасности, чтобы адаптировать лечение для уменьшения симптомов и улучшения качества жизни женщин [1–3].
Высокое сродство к прогестероновым рецепторам будет обеспечивать основной фармакологический эффект препарата, а при наличии связи с другими стероидными рецепторами присутствует высокий риск возникновения нежелательных явлений. Согласно опубликованным данным, аффинность дидрогестерона к прогестероновым рецепторам составляет 75%, диеногеста – 5% (рис. 2) [37]. С учетом возможного наличия прогестеронорезистентности важно, чтобы связь гестагена с прогестероновыми рецепторами была выше, чем у самого прогестерона. Основное отличие и преимущество дидрогестерона в сравнении с другими гестагенами – его высокая селективность в отношении рецепторов прогестерона, что снижает вероятность нежелательных эффектов, обусловленных взаимодействием с другими рецепторами (рис. 2) [37, 38]. Отсутствие у дидрогестерона связи с андрогенными, глюкокортикоидными, минералокортикоидными рецепторами обуславливает отсутствие у этого препарата целого ряда нежелательных реакций [37, 38].
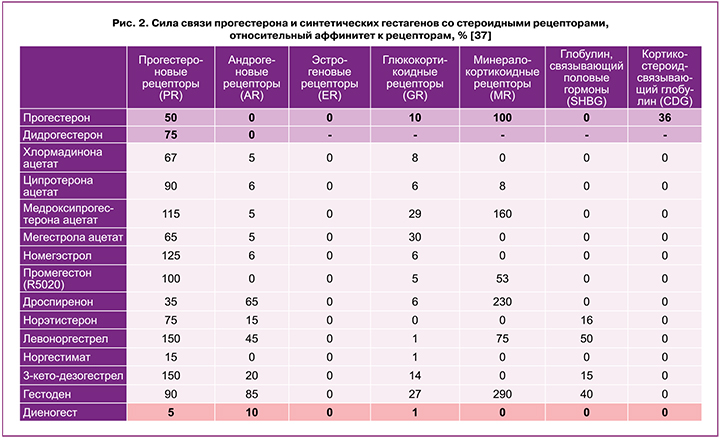
Прием гестагенов, имеющих аффинность к другим рецепторам, помимо прогестероновых, может приводить к развитию нежелательных явлений [29]. В связи с этим пациентки самостоятельно отказываются от назначенного лечения, что способствует возникновению рецидивов заболевания [26, 39]. Ряд исследователей отмечают минимальный риск рецидива боли при эндометриозе при длительной терапии гестагенами [12, 18, 21, 22, 25].
Персонализация терапии для женщин с эндометриозом будет представлена на примере дидрогестерона, который позволяет продемонстрировать алгоритмы ведения пациенток в различных клинических ситуациях. Дидрогестерон имеет несколько схем применения, что дает возможность управлять терапией, подбирать необходимые дозировки (10–30 мг), режимы (циклический, пролонгированный циклический, непрерывный) и повышать комплаентность пациенток. При этом важно отметить, что данные алгоритмы применимы к любым гестагенам, у которых зарегистрированы соответствующие схемы применения.
Ведение пациенток репродуктивного возраста с жалобами на тазовую боль, дисменорею и диспареунию
Тактика ведения пациенток репродуктивного возраста с жалобами на тазовую боль, дисменорею и диспареунию определяется позицией российских и международных экспертов в соответствии с алгоритмами, представленными на рисунке 3.
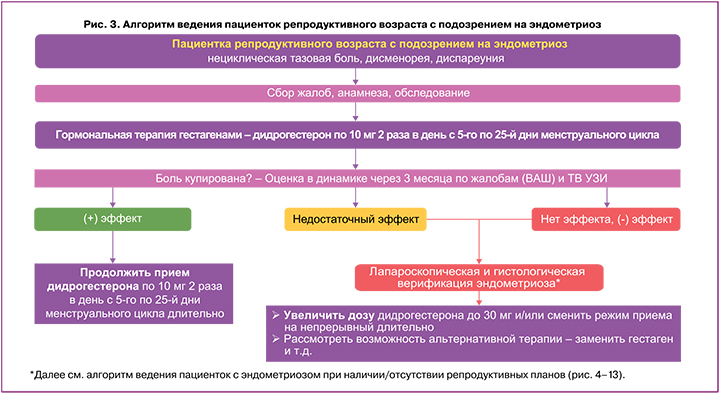
Диагноз эндометриоз устанавливается на основании жалоб и анамнеза пациенток, физикального обследования, а также данных инструментальных методов обследования (УЗИ органов малого таза, МРТ органов малого таза, диагностическая лапароскопия) [4].
Согласно Руководству ESHRE по эндометриозу (2022), лапароскопия рекомендуется пациенткам с указанными жалобами при отсутствии УЗили МР‑признаков эндометриоза, а также при отсутствии эффективности эмпирического лечения [1–3]. Лапароскопия при подозрении на эндометриоз показана: при наличии болевого синдрома, отсутствии эффекта от консервативного лечения, на этапе планирования беременности.
При наличии УЗили МР‑признаков эндометриоза у женщин репродуктивного возраста, не планирующих беременность в настоящее время, и при отсутствии показаний к хирургическому лечению возможна длительная терапия гестагенами [40].
У пациентки с подозрением на эндометриоз с хронической тазовой болью, дисменореей, диспареунией (возможно, с кровотечением и бесплодием) после тщательной оценки жалоб, физикального обследования и трансвагинального ультразвукового исследования (ТВ УЗИ), в том числе на наличие объемных образований яичников и их размеры, определяется дальнейшая тактика. При одноили двустороннем объемном образовании ≥30 мм (O‑RADS 2) рекомендовано оценить овариальный резерв и выполнить энуклеацию стенки эндометриоидной кисты после ее опорожнения и промывания полости для полного удаления патологического очага с целью морфологической верификации диагноза и уменьшения частоты рецидивирования [4], после чего следует назначить гормональную терапию с оценкой ее эффективности спустя 3 месяца в динамике по симптомам (визуальная аналоговая шкала (ВАШ)) и по данным ТВ УЗИ.
Из гестагенов пациентке репродуктивного возраста с подозрением на эндометриоз в соответствии с действующей инструкцией по медицинскому применению может быть назначен дидрогестерон по показанию «дисменорея» по 10 мг 2 раза в день с 5-го по 25-й дни менструального цикла. Если для пациентки приоритетнее контрацепция, то возможно использование КОК [4]. Контроль эффективности проводимого лечения осуществляется через 3 месяца. При положительном эффекте применения дидрогестерона рекомендуется продолжить его прием по 10 мг 2 раза в день с 5-го по 25-й дни менструального цикла длительно с перерывами на реализацию репродуктивных планов и лактацию при необходимости. В случае недостаточного эффекта или усугубления симптоматики рекомендуется лапароскопическая и гистологическая верификация диагноза эндометриоза с дальнейшим увеличением дозировки дидрогестерона до 30 мг/сут., либо смена режима приема дидрогестерона на непрерывный и увеличение дозировки до 30 мг/сут., либо замена гестагена (рис. 3).
Ведение пациенток с эндометриозом при наличии репродуктивных планов
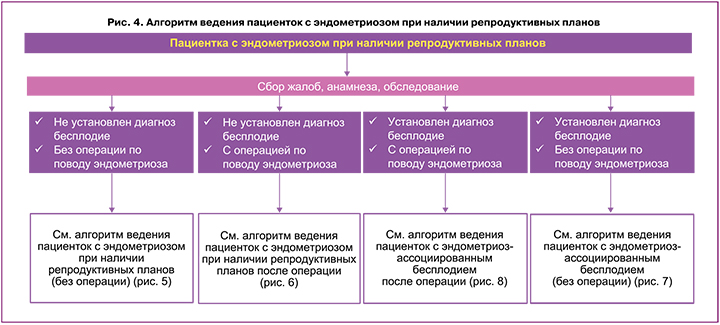
Основные вопросы, которые будут определять выбор тактики ведения пациенток с эндометриозом при наличии репродуктивных планов (рис. 4), следующие:
1) установлен ли диагноз бесплодия;
2) есть ли необходимость операции по поводу эндометриоза.
Эндометриозом страдают 25–50% инфертильных женщин, а 30–50% женщин с эндометриозом имеют бесплодие [4, 41]. Эндометриоз выявляется у 58% женщин, подвергшихся лапароскопии как конечному этапу обследования по поводу бесплодия [4, 42, 43]. Вопрос реализации репродуктивной функции в силу возраста, сопутствующих заболеваний, овариального резерва и других обстоятельств может требовать быстрого и максимально эффективного решения в короткие сроки.
Алгоритм ведения пациентки с эндометриозом при наличии репродуктивных планов без установленного диагноза бесплодия продемонстрирован на рисунках 5 и 6. Показания к хирургическому лечению у женщин с эндометриозом при наличии репродуктивных планов обсуждают с пациенткой и совместно определяют дальнейшую тактику (рис. 5, 6).
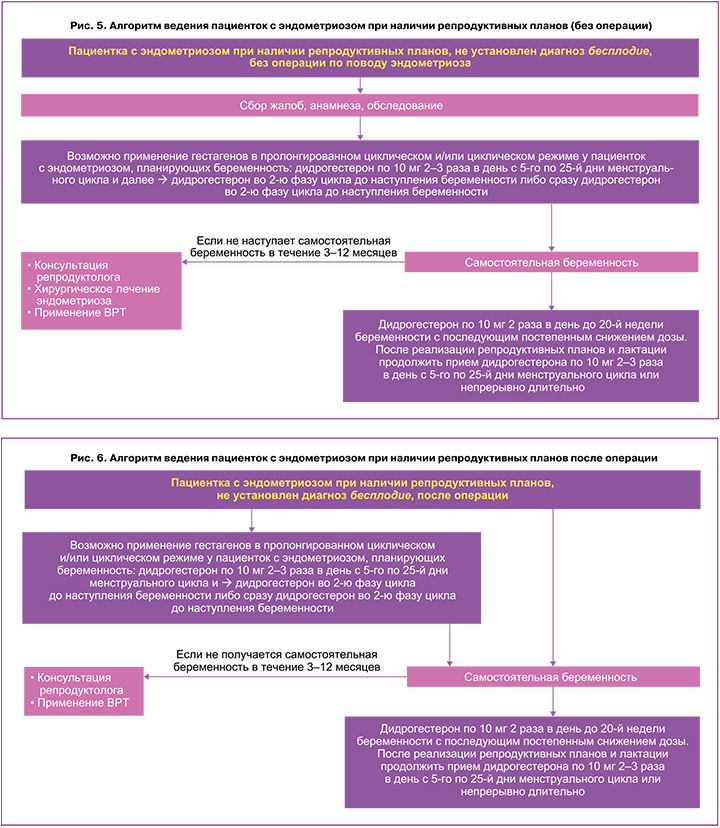
В ряде случаев при противопоказаниях, отказе от операции, либо если женщина ранее подвергалась хирургическому лечению, пациентку подготавливают для возможной самостоятельной беременности с использованием, например, дидрогестерона. Убедительных данных за супрессивную терапию эндометриоза для увеличения шансов наступления беременности в настоящее время нет [1–3], по-этому может рассматриваться вариант ведения женщины, например, на дидрогестероне в циклическом режиме для коррекции недостаточности лютеиновой фазы менструального цикла, предимплантационной подготовки эндометрия (рис. 5–8). В соответствии с клиническими рекомендациями РОАГ по эндометриозу возможно применение гестагенов в циклическом режиме во вторую фазу менструального цикла у пациенток с эндометриозом, планирующих беременность [4]. При этом в индивидуальных случаях (например, при наличии выраженного болевого синдрома, необходимости отсрочить реализацию репродуктивной функции, для дообследования женщины или партнера и др.) возможны использование дидрогестерона в пролонгированном циклическом режиме с 5-го по 25-й дни менструального цикла по 10 мг 2–3 раза в сутки для купирования симптомов, регресса эндометриоидных очагов (рис. 5–8), и далее при готовности к беременности – перевод на циклический режим для коррекции недостаточности лютеиновой фазы менструального цикла. При невозможности достижения самостоятельной беременности в течение 3–12 месяцев (в зависимости от клинической ситуации и возраста больной) рекомендовано направить пациентку к репродуктологу, принять решение о проведении хирургического лечения эндометриоза и/или применении ВРТ (рис. 5). Преимущество дидрогестерона также в том, что при беременности его прием можно продолжить по 20 мг в сутки до 20‑й недели беременности с последующим постепенным снижением дозы, а после реализации репродуктивных планов и лактации для лечения эндометриоза – по 10 мг 2–3 раза в день в пролонгированном циклическом режиме (с 5‑го по 25‑й дни менструального цикла) или непрерывном режиме (ежедневно), при этом курс целесообразен длительный – до менопаузы или дальнейшего планирования беременности.
Алгоритм ведения пациентки с эндометриозом при наличии репродуктивных планов без установленного диагноза бесплодия после операции представлен на рисунке 6. Женщинам, стремящимся забеременеть, не следует назначать послеоперационную гормональную супрессию с единственной целью повышения частоты будущих беременностей [1–4]. Тем женщинам, которые отсрочили реализацию репродуктивных планов, сразу после операции может быть предложена гормональная терапия, поскольку она не оказывает негативного влияния на фертильность и улучшает результат хирургического вмешательства [1–3]. При этом в ряде конкретных случаев возможно предложить пациентке, например, дидрогестерон в пролонгированном циклическом режиме и далее в циклическом либо сразу в циклическом для прегравидарной подготовки. При невозможности достижения самостоятельной беременности в течение 3–12 месяцев (в зависимости от клинической ситуации) рекомендовано направить пациентку к репродуктологу, принять решение о применении ВРТ (рис. 5, 6). Учитывая высокий риск выкидышей у пациенток с эндометриозом [42], преимущество дидрогестерона также в том, что при беременности его прием можно продолжить по 20 мг в сутки до 20‑й недели беременности с последующим постепенным снижением дозы, а после реализации репродуктивных планов и лактации для лечения эндометриоза – по 10 мг 2–3 раза в день в пролонгированном циклическом режиме (с 5‑го по 25‑й дни менструального цикла) или непрерывном режиме (ежедневно), при этом курс целесообразен длительный – до менопаузы или дальнейшего планирования беременности.
Бесплодие является одной из наиболее значимых жалоб при эндометриозе [1–4] и требует особой тактики ведения пациенток. Алгоритм ведения пациенток с эндометриоз‑ассоциированным бесплодием указан на рисунках 7 и 8. Показания к хирургическому лечению женщин с эндометриозассоциированным бесплодием обсуждают с пациенткой и совместно определяют дальнейшую тактику (рис. 7, 8).
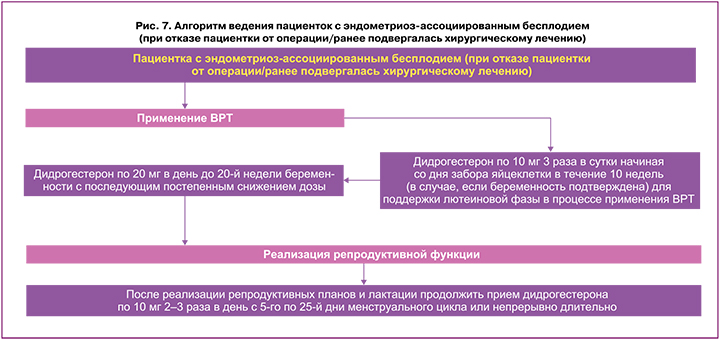
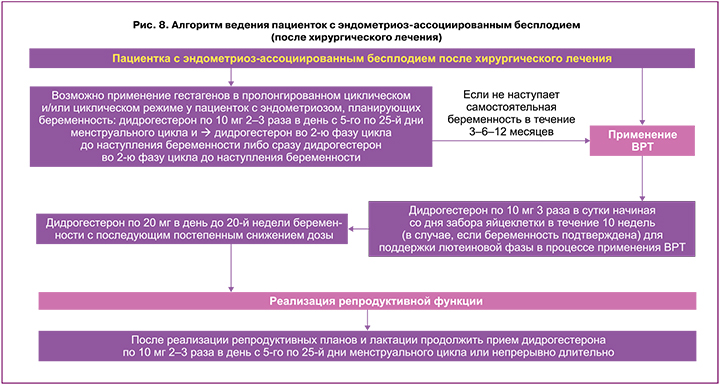
Принимать решение о проведении операции рекомендуется с учетом наличия или отсутствия болевых симптомов, возраста и предпочтений пациентки, истории предшествующих операций, наличия других факторов бесплодия, овариального резерва и расчетного индекса фертильности при эндометриозе [1–3].
В соответствии с рекомендациями РОАГ (2020) рекомендовано хирургическое лечение пациенток с бесплодием и эндометриозом при любой степени распространения процесса, так как это улучшает репродуктивный прогноз [4, 16]. Оперативное лечение рекомендуется лапароскопическим доступом при малых или умеренных формах эндометриоза, что улучшает показатели наступления беременности [4]. Врачи могут рассматривать лапароскопию для лечения бесплодия, связанного с эндометриомой, поскольку данный метод может повысить шансы пациенток на естественную беременность, хотя данные сравнительных исследований отсутствуют [1–3]. У пациенток с бесплодием при эндометриозе I/II стадии (AFS/ASRM) рекомендовано провести хирургическое удаление очагов эндометриоза в полном объеме для повышения частоты живорождения [4]. Также лапароскопия у пациенток с эндометриозом, страдающих бесплодием, позволяет расширить поиск причин бесплодия, выявить сопутствующие нарушения или заболевания (воспаление, спаечный процесс, нарушения проходимости маточных труб) и провести их коррекцию [4]. При этом удаление небольших эндометриом перед экстракорпоральным оплодотворением (ЭКО) не рекомендуется, особенно в случае повторных операций при подтвержденном диагнозе эндометриоза [1–3]. Тем не менее операция остается обязательной при наличии подозрительных результатов УЗИ и у женщин с синдромом тазовых болей. Как выжидательная, так и хирургическая тактика при эндометриоме яичника у женщин, планирующих ВРТ, имеет потенциальные преимущества и риски, которые должны быть тщательно оценены перед принятием решения. Требуется оценка овариального резерва (контроль уровня антимюллерова гормона и подсчет антральных фолликулов) перед планированием хирургического лечения у пациенток с эндометриомами яичников [4, 17].
В ряде случаев (при противопоказаниях, отказе от операции, либо если женщина ранее подвергалась хирургическому лечению) пациентку подготавливают к ВРТ и далее ведут в соответствии с алгоритмом, представленным на рисунке 7. Есть данные, что перед подготовкой пациентки с эндометриозом к ЭКО могут быть назначены агонисты Гн‑РГ с заместительной «add‑back» терапией от 3 до 6 месяцев до процедуры ВРТ, однако отсутствуют надлежащего уровня доказательства повышения вероятности наступления беременности при этом [1–4]. В процессе применения ВРТ возможно назначение дидрогестерона для поддержки лютеиновой фазы цикла по 10 мг 3 раза в сутки начиная со дня забора яйцеклетки в течение 10 недель (в случае, если беременность подтверждена) с дальнейшей пролонгацией приема дидрогестерона по 20 мг в день до 20‑й недели беременности с последующим постепенным снижением дозы. После реализации репродуктивных планов и лактации можно продолжить прием, например, дидрогестерона по 10 мг 2–3 раза в день в пролонгированном циклическом режиме (с 5‑го по 25‑й дни менструального цикла) или непрерывном режиме (ежедневно), при этом курс целесообразен длительный – до менопаузы или дальнейшего планирования беременности (рис. 7). При невозможности достижения беременности в течение от 3 до 12 месяцев (в зависимости от клинической ситуации) с помощью ВРТ или в случае невынашивания принять решение о проведении хирургического лечения эндометриоза и определить дальнейшую тактику.
Алгоритм ведения пациенток с эндометриозассоциированным бесплодием после хирургического лечения эндометриоза представлен на рисунке 8. Рекомендовано использование методов ВРТ для достижения беременности после хирургического лечения у женщин с эндометриозом 3–4‑й стадии и нарушением проходимости маточных труб независимо от возраста пациентки и фертильности мужа, при неэффективности хирургического лечения и консервативного лечения в течение 3–12 месяцев [4].
После хирургического лечения эндометриоза нужно определиться с необходимостью назначения гормональной терапии. Согласно рекомендациям РОАГ (2020) и ESHRE (2022), пациенткам с эндометриоз‑ассоциированным бесплодием не рекомендовано назначать гормональное лечение после операции в случае радикального удаления очагов для улучшения спонтанных показателей беременности [1–4]. В индивидуальных случаях, когда женщине нужно отложить реализацию репродуктивных планов по каким‑либо причинам, имеется успешная практика назначения гормональной терапии сразу после операции, поскольку она не оказывает негативного влияния на фертильность и улучшает результат хирургического вмешательства [1–3].
Высокая эффективность комбинированного лечения эндометриоз‑ассоциированного бесплодия (операция + дидрогестерон) предоставляет возможность получить долгожданную беременность более чем у 80% пациенток [12]. Для лечения эндометриоза целесообразны методы, которые могут эффективно лечить заболевание или контролировать его без ингибирования овуляции, тем самым позволяя желающим беременность во время терапии [1–3, 44].
Механизм действия дидрогестерона отличается от механизма действия других гестагенов тем, что в терапевтических дозах он не подавляет овуляцию и поэтому является единственным гестагеном, который подходит для пациенток с эндометриозом, планирующих беременность [37, 38, 42, 45, 46]. Ранее считалось, что подавление овуляции, которое обеспечивают КОК, является необходимым в терапии эндометриоза. Исследование, проведенное Santulli Р. et al., показало, что олиго‑ановуляция встречается с равной частотой у пациенток с эндометриозом и без него [47]. Следовательно, данные результаты отклоняют интуитивную веру, что олиго‑ановуляция может обеспечивать некоторую защиту от эндометриоза [47].
В силу того, что эндометриоз является одной из распространенных причин бесплодия и невынашивания беременности, целесообразен прием гестагенов во время беременности [12–14, 45, 46]. После реализации репродуктивной функции терапия эндометриоза дидрогестероном может быть продолжена.
Высказаны предположения о пользе назначения дидрогестерона в лютеиновую фазу при эндометриоз‑ассоциированном бесплодии [48] с повышением вероятности наступления беременности [12, 49, 50]. Дидрогестерон доказанно снижает риск спорадического и привычного самопроизвольного патологического прерывания беременности при недостаточности лютеиновой фазы. Его прием целесообразен во время беременности, так как при эндометриозе риск самопроизвольного патологического прерывания беременности повышен в 1,7–3,0 раза [45, 46, 50].
Пациенткам с бесплодием на фоне эндометриоза, планирующим беременность, после операции циклический режим приема дидрогестерона во вторую фазу менструального цикла может помочь получить долгожданную возможность реализовать репродуктивные планы самостоятельно или с помощью ВРТ [12].
Ведение пациенток с эндометриозом при отсутствии репродуктивных планов
Алгоритм ведения пациентки при отсутствии репродуктивных планов с эндометриозом/подозрением на эндометриоз представлен на рисунке 9.
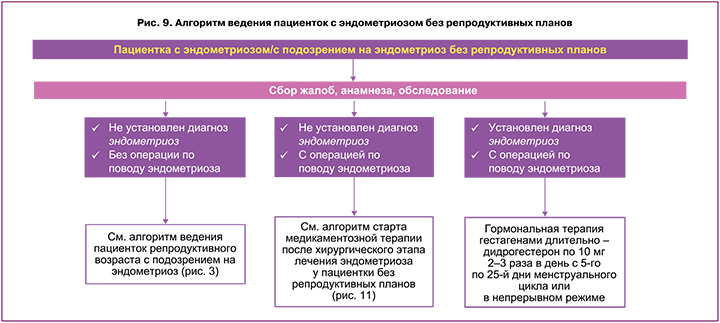
Основные вопросы, которые определяют тактику ведения пациенток с эндометриозом после хирургического этапа без репродуктивных планов:
1) необходимость назначения агонистов Гн‑РГ;
2) выбор гестагена.
После хирургического лечения эндометриоза в ряде случаев возникает вопрос необходимости назначения агонистов Гн‑РГ. Агонисты Гн‑РГ могут быть использованы в течение нескольких месяцев до гестагенов [14, 51, 52] или чередоваться с приемом гестагенов при недостаточном купировании болевого синдрома или некупирующихся кровотечениях в комбинации с «add‑back» терапией для предотвращения нежелательных явлений у пациенток, не отвечающих на гестагены или другую гормональную терапию и избегающих операции в связи с высоким хирургическим риском [1–4, 14]. Эксперты ESHRE и РОАГ рекомендуют рассмотреть возможность назначения «add‑back» терапии наряду с терапией агонистами Гн‑РГ для предотвращения таких нежелательных явлений, как потеря костной массы и симптомы гипоэстрогении [1–4].
После отмены агонистов Гн‑РГ перед врачом встает вопрос выбора препарата для дальнейшего лечения, как правило, гестагена. Чаще всего это происходит через 3–6 месяцев. Алгоритм перехода гормональной терапии эндометриоза с агонистов Гн‑РГ на гестагены (рис. 10) позволит получить максимальный результат от проводимого лечения. В настоящее время наиболее часто в реальной практике используется последовательный переход с агонистов Гн‑РГ на гестагены (рис. 10a). При этом нужно учесть ряд рисков. В момент перехода с агонистов Гн‑РГ на гестагены есть высокий риск перерыва в лечении и, как следствие, рецидива боли, снижения эффективности проводимого лечения. Возможна тактика с «перекрытием» агонистов Гн‑РГ дидрогестероном (рис. 10b). Терапия не прерывается, нивелируется риск перерыва в момент перехода с агонистов Гн‑РГ на гестагены, и, как следствие, отсутствует/минимизирован риск рецидива боли, повышается эффективность проводимого лечения.
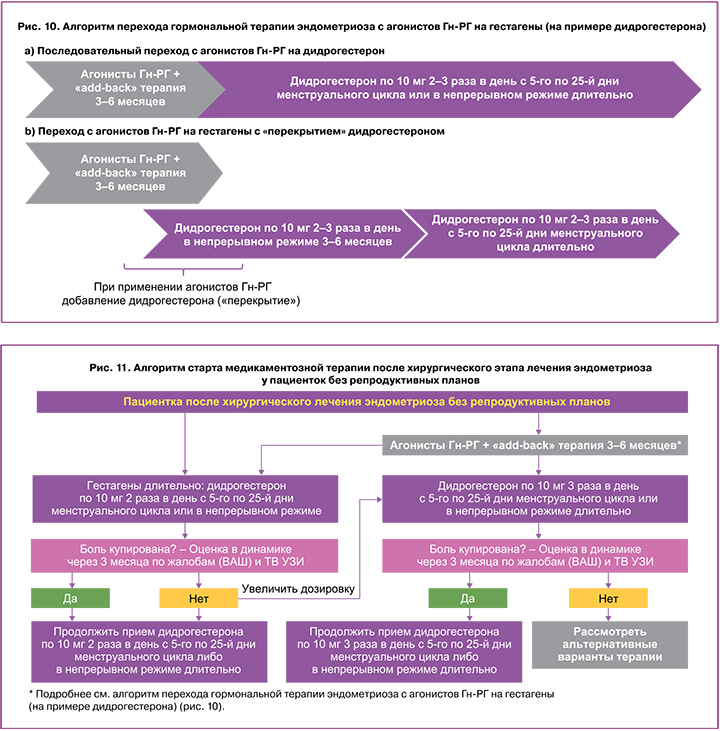
В связи с тем что терапия агонистами Гн‑РГ ограничена по времени, а эндометриоз имеет хроническое течение, важно изначально ориентироваться на первую линию терапию заболевания – гестагены, а в случае необходимости назначения агонистов Гн‑РГ далее подобрать для пациентки оптимальный гестаген на длительный срок с возможностью реализовать успешно репродуктивные планы, если они появятся.
Вопрос выбора гестагена (дидрогестерон, диеногест, норэтистерон) при эндометриозе определяется с учетом следующих факторов: высокая эффективность, надежный профиль безопасности при длительном применении, возможность персонализации терапии. Дидрогестерон достоверно эффективен и безопасен в двух схемах терапии (пролонгированной циклической и непрерывной) в отношении уменьшения хронической тазовой боли и дисменореи, что в рамках исследования ОРХИДЕЯ привело к заметным улучшениям всех изученных параметров, связанных с качеством жизни и сексуальным благополучием [18]. У пациенток, получавших дидрогестерон в течение 6 месяцев, значительно сокращалось количество дней, в течение которых требовались анальгетики [18]. На сегодняшний день большинство пациенток желают сохранить менструацию на весь период лечения эндометриоза [13]. Исследование ОРХИДЕЯ демонстрирует, что длительность менструального цикла статистически значимо не менялась во время терапии дидрогестероном как при непрерывном, так и при пролонгированном циклическом режиме [18]. Таким образом, дидрогестерон соответствует современным требованиям терапии эндометриоза и учитывает пожелания большинства женщин.
Стартовая дозировка дидрогестерона после может быть минимальной – 20 мг в сутки, режим приема – в зависимости от потребности пациентки непрерывным или пролонгированным циклическим. При оценке болевого синдрома в динамике через 3 месяца (по шкале ВАШ), а также по результатам ТВ УЗИ в любой момент дозировка дидрогестерона может быть повышена до 30 мг/сут., также можно сменить режим. Если боль купирована, то рекомендовано продолжать прием дидрогестерона по подобранной схеме и дозировке длительно (рис. 11). При необходимости изменения дозировки и режима это можно реализовать без дополнительных обследований. При отсутствии положительной динамики необходимо продолжить поиск оптимальной терапии (рис. 11).
Высокая эффективность, надежный профиль безопасности дидрогестерона при эндометриозе и наличие разных схем его применения дают возможность варьировать зарегистрированными дозировками (10–30 мг), режимами (непрерывный, пролонгированный циклический, циклический) в зависимости от потребностей врача и пациентки [12, 18]. Все это позволяет подобрать адекватную дозу и режим для купирования боли, ассоциированной с эндометриозом, и снизить риск возникновения нежелательных явлений, в том числе избежать прорывных кровотечений [13].
Ведение пациенток с эндометриозом при необходимости смены терапии
Частота развития нежелательной лекарственной реакции, такой как «маточные кровотечения», у пациенток будет зависеть от режима терапии гестагенами [19, 53]. Дидрогестерон предоставляет врачам и пациенткам возможность минимизировать риск прорывных кровотечений за счет зарегистрированного пролонгированного циклического режима с 5‑го по 25‑й дни менструального цикла и разных дозировок [18]. В масштабном многоцентровом исследовании по применению дидрогестерона у пациенток с эндометриозом ОРХИДЕЯ (2018– 2020 гг.) не было отмечено ни одного случая маточного кровотечения в группе пролонгированного циклического режима 0/273 (0,0%) [18]. При непрерывном приеме гестагенов возможны нерегулярные кровотечения в первые 3 месяца лечения примерно у 20% пациенток [54]. Аномальное маточное кровотечение может потребовать дальнейшего обследования с помощью ТВ УЗИ, физикального и лабораторного обследования, включая скрининг на инфекции, передающиеся половым путем, такие как Chlamydia trachomatis [15, 55].
При ведении пациентки с эндометриозом важно проинформировать ее о возможном кровотечении на фоне приема гестагенов, изменении характера кровотечений. В этом случае женщине целесообразно обратиться к врачу. Пациентке важно объяснить, что кровотечение при приеме гестагенов не является признаком недостаточной эффективности терапии или рецидивом заболевания. Низкая сонографическая толщина эндометрия будет свидетельствовать о возможной атрофии. В этом случае показан перерыв на 5–7 дней для восстановления эндометрия, также возможно краткосрочное применение 1 мг перорального или трансдермального эстрадиола (5–7 дней) [56]. Сохранение аномального маточного кровотечения должно побудить к дальнейшим исследованиям для исключения другой патологии матки, помимо эндометриоза [56].

При развитии кровотечения на диеногесте в течение 3–6 месяцев после обследования (физикального и лабораторного, ТВ УЗИ) и при исключении другой патологии пациентка может быть переведена на дидрогестерон, поскольку наличие у диеногеста только непрерывного режима ограничивает его возможности с точки зрения преодоления ряда нежелательных эффектов. Переход с непрерывной схемы лечения гестагена на пролонгированный циклический режим осуществляется с началом нового менструального цикла: дидрогестерон по 10 мг 2–3 раза в день с 5‑го по 25‑й дни менструального цикла длительно. При желании пациентки реализовать репродуктивные планы можно перевести ее на циклический режим приема дидрогестерона во вторую фазу (подробнее см. рис. 4).
На рисунке 13 представлен алгоритм ведения женщин с кровотечением на фоне приема гестагенов при лечении эндометриоза на примере дидрогестерона. Пациентке с эндометриозом при кровотечении на непрерывном режиме дидрогестерона в дозировке 20 мг/сут. после обследования (физикального и лабораторного, ТВ УЗИ) и при исключении другой патологии можно продолжить прием данного препарата и рассмотреть несколько вариантов лечения (рис. 13а):
1) оставить текущий непрерывный режим дидрогестерона, увеличив дозировку до 30 мг/сут.;
2) сменить режим дидрогестерона на пролонгированный циклический с 5‑го по 25‑й дни менструального цикла, дозировка та же, 20 мг/сут.;
3) сменить режим дидрогестерона на пролонгированный циклический с 5‑го по 25‑й дни менструального цикла и увеличить дозировку до 30 мг/сут.
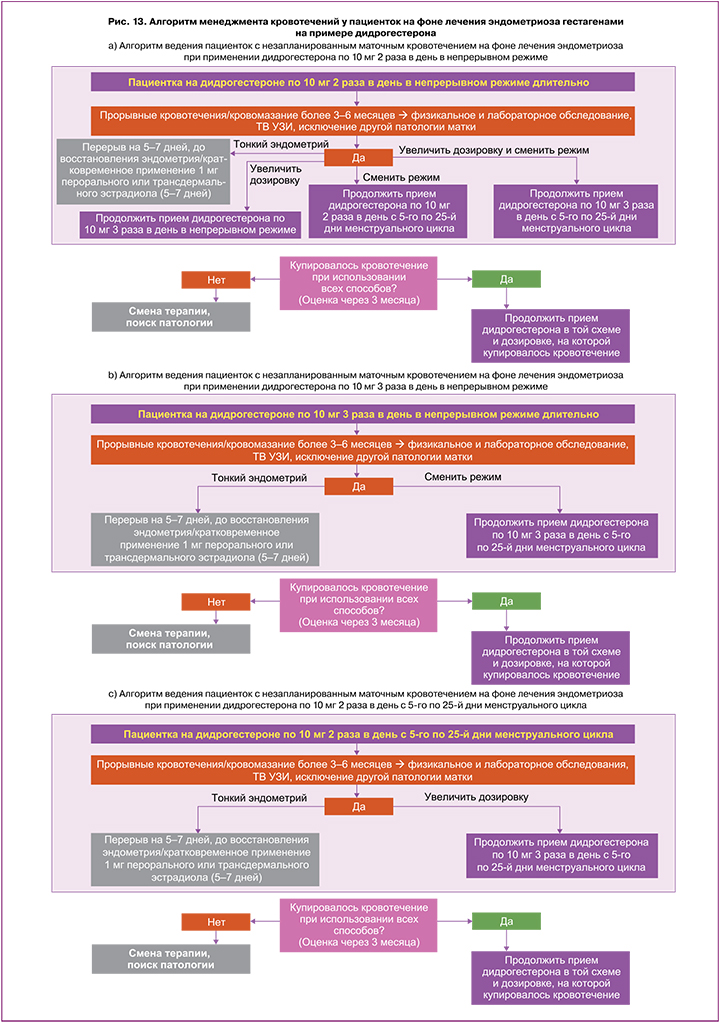
Если кровотечение наблюдается на фоне непрерывного режима дидрогестерона в дозировке 30 мг/сут., то можно сменить режим на пролонгированный циклический с 5‑го по 25‑й дни менструального цикла при сохранении дневной дозировки (30 мг/сут.) (рис. 13b).
Если кровотечение наблюдается на фоне приема дидрогестерона с 5‑го по 25‑й дни менструального цикла в дозировке 20 мг/сут., то можно увеличить дозировку до 30 мг/сут. (рис. 13c).
В течение 3–6 месяцев лечения необходимо оценить клиническую ситуацию и состояние пациентки. Если кровотечение купировалось, то необходимо продолжить прием дидрогестерона в подобранной схеме. При продолжающихся кровотечениях необходимо провести поиск патологии эндометрия, при отсутствии таковой – сменить терапию (рис. 13).
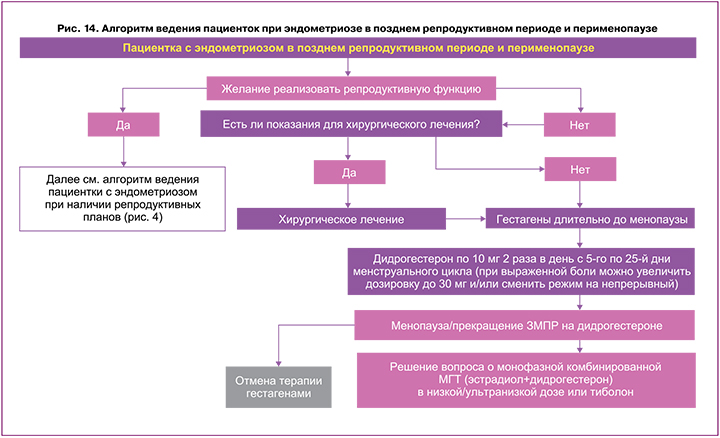
Ведение пациенток с эндометриозом в позднем репродуктивном периоде, пери- и постменопаузе
Частота выявления эндометриоза у женщин в постменопаузе составляет 2–5% [57, 58]. Алгоритм ведения пациенток при эндометриозе в позднем репродуктивном периоде и перименопаузе (рис. 14) предоставляет врачу план действий в соответствующей клинической ситуации. Врачу при ведении пациенток в постменопаузе следует учитывать риск малигнизации, а также возможность назначения менопаузальной гормональной терапии (МГТ) при наличии показаний [4]. При наличии бесплодия у женщин в позднем репродуктивном периоде или перименопаузе целесообразно применять тактику лечения в соответствии с алгоритмами ведения пациенток с эндометриоз‑ассоциированным бесплодием (рис. 4). Также необходимо определиться, есть ли у пациентки показания к хирургическому лечению эндометриоза. После проведенной операции или при отсутствии показаний к хирургическому лечению назначается гормональная терапия гестагенами длительно – до наступления менопаузы/прекращения закономерной менструальноподобной реакции (ЗМПР) в случае циклического приема гестагенов. В данном случае предпочтителен дидрогестерон по 10 мг 2 раза в день с 5‑го по 25‑й дни менструального цикла, при выраженной боли можно увеличить дозировку до 30 мг в сутки.
В постменопаузе при наличии показаний и отсутствии противопоказаний к МГТ возможно решить вопрос о назначении монофазной комбинированной МГТ (например, эстрадиол + дидрогестерон) в низкой или ультранизкой дозе или тиболона (рис. 14–16). Описаны случаи появления очагов/симптоматики/рецидивов эндометриоза в пери- и постменопаузе как в случае использования МГТ, так и без нее, а также примеры впервые диагностированного эндометриоза. При выявлении эндометриоидных кист яичника и экстрагенитальных форм заболевания следует проявлять онкологическую настороженность [4, 59].
Согласно клиническим рекомендациям РОАГ (2020) по эндометриозу, рекомендовано хирургическое лечение женщин с эндометриозом любой локализации, особенно при наличии объемных образований гениталий, при возможности лапароскопическим доступом, у пациенток в постменопаузе как с целью ликвидации самого объемного образования, так и для исключения онкологических заболеваний [4].
Лечение пациенток в случае появления очагов/ симптоматики/рецидивов эндометриоза в пери- или постменопаузе и алгоритм врачебной тактики представлены на рисунке 16. Следует помнить, что при персистировании эндометриоза в постменопаузе повышается риск малигнизации, что требует безотлагательного оперативного лечения [4]. Если рецидив возникает на фоне МГТ, то следует отменить терапию и при отсутствии эффекта решить вопрос о хирургическом лечении эндометриоза. При невозможности проведения операции в перименопаузе возможно назначение агонистов Гн‑РГ либо гестагенов (дидрогестерон по 10 мг 2 раза в день с 5‑го по 25‑й дни менструального цикла, при выраженной боли можно увеличить дозировку до 30 мг), в постменопаузе – ингибиторов ароматазы с обязательным наблюдением пациентки в динамике (рис. 14–16).
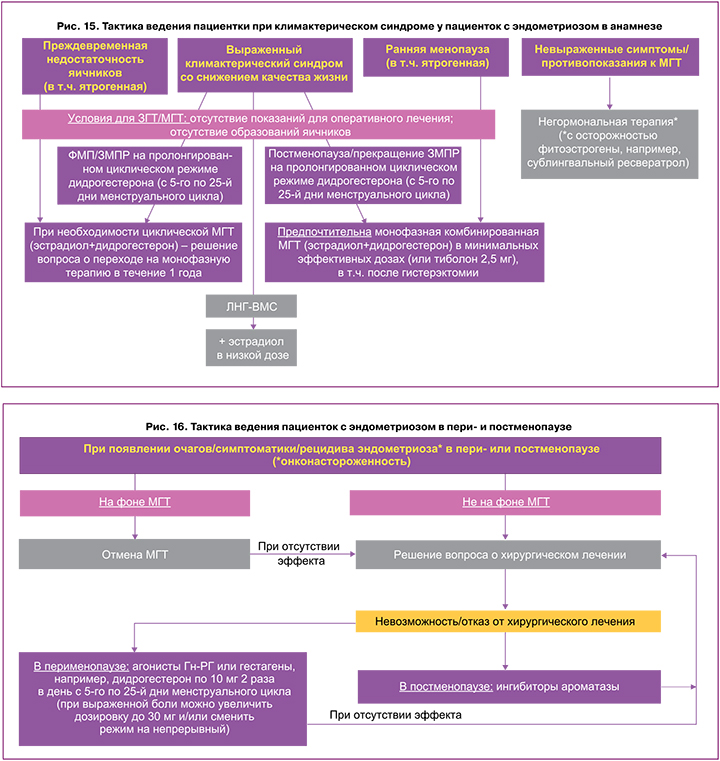
Алгоритм действий врача при развитии климактерического синдрома у пациенток с эндометриозом в анамнезе предложен на рисунке 15. В зависимости от клинической картины, анамнеза, выраженности проявлений менопаузы определяются дальнейшая тактика и возможности использования гормональной терапии. Врачам следует избегать назначения схем, содержащих только эстрогены, для лечения вазомоторных симптомов у женщин в постменопаузе с эндометриозом в анамнезе, поскольку данные схемы могут быть связаны с более высоким риском злокачественной трансформации [1–4]. Согласно позиции ESHRE (2022), у тиболона нет преимуществ перед комбинированной монофазной МГТ [1–3]. Контроль УЗИ органов малого таза в течение всего периода лечения осуществляется через 3, 6, 12 месяцев.
Заключение
Эндометриоз – хроническое заболевание, цель лечения которого состоит в том, чтобы добиться купирования болевого синдрома, улучшения репродуктивного здоровья и качества жизни пациенток. Пациенткам необходима длительная персонифицированная медикаментозная терапия в зависимости от возраста, репродуктивных мотиваций и клинических проявлений. В настоящее время наилучшими из доступных средств являются гормональные препараты. Терапией выбора при эндометриозе в зарубежных и российских рекомендациях являются гестагены.
Алгоритмы – один из ключевых и удобных форматов представления медицинской информации, так как четкое понимание схемы действий врача в той или иной клинической ситуации помогает осуществлять выбор лечения для максимально эффективного результата.
Представленные алгоритмы ведения пациенток с эндометриозом являются совместной позицией ведущих экспертов нашей страны в области гинекологии и разработаны на основании современных отечественных и зарубежных данных и актуальных клинических рекомендаций.
Данные алгоритмы помогут улучшить клинические подходы к ведению пациенток с эндометриозом в ежедневной практике каждого врача. Это будет способствовать поддержанию качества жизни и репродуктивного здоровья женщин, оказывая значительное влияние на предотвращение медикодемографических, социальных и экономических потерь в России. По мере появления новых международных рекомендаций и научных исследований представленные алгоритмы будут дополнены и обновлены. Разработчики алгоритмов всегда рады поступающим предложениям для дальнейшего совершенствования документа.



