Ранний старт менопаузальной гормональной терапии в соответствии с теорией эуэстрогенемии
Данные клинических и фундаментальных исследований показали, что эстрогены играют важную роль в контроле гомеостаза, являясь ключевыми регуляторами метаболических процессов в организме. Это легло в основу теории эуэстрогенемии (life-long euestrogenemia) [3]. Суть концепции эуэстрогенемии состоит в том, что эстрогеновые рецепторы (ЭР) широко представлены в большинстве органов и тканей (подтверждено около 3600 эстрогеновых сигнальных путей), поэтому поддержание соответствующих уровней эстрогенов необходимо для оптимальной функции ЭР.
ЭР хорошо отвечают на эстрогены, назначенные после краткого периода абстиненции, однако после продолжительного «бездействия» в условиях гипоэстрогенемии так называемая «ре-эстрогенизация» с помощью экзогенных эстрогенов может оказаться невозможной [4].
В рамках концепции эуэстрогенемии большой интерес представляют результаты некоторых исследований последних лет, касающиеся изменений вазомоторной регуляции, композиционного состава тела, дебюта и/или прогрессирования остеопороза и других метаболических нарушений, лежащих в основе развития будущих болезней, связанных со старением.
Это заставляет еще раз критически рассмотреть временные рамки для начала гормональной терапии, когда еще возможно получение протективного эффекта в отношении неблагоприятных изменений в экспрессирующих ЭР органах и системах организма, что может послужить основой здорового долголетия современных женщин [5].
Miller и соавт. выдвинули гипотезу, согласно которой происходящие в переходный период гормональные изменения помогают обнаружить индивидуальные различия в вегетативных нейро-сосудистых регулирующих механизмах, которые могут иметь генетическую основу или приобретаются в течение жизни женщины и при этом коррелируют с динамикой клинических проявлений старения в целом, что, по их мнению, согласуется с концепцией эуэстрогенемии [6].
В выполненных в Австралии, Великобритании и США исследованиях четко прослеживаются четыре возможные траектории развития вазомоторных проявлений у отдельных женщин. Такую закономерность невозможно объяснить исключительно социально-экономическими или культурными факторами, по-видимому, в ее основе лежат биологические причины: генетические варианты, характеризующие отличия в процессах синтеза эстрогенов и работе их сигнальных путей, помимо возможных особенностей генов, контролирующих катехоламинергические сигнальные пути в ЦНС, связанные с разворачиванием клинической картины прилива [7].
Концентрация эстрогенов постепенно уменьшается в перименопаузе, и уже в этот период появляются первые клинические признаки «старения» репродуктивной системы (приливы, ночная потливость, психоэмоциональные нарушения, изменение композиционного состава и пропорций тела). Эти признаки служат своеобразным маркером постепенного угасания функции яичников, несмотря на регулярный менструальный цикл, и существенно снижают качество жизни.
МГТ является наиболее эффективным методом лечения вазомоторных и других менопаузальных симптомов у женщин в отсутствие противопоказаний [8]. Как уже отмечалось, эстрогены относятся к разряду плейотропных, т.е. обладающих множественными эффектами гормонов, важных для нормального функционирования многих органов и тканей, а не только для осуществления репродуктивной функции. МГТ, назначенная в рамках терапевтического «окна возможностей», может обеспечить профилактические эффекты в отношении ряда хронических заболеваний старения, что полностью отвечает концепции эуэстрогенемии.
Влияние эстрогенов на стенку артерий меняется в зависимости от стадии старения репродуктивной системы и степени субклинического атеросклероза [9]. Положительное влияние своевременного старта МГТ на сердечно-сосудистую систему было подтверждено в исследованиях ELITE Trial и MESA Trial [10, 11]. С получением убедительных доказательств комплексного благоприятного влияния МГТ при своевременном назначении в рамках терапевтического «окна возможностей» (у женщин в возрасте до 60 лет или в течение 10 лет постменопаузы) потенциальная польза МГТ является очевидной [11–13].
Для оценки «окна терапевтических возможностей» при принятии решения о назначении МГТ важно учитывать 2 ключевых фактора: возраст женщины на момент обращения и длительность постменопаузы. Оптимальным временем начала МГТ у женщин является возраст до 60 лет и длительность постменопаузы до 10 лет [8].
Ранний старт МГТ может быть рассмотрен в случае аменореи у женщин с наличием вазомоторных симптомов в возрасте ≥45 лет. У женщин моложе 45 лет с наличием олиго-/аменореи в течение 4–6 месяцев и наличием/отсутствием вазомоторных симптомов рекомендовано проведение гормонального обследования: ФСГ двукратно с перерывом 4–6 недель, ТТГ, пролактин. При показателях ФСГ >25 МЕ/л может быть рассмотрен вопрос о назначении МГТ [14].
Алгоритм выбора менопаузальной гормональной терапии при старте терапии, перевод с циклической на непрерывную форму терапии
Индивидуальный подход к каждой пациентке является приоритетным при выборе тактики лечения климактерических расстройств. Учитывая современную концепцию персонализации МГТ, врач при выборе терапии должен соблюдать следующие принципы [8].
1. Учитывать профиль безопасности составляющих компонентов используемого препарата.
2. Персонифицировать МГТ с учетом факторов риска сердечно-сосудистых заболеваний (ССЗ), рака молочной железы и постменопаузального остеопороза, наличия коморбидных состояний у женщины, что включает:
- подбор минимальной эффективной дозировки;
- определение лекарственной формы препаратов МГТ;
- использование режима терапии с учетом возраста, стадии репродуктивного старения (STRAW +10) и потребностей пациентки.
Применение МГТ требует периодической коррекции дозировок в зависимости от стадии репродуктивного старения, возраста, эффективности и переносимости лечения, что позволяет:
1. эффективно купировать симптомы климактерического синдрома;
2. уменьшить/отсрочить развитие отдаленных последствий дефицита эстрогенов;
3. снизить возможные риски и нежелательные явления на фоне проводимой терапии.
 У женщин с интактной маткой требуется назначение комбинированной гормональной терапии, включающей эстрогенный и гестагенный компоненты. Гестагены в данном случае выполняют роль защиты эндометрия от пролиферативного воздействия эстрогенов, нивелируя риск гиперпластических процессов эндометрия. Женщинам, перенесшим гистерэктомию, назначают монотерапию эстрогенами в непрерывном режиме (за исключением случаев оперативного лечения по поводу эндометриоза, когда назначается комбинированная эстроген-гестагенная МГТ или тиболон).
У женщин с интактной маткой требуется назначение комбинированной гормональной терапии, включающей эстрогенный и гестагенный компоненты. Гестагены в данном случае выполняют роль защиты эндометрия от пролиферативного воздействия эстрогенов, нивелируя риск гиперпластических процессов эндометрия. Женщинам, перенесшим гистерэктомию, назначают монотерапию эстрогенами в непрерывном режиме (за исключением случаев оперативного лечения по поводу эндометриоза, когда назначается комбинированная эстроген-гестагенная МГТ или тиболон).
В настоящее время в России зарегистрированы следующие комбинации эстрогенов и гестагенов для терапии климактерических расстройств у женщин с интактной маткой [15]:
- комбинации для циклического приема: эстрадиол валерат 2 мг + левоноргестрел 0,15 мг; эстрадиол 2 мг или 1 мг + дидрогестерон 10 мг; эстрадиола валерат 2 мг + медроксипрогестерон 10 мг; эстрадиола валерат 2 мг + ципротерон ацетат 2 мг;
- комбинации для непрерывного приема: эстрадиол 1 мг или 0,5 мг + дидрогестерон 5 мг или 2,5 мг соответственно; эстрадиол 1 мг или 0,5 мг + дроспиренон 2 мг или 0,25 мг соответственно.
Персонализация МГТ для женщин с интактной маткой будет представлена на примере линейки препаратов, содержащих комбинации эстрадиола и дидрогестерона, которая позволяет продемонстрировать алгоритм ведения пациенток в различные периоды климактерия, так как является наиболее широкой и представлена различными формами и дозировками, что дает возможность управлять терапией, меняя дозировку и режим без смены действующих компонентов, что повышает комплаентность (табл. 1). Эти алгоритмы применимы к любым представленным выше препаратам.
Выбор терапии
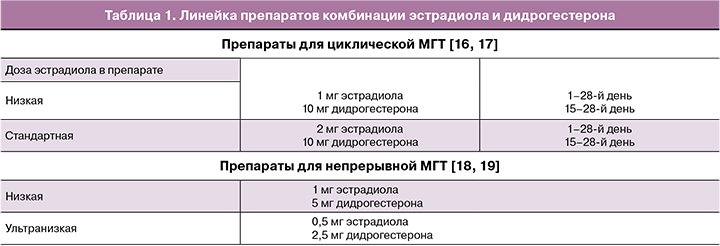
 Старт в перименопаузе
Старт в перименопаузе
Для женщин в перименопаузе рекомендовано стартовать с циклической низкодозированной терапии – например, 1 мг эстрадиола/10 мг дидрогестерона. Эффект лечения оценивают индивидуально через 1–2 месяца, и в случае сохранения симптомов возможно перейти на стандартную дозу комбинированного препарата, содержащего 2 мг эстрадиола (рис. 1).
Пациенткам с ранней менопаузой (возраст наступления менопаузы 40–44 лет) или преждевременной менопаузой (возраст до 40 лет), в случае преждевременной недостаточности яичников (ПНЯ) гормональную терапию начинают со стандартной дозы перорального гормонального препарата в циклическом режиме, содержащего эстрадиола 2 мг/дидрогестерона 10 мг, а при недостаточном клиническом эффекте через 1–2 месяца, в случае сохранения климактерических симптомов, рекомендуется рассмотреть вопрос о переходе на высокую дозу МГТ в циклическом режиме, содержащую эстрадиола 4 мг/дидрогестерона 20 мг в сутки [20].
При приеме женщиной МГТ в стандартной дозе (эстрадиол 2 мг/дидрогестерон 10 мг) как при первичном назначении, так и после перехода с низкодозированного препарата (1 мг эстрадиола/10 мг дидрогестерона), рекомендовано через 1–2 месяца оценить эффективность (уменьшение/исчезновение вазомоторных симптомов, улучшение сна, настроения и др.) и переносимость лечения (например, возникновение отеков, мастодинии и др.).
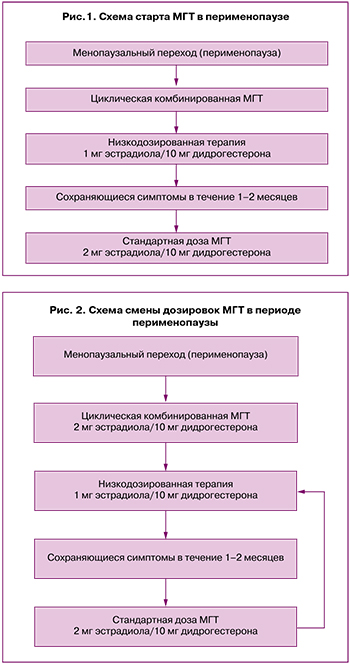
При возникновении нежелательных эффектов, связанных с дозой эстрогена в составе МГТ (отеков, мастодинии), через 1–2 месяца рассмотреть вопрос о снижении дозы эстрогена, перейдя на низкодозированный препарат в циклическом режиме (эстрадиол 1 мг/дидрогестерон 10 мг), с целью применения минимально эффективной дозы (рис. 2).
После старта и применения циклической комбинированной МГТ женщинам может потребоваться переход на непрерывную комбинированную МГТ в следующих ситуациях:
Через 1–2 года приема низкодозированной МГТ в циклическом режиме при возрасте женщины на момент начала терапии старше 50 лет.
По достижении пациенткой среднего возраста менопаузы (51–52 года), при начале использования МГТ до 50 лет.
При изменении характера менструальноподобной реакции: скудные мажущие выделения/полное отсутствие в течение 2 последовательных циклов.
При желании пациентки прекратить менструальноподобную реакцию после приема низкодозированной циклической МГТ (1 мг эстрадиола/10 мг дидрогестерона) в течение не менее 12 месяцев (во избежание прорывных кровотечений) [21, 22].
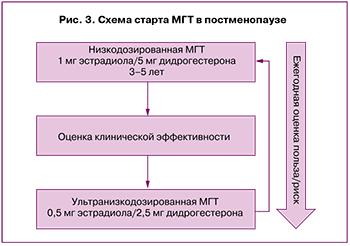 Старт терапии в постменопаузе
Старт терапии в постменопаузе
Женщинам в постменопаузе (≥12 месяцев после последней менструации) рекомендуется использовать комбинированную МГТ в монофазном режиме и стартовать с низкодозированного препарата, содержащего в качестве эстрогенного компонента 1 мг эстрадиола (например, эстрадиол 1 мг/дидрогестерон 5 мг). На фоне МГТ проводятся ежегодное обследование пациентки и оценка польза/риск продолжения лечения.
Через 3–5 лет приема низкодозированной комбинированной МГТ в монофазном режиме возможен переход на ультранизкодозированный препарат (например, эстрадиол 0,5 мг/дидрогестерон 2,5 мг) (рис. 3).
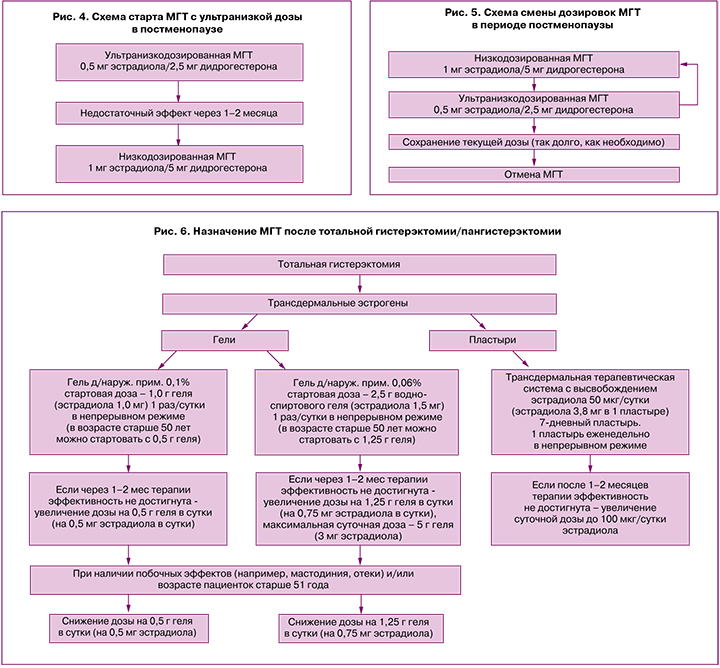
Женщинам в постменопаузе также возможно стартовать с ультранизкой дозы МГТ.
При этом следует учитывать, что ультранизкодозированная терапия не имеет показания «профилактика остеопороза» [21, 22]. Кроме того, важно отметить, что женщинам с индексом массы тела (ИМТ) более 30 кг/м2, длительностью менопаузы <5 лет, в возрасте <55 лет ультранизкой дозы МГТ (эстрадиол 0,5 мг/дидрогестерон 2,5 мг) может быть недостаточно для достижения полного клинического эффекта, поэтому через 1–2 месяца после начала лечения возможно рассмотреть вопрос о повышении дозы препарата и переходе на низкодозированную МГТ (эстрадиол 1 мг/дидрогестерон 5 мг) [23] (рис. 4).
На фоне приема МГТ пациенткам проводят ежегодную оценку риск/польза и рассматривают вопросы о продолжении лечения, переводе пациентки на ультранизкодозированный препарат либо о прекращении лечения.
Длительность терапии не ограничена конкретным сроком и определяется индивидуально в зависимости от целей лечения, его эффективности и переносимости пациенткой с ежегодной оценкой польза/риск (рис. 5).
МГТ после тотальной гистерэктомии
У женщин в возрасте ≤50–51 года после гистерэктомии/пангистерэктомии для коррекции климактерических симптомов и/или профилактики остеопороза предложено рассмотреть терапию моноэстрогенами в пероральной или трансдермальной форме приема (в виде пластыря или геля) (за исключением случаев эндометриоза, когда назначается комбинированная эстроген-гестагенная МГТ или тиболон).
В настоящее время в России зарегистрированы следующие препараты эстрогенов [15]:
- пероральные эстрогены: эстрадиола валерат 2 мг;
- трансдермальные эстрогены: трансдермальная терапевтическая система (ТТС) в виде пластыря со скоростью высвобождения активного вещества 50 мкг/сут. (эстрадиола гемигидрат 3,9 мг в 1 ТТС, что соответствует содержанию эстрадиола 3,8 мг), эстрадиола гемигидрат гель для наружного применения 0,1% (эстрадиола 0,5 мг/пак. или 1 мг/пак.), эстрадиола гемигидрат водно-спиртовой гель 0,06% для наружного применения (эстрадиола 1,5 мг в 2,5 г геля).
Ниже представлена схема терапии климактерических симптомов у женщин с тотальной гистерэктомией на примере трансдермальных форм лекарственных средств (рис. 6).
Алгоритм управления кровотечениями при применении менопаузальной гормональной терапии
Постменопаузальное маточное кровотечение (ПМК) определяется как маточное кровотечение, возникшее спустя более чем через 1 год стойкой аменореи, которая наступила в результате утраты овариальной активности [24].
Причины постменопаузальных кровотечений
Наиболее частой причиной кровотечений у женщин в постменопаузе (ПМК) является внутриматочная патология, однако они могут быть обусловлены другими причинами (патологические процессы шейки матки и влагалища) и негинекологической патологией (мочевыделительной системы, желудочно-кишечного тракта). Повышенный риск рака эндометрия у пациентов с ПМК требует незамедлительного диагностического поиска. Таким образом, жалобы на ПМК должны рассматриваться крайне серьезно и ни в коем случае не должны быть проигнорированы [25].
Для диагностического поиска и определения дальнейшей тактики у женщин с постменопаузальным кровотечением можно воспользоваться следующим алгоритмом [25] (рис. 7).
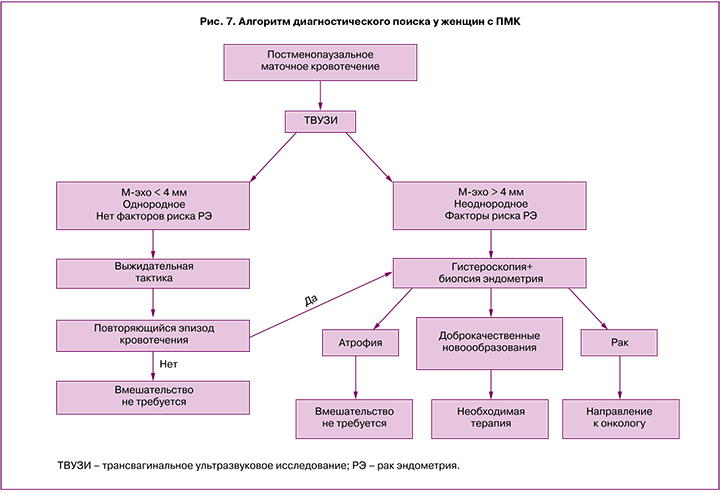
Женщины, получающие менопаузальную гормональную терапию
Данные научных исследований свидетельствуют о том, что риск развития рака эндометрия у постменопаузальных женщин с кровотечением из половых путей на фоне МГТ (кровотечения прорыва) значительно ниже в сравнении с женщинами, не получающими гормональную терапию. Так, масштабный метаанализ 2018 г., включивший более 40 000 женщин, свидетельствует о том, что риск рака эндометрия в постменопаузе у женщин, принимавших МГТ, был значительно ниже, чем у тех, кто не принимал МГТ: 7% и 12% соответственно (р<0,001) [26].
Это подтверждают и данные анализа долгосрочного риска рака эндометрия Датского медицинского регистра, опубликованные в 2020 г. Анализ, включивший более 43 000 женщин с постменопаузальными кровотечениями, показал, что риск рака эндометрия среди женщин, принимавших МГТ, составил 3,2% спустя 1 год и 3,6% спустя 5 лет после возникновения эпизода ПМК, тогда как риск для женщин, не принимавших МГТ, составил 5,1% и 5,65% спустя 1 год и 5 лет соответственно [27].
В любом случае женщины, имеющие незапланированные кровотечения на фоне приема комбинированной МГТ в циклическом или непрерывном режиме, должны быть тщательным образом обследованы. Наиболее частыми причинами незапланированных кровотечений на фоне МГТ являются низкая комплаентность, заболевания печени, лекарственные взаимодействия, доброкачественные новообразования (такие как эндометриальные или цервикальные полипы), цервициты, а также экстрагенитальная патология (заболевания мочевыводящих путей, желудочно-кишечного тракта) [25].
При применении комбинированной МГТ частота кровотечений как при пероральном, так и при трансдермальном пути введения может возникать в 0–77% случаев, по различным данным [28].
При этом, как было показано на примере непрерывной комбинированной пероральной МГТ, число женщин с кровотечениями после 6–12 месяцев использования терапии значительно снижается, а после 9 месяцев ожидается, что только 3–9% женщин будут сталкиваться с незапланированными кровотечениями. При применении трансдермального пути введения эстрогена через 12 месяцев кровотечения все еще наблюдаются у женщин в 10–20% случаев [29].
Таким образом, при незапланированном кровотечении у женщин, применяющих МГТ, существует две основные задачи:
- исключить рак эндометрия;
- выяснить причину для лечения ациклических кровотечений с целью возможной патогенетической и/или симптоматической терапии.
Тактика диагностики и лечения
1. Подробный анамнез.
- Когда возникает кровотечение?
- Какие лекарства принимает пациентка?
- Пациентка пропустила/нарушила режим приема МГТ?
- Посткоитальное?
- Когда было последнее обследование шейки матки?
2. Физикальное обследование должно включать осмотр наружных половых органов, влагалища и шейки матки с целью:
- выявления визуальных признаков поражений или кровотечения, включая любые признаки атрофии;
- уточнения локализации кровотечения, которые возможны из половых путей, уретры, прямой кишки.
3. Ультразвуковое обследование (дальнейшая тактика действий будет во многом зависеть от результатов УЗИ, поэтому опыт ультразвукового врача имеет существенное значение).
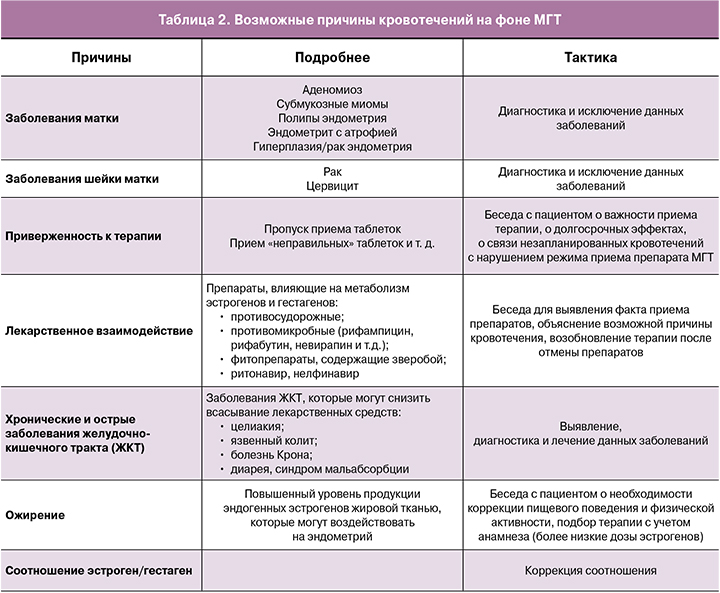
Собранные данные позволят поэтапно исключить возможные причины кровотечения [28–30] (табл. 2).
4. После выполнения вышеописанных шагов для дальнейшей тактики можно воспользоваться следующим алгоритмом (рис. 8).
5. После исключения патологических изменений эндометрия и других причин возможны следующие шаги в зависимости от типа применяемой терапии.
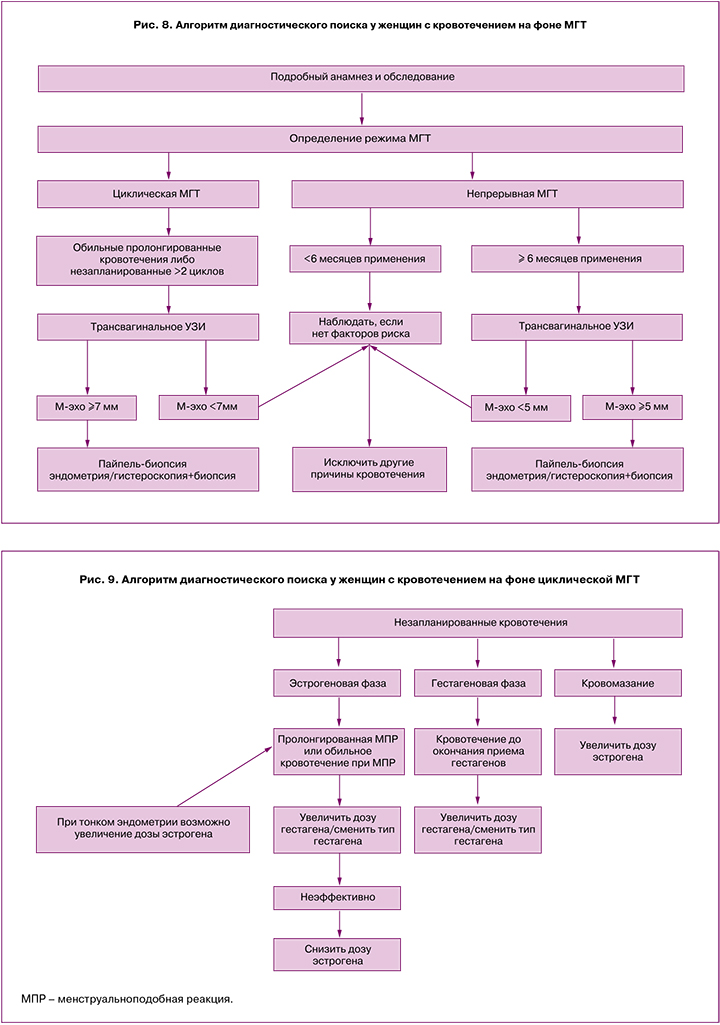
А. Незапланированное кровотечение при применении циклической МГТ [28, 30] (рис. 9).
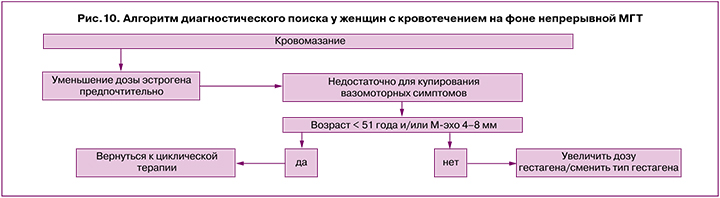
Б. Незапланированное кровотечение при применении непрерывной МГТ [28, 30] (рис. 10).
Алгоритм перевода пациенток с комбинированных оральных контрацептивов на менопаузальную гормональную терапию
На сегодняшний день нет единого алгоритма, позволяющего четко определить показания и механизм самого перевода пациенток с приема КОК на МГТ.
Согласно данным Всероссийского анкетирования по назначению и применению МГТ, около 90% врачей сталкиваются в своей практике с необходимостью перевода пациенток с КОК на МГТ [31]. При этом основными стратегиями перевода с КОК на МГТ являлись: отмена КОК и непосредственно следующий за этим старт МГТ (61% респондентов) и отмена КОК, последующий перерыв в какой-либо терапии, а затем – старт МГТ (28% респондентов). Остальные 11% опрошенных следовали различным стратегиям, например, ориентировались на возраст предполагаемой менопаузы, делали только перерыв после отмены КОК на 6–8 недель, делали перерыв и ориентировались на уровни ФСГ и т. д.
В России только 25% женщин, принимающих КОК, делают это с контрацептивной целью, тогда как 75% КОК был назначен с лечебной целью, что что может быть неоптимальным [32].
При этом возраст служит условным ориентиром для понимания потребности в переходе. После 40 лет у женщин требуется периодически, 1 раз в год, оценивать риск/пользу применения гормональной контрацепции [33, 51].
Для определения приемлемости контрацепции для каждого пациента следует учитывать наличие в совокупности более одного из перечисленных состояний [34]:
- возраст (< / ≥35 лет), курение (< / ≥ 15 сигарет/день), ожирение (ИМТ ≥30 кг/м²), повышенное артериальное давление;
- венозный тромбоэмболизм, тромбоз поверхностных вен, дислипидемия, тяжелое сердечно-сосудистое заболевание в анамнезе (включая ишемическую болезнь сердца, инсульт или другие тромбоэмболические состояния), мигрени и др.
К возможным причинам отмены КОК женщиной либо лечащим врачом относятся:
- неблагоприятный баланс риск/польза;
- отсутствие полового партнера;
- вынужденный перерыв (планируемая операция, иммобилизация, другие заболевания).
При возникновении вазомоторных симптомов после отмены КОК необходимо рассмотреть вопрос о назначении МГТ.
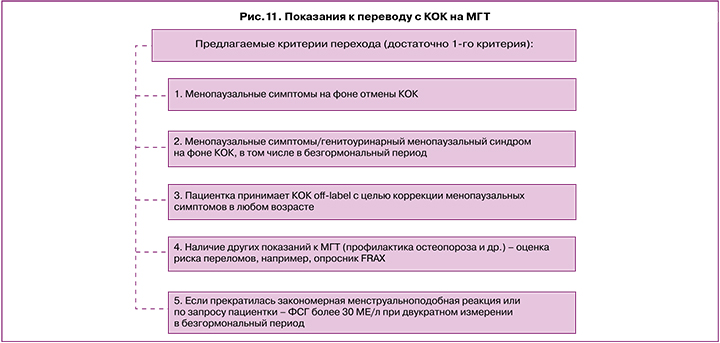
Таким образом, можно сформулировать следующие показания к переводу с КОК на МГТ (рис. 11).
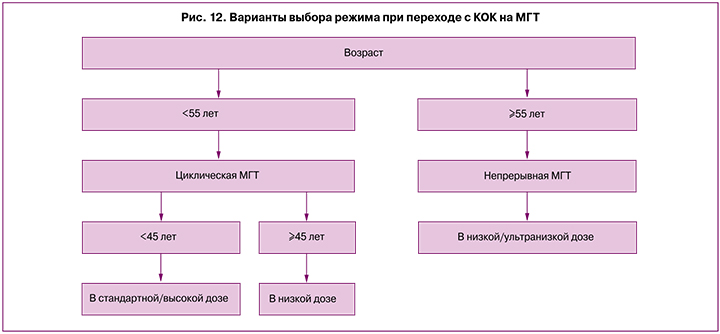
Предлагаемые варианты выбора режима МГТ при переходе с КОК (рис. 12).
Через 2–3 месяца после перехода на МГТ необходима повторная консультация с результатами УЗИ органов малого таза (по показаниям) для оценки эффективности, возможных побочных реакций, наличия кровянистых выделений и их характера. Необходимо уведомить пациентку об отсутствии контрацептивного эффекта у препаратов МГТ и рекомендовать при необходимости использовать, например, барьерный метод контрацепции.
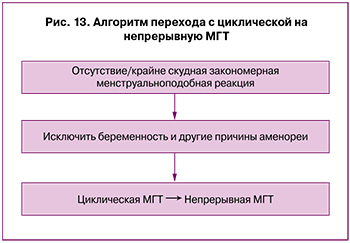 В случае отсутствия или крайне скудной закономерной менструальноподобной реакции на фоне применения циклической МГТ (при исключении беременности и других причин аменореи) – рассмотрение вопроса о переходе на монофазную МГТ (рис. 13).
В случае отсутствия или крайне скудной закономерной менструальноподобной реакции на фоне применения циклической МГТ (при исключении беременности и других причин аменореи) – рассмотрение вопроса о переходе на монофазную МГТ (рис. 13).
Заключение
Несомненно, что деятельность врача является ключевой на пути сохранения здоровья и общего качества жизни женщин, страдающих от менопаузальных симптомов. Мы надеемся, что данные алгоритмы помогут улучшить клинические подходы к ведению пациенток с менопаузой и обеспечить персонализацию терапии, станут настольным инструментом в ежедневной практике каждого врача, что в совокупности будет способствовать поддержанию активного, здорового долголетия женщин, тем самым оказывая значительное влияние на предотвращение медико-демографических, социальных и экономических потерь в России.
Приведенные алгоритмы будут в последующем дополняться и пересматриваться по мере появления новых международных рекомендаций и научных исследований.



