Общие сведения
Коды поражений шейки матки по МКБ-10
- N87 Дисплазия шейки матки.
- N87.0 Слабовыраженная дисплазия шейки матки.
- N87.1 Умеренная дисплазия шейки матки.
- N87.2 Резко выраженная дисплазия шейки матки, не классифицированная в других рубриках.
- N87.9 Дисплазия шейки матки неуточненная.
Инфицированность вирусами папилломы человека (ВПЧ) у беременных женщин обнаруживается в широком диапазоне – от 5,5 до 65% и зависит от региона проживания, возраста и других факторов [1]. ВПЧ является этиологическим фактором развития рака шейки матки (РШМ) в 99% случаев.
Распространенность носительства ВПЧ у беременных женщин в России (Московский регион), по данным нашего исследования, выявлена у 29% (из 2620 человек, прошедших скрининг) [2].
Факторы риска. Наиболее значимыми факторами риска заболеваний шейки матки (ЗШМ) у ВПЧинфицированных женщин являются возраст старше 35 лет (ОШ=3,8; 95% ДИ 1,6–9,0; р=0,04), бактериальный вагиноз в анамнезе (ОШ=3,0; 95% ДИ 1,6–5,5; р=0,001) и отсутствие регулярного скрининга (ОШ=2,4; 95% ДИ 1,2–4,9; р=0,02) [собственные данные].
Распространенность цервикальной интраэпителиальной неоплазии (CIN) составляет от 1,3 до 2,7 на 1000 беременностей, а заболеваемость РШМ – 0,1–12 на 10 000 беременностей [3]. Исследователи утверждают, что РШМ является самым частым новообразованием среди злокачественных заболеваний у беременных. В России (Московский регион) частота LSIL и HSIL составляет 6,7 и 3,9% среди беременных женщин, инфицированных ВПЧ, или 24,8 на 1000 всех обследованных беременных женщин [2].
Естественное течение CIN во время беременности. Отмечается редкое прогрессирование CIN до инвазивной стадии РШМ (у 9,6% пациенток). CIN часто подвергается регрессу в послеродовом периоде (у 46,8%). Прогрессирования до инвазивного рака в течение беременности не наблюдается [4]. В то же время вопрос о том, может ли беременность ускорить прогрессирование рака, все еще остается спорным. Некоторые ученые обнаружили, что уровни эстрогена, прогестерона и хорионического гонадотропина человека во время беременности положительно коррелируют с ВПЧ 16 и 18 типов, что косвенно указывает на то, что беременность может способствовать прогрессированию CIN [5].
Воспалительные заболевания шейки матки у беременных, инфицированных ВПЧ, составляют 88%, ASCUS – 12% в структуре ЗШМ [2]. Носительство ВПЧ сопровождается достоверно большей частотой воспалительных ЗШМ (ОШ=9,5; 95% ДИ 4,61–19,69; р<0,0001) и SIL различной степени тяжести (ОШ=7,7; 95% ДИ 1,70–34,95; р=0,005) по сравнению с женщинами без ВПЧ [6]. Дисбиоз влагалища обнаруживается у 39%, рецидивирующее течение имеют 48% пациенток [7]. Показано влияние нарушений биоценоза влагалища у беременных на увеличение частоты LSIL, HSIL и РШМ (20, 27 и 40% соответственно по сравнению с 11% – у женщин без дисбиоза) [8].
Влияние ВПЧ на частоту преждевременных родов (ПвР) и самопроизвольных выкидышей имеет неоднозначные результаты, однако метаанализ 18 РКИ показал, что инфекция, вызванная ВПЧ высокого канцерогенного риска (ВКР), связана с риском ПвР с объединенным OШ=2,84 (95% ДИ 1,95–4,14) [9].
Беременность, протекающая в условиях рецидивирующего нарушения биоценоза влагалища на фоне ВПЧ-инфекции, сопровождается высоким риском невынашивания и недонашивания беременности с частотой 21,6% [10].
Диагностика заболеваний шейки матки у беременных женщин
Скрининг. Установление этиологической роли ВПЧ в развитии РШМ является основанием выявления ДНК ВПЧ как первого этапа скрининга РШМ. Для диагностики HSIL+ чувствительность теста на ДНК ВПЧ ВКР полимеразной цепной реакцией (ПЦР) в реальном времени значительно выше (94%) по сравнению с цитологическим методом (ПАП-тест – 59%, жидкостная цитология ThinPrep – 77%), однако специфичность цитологических методов выше по сравнению с ВПЧ-тестами (92–80% против 75–76% соответственно), что объясняется транзиторным характером папилломавирусной инфекции [11, 12].
Скрининг на ВПЧ в качестве первичного теста позволяет увеличить интервалы между обследованием до 3 лет. Сочетание методов ДНК ВПЧ ВКР и цитологического исследования увеличивает точность результата до 100% [13].
Определение серотипов ВПЧ ВКР. Показано, что ВПЧ 16 вызывает более 50% случаев РШМ, в то время как ВПЧ 16 и 18 вместе являются причиной более 70% случаев во всем мире [14]. Распространенность носительства 16 и 18 типов ВПЧ у беременных в России (Московский регион) выявлена у 25 и 19% соответственно, 16/18 – у 8,4% [2]. Обнаружение данных типов вируса диктует необходимость более активного выявления предраковых заболеваний ШМ.
Вирусная нагрузка ВПЧ ВКР может быть маркером прогрессирования предраковых состояний. Но однократное определение вирусной нагрузки не имеет клинического значения. Численное значение вирусной нагрузки ВПЧ не связано с элиминацией вируса, но ее уменьшение более чем на 2 порядка между двумя посещениями врача (через 6–12 месяцев) может быть полезным прогностическим фактором низкого риска РШМ [15].
Цитологическое исследование соскобов шейки матки. Жидкостная цитология по сравнению с ПАП-тестом имеет более высокую чувствительность (97,8 против 95,2% соответственно) и отрицательную прогностическую ценность результата для обнаружения CIN2+ (80,8 против 71,1% соответственно), а также другие преимущества, и может быть альтернативным подходом для скрининга РШМ [16].
Кольпоскопическое исследование шейки матки. У беременных женщин наблюдается эверсия шейки матки (ШМ) («выворот»), что позволяет хорошо визуализировать зону стыка в большинстве случаев. С другой стороны, имеют место изменения ШМ, связанные с гормональными влияниями, затрудняющими оценку кольпоскопических картин (повышенное кровенаполнение ШМ, усиленное образование слизи, активный процесс метаплазии в зоне стыка, децидуализация стромы, повышенная реакция на воздействие раствором уксусной кислоты). В связи с этим отмечается, что частота совпадения результатов между кольпоскопией и цитологией составляет 68,1% случаев, «кольпоскопическое завышение» – 14,5% и «занижение» – 17,4% [17]. По данным нашего исследования, у пациенток с ЗШМ частота несовпадений была значительно ниже – 3,7%.
Определение структуры микробиоценоза влагалища. Традиционным методом исследования является микроскопия мазка влагалищного содержимого и цервикального канала (нативного и окрашенного по Граму) для идентификации условно-патогенных микроорганизмов (чувствительность – 90%, специфичность – 86%) [18]. Бактериологический метод («посев» из влагалища) имеет низкие показатели чувствительности (50%), особенно в отношении анаэробных микроорганизмов, которые в большинстве случаев не культивируются на питательных средах, и, таким образом, дает необъективную и неполную оценку структуры микробного сообщества [19]. Метод Фемофлор-16 позволяет охарактеризовать состав и структуру микробиоценоза влагалища и концентрацию лактобактерий (чувствительность – 97%, специфичность – 97%).
При выявлении заболеваний, сопровождающихся патологическими выделениями из влагалища, необходимо провести исследование для идентификации инфекций, передаваемых половым путем, методом МАНК или ПЦР в реальном времени.
Ведение беременных женщин с заболеваниями шейки матки
Предраковые ЗШМ у ВПЧ-инфицированных женщин. В настоящее время рекомендуется консервативная тактика:
- ASCUS – кольпоскопия проводится в послеродовом периоде (через 6–8 недель после родов);
- LSIL – рекомендуется выполнить кольпоскопию; при отсутствии подозрения на тяжелые поражения – повторное обследование после родов (через 6–8 недель);
- HSIL – рекомендуется выполнить кольпоскопию и биопсию (в условиях стационара); лечения не требуется при отсутствии РШМ (в этом случае проводится повторное обследование после родов); при подозрении на РШМ рекомендуется петлевая электроэксцизия (возможно отложить до послеродового периода при отсутствии инвазии).
Воспалительные заболевания влагалища и шейки матки. Лечение осуществляется в соответствии с выявленными возбудителями с использованием лекарственных средств и схем, рекомендованных действующими клиническими рекомендациями и инструкциями по применению с учетом преимуществ пользы по сравнению с риском для плода (категории А и В по FDA, а также С при условии отсутствия более безопасных альтернативных вариантов).
Профилактика преждевременных родов. Учитывая высокий риск ПвР у женщин, инфицированных ВПЧ и/или имеющих рецидивы бактериального вагиноза, необходимо проведение профилактических мероприятий в соответствии с действующими клиническими рекомендациями.
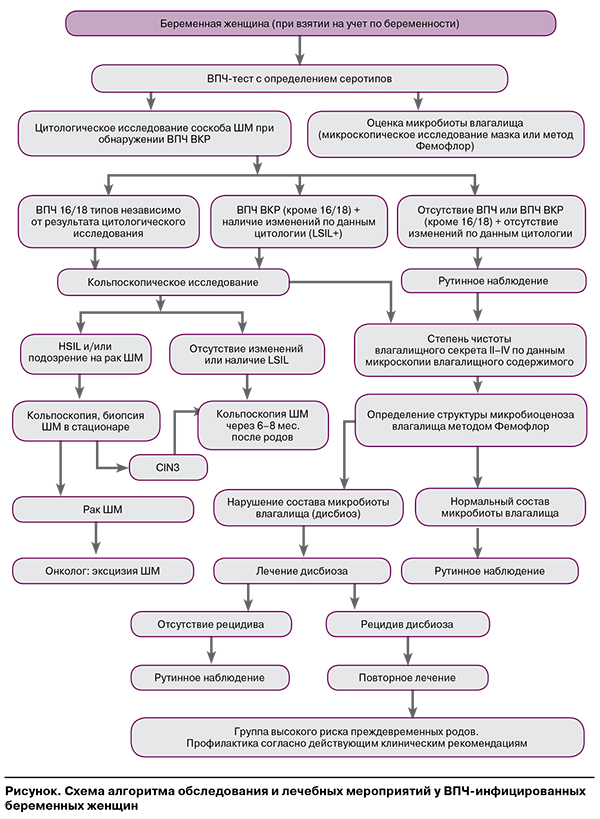
На основании проведенного нами исследования, анализа его результатов и данных, опубликованных другими авторами, разработан алгоритм диагностики ЗШМ у ВПЧ-инфицированных женщин в период беременности, который позволяет выявить интраэпителиальные поражения шейки матки, определить структуру нарушений микробиоценоза влагалища, оценить риск преждевременных родов, обосновать стратегию лечения (рисунок).