Одним из основных направлений современной медицины является снижение не только перинатальной смертности, но и, что не менее важно, перинатальной заболеваемости. Гемолитическая болезнь плода и новорожденного (ГБПиН) влияет на оба показателя [1–11]. В экономически развитых странах проблема профилактики ГБПиН сохраняется только у эмигрантов, а среди коренного населения она решена благодаря высокой организации иммунизации [11–15]. В 2018 году иммунопрофилактике ГБПиН исполнилось 50 лет. В нашей стране этот вопрос актуален до настоящего времени, поэтому много работ посвящено лечению ГБПиН [2, 6, 8, 16, 17]. Полувековой истории иммунопрофилактики ГБПиН посвящена данная статья.
Первое клиническое наблюдение желтухи у двух близнецов описано в 1609 г. французской акушеркой Луизой Буржуа: один новорожденный погиб во время родов, другой – через несколько дней [18]. Отек и желтуха у младенцев не раз упоминались в научных трудах XVIII века. В 1785 году Жан Батист Тимати Баумес (J.B.T.Baumes) награжден премией Парижского университета за работу по описанию 10 клинических наблюдений желтухи у новорожденных [19]. В 1812 г. Райтман (М. Raytman) при вскрытии погибшего от отека плода обнаружил в его крови большое количество эритробластов и миэлобластов, а также множественные и сильно развитые очаги кроветворения в печени, почках и селезенке. Эту патологическую картину Райтман назвал erythroblastosis foetalis [18]. Этиология заболевания долгое время оставалась невыясненной.
Изучать механизмы развития врожденного отека, сочетающегося с желтухой, стали в начале XIX века. Людвиг фон Буль (L. Buhl) в 1861 г. описал клинику тяжелой желтухи новорожденного, но связал ее с наличием сифилиса. Джоханнс Орт (J. Orth) в 1875 г., а затем Кристиан Георг Шморль (C. Schmorl) в 1903 г., исследуя патологоанатомические изменения при тяжелой желтухе, выявили окрашивание ядерных масс полушарий мозга, мозжечка и продолговатого мозга новорожденного [19]. Желтуху с прокрашиванием ядер Кристиан Георг Шморль назвал «kernicterus» («ядерная желтуха»). Этот термин длительное время использовался для обозначения тяжелой желтухи новорожденного с поражением центральной нервной системы. Позже в 1964 году В.А. Таболин в своей докторской диссертации на тему «Гемолитическая болезнь новорожденных (патогенез, клиника, лечение, отдаленные последствия)» доказал, что поражение мозга, называемое «ядерной желтухой» («kernicterus»), не является патогномоничным для ГБН и может наблюдаться при любом заболевании новорожденных [20], сопровождающимся накоплением в крови непрямого билирубина (например, при физиологической желтухе недоношенных и др.).
На протяжении нескольких десятилетий акушеры сталкивались с заболеваниями новорожденных, проявляющимися отеком, анемий и желтухой, рецидивирующими при повторных родах, долгое время объединяющимися под общим названием «фетальный эритробластоз», или «эритролейкобластоз». Однако этиология заболевания оставалась неизвестной.
Научный прорыв произошел в 1940 году, когда американскими исследователями Карлом Ландштейнером (K. Landsteiner) и Александром Винером (Wiener Alexander Solomon) обнаружен резус-фактор [21]. Авторы, иммунизируя кроликов кровью обезьян вида Macacus rhesus, получили иммунную сыворотку, которая вызывала агглютинацию не только эритроцитов обезьян «резус», но и эритроцитов 15% людей, независимо от их групповой принадлежности. На основании полученных данных сделано заключение о наличии в эритроцитах людей нового, до сих пор неизвестного, фактора, который авторами назван резус-фактором (резус-агглютиногеном), а соответствующие ему антитела – антирезус – агглютининами. Оценка распределения резус-фактора показала, что его содержат около 85% населения, их стали называть резус-положительными или резус-позитивными (Rh+). Лиц, не имеющих резус-фактор (15%), считали резус-отрицательными или резус-негативными (Rh-).
После открытия резус-фактора и установления роли резус-несовместимости крови плода и матери в возникновении отека и желтухи новорожденного для обозначения данного заболевания стал применяться термин «гемолитическая болезнь новорожденных» [20].
K. Landsteiner и A.S. Wiener подробно исследовали феномен агглютинации и лизиса эритроцитов, а также изучали их роль в развитии ГБН. Переход материнского анти-D-иммуноглобулина G (IgG) через плаценту в кровообращение плода был признан финальным событием, способным вызывать спектр клинических проявлений заболевания [21, 22].
В 1957 году Е. Kleihauer и соавт. [23] убедительно доказали, что количество крови плода, попавшей в кровоток матери через плаценту, и частота сенсибилизации во многом зависят от акушерской ситуации и тактики ведения родов. Так, по их данным, объем фето-материнской трансфузии увеличивается при токсикозах беременности, после операции кесарева сечения, родов в тазовом предлежании, ручного отделения плаценты, наружного и внутреннего поворота плода, амниоцентеза.
Е. Kleihauer и соавт. [23] разработали метод оценки объема трансплацентарного кровотечения, которым пользуются акушеры всего мира по сегодняшний день для расчета дозы вводимого антирезус иммуноглобулина.
Первые исследования по специфической профилактике резус-сенсибилизации выполнены в Англии профессором C.A. Clarke и соавторами в начале 60-х годов прошлого века [24]. Одновременно и независимо от группы английских ученых в США V. Freda с соавторами [25] проводили работу по предупреждению резус-сенсибилизации. Американские авторы опирались на наблюдения T. Smith, который еще в 1909 году, обследуя заключенных, показал, что в присутствии пассивно введенных антител соответствующий антиген не вызывает иммунизации [26]. В 1964 г. американские исследователи получили гипериммунный антирезус-гаммаглобулин для внутримышечных инъекций, в 1968 году – выдано официальное разрешение на его использование [24].
После успешных экспериментов во многих центрах мира начаты клинические испытания по профилактике резус — сенсибилизации у женщин с резус-отрицательной кровью. В нашей стране анти-резус иммуноглобулин внедрен в клиническую практику благодаря исследованиям В.М. Сидельниковой [26–28]. Работая в лаборатории профессора C.A. Clarke в Ливерпуле, она изучила организацию профилактики резус-сенсибилизации в акушерских клиниках Великобритании, научилась выполнять амниоцентез и интраперитонеальное переливание крови под руководством доктора Bevis D. в г. Шеффилде (автора метода амниоцентеза), а также приняла участие в иммунологических испытаниях лаборатории профессора P.G. Mollison в Лондоне.
Впоследствии (1968–1974 гг.) В.М. Сидельникова возглавила первое отечественное исследование по послеродовой профилактике резус-сенсибилизации, используя закупленный за рубежом препарат Партобулин, а также сделав попытку создания отечественного антирезус иммуноглобулина. Под наблюдением находилось 1200 женщин с резус-отрицательной кровью без явлений сенсибилизации [26]. Для профилактики резус-сенсибилизации 302 из них в первые 48 часов после родов получили антирезус иммуноглобулин: 180 пациенток – Партобулин, остальные (122) – отечественный препарат (таблица).
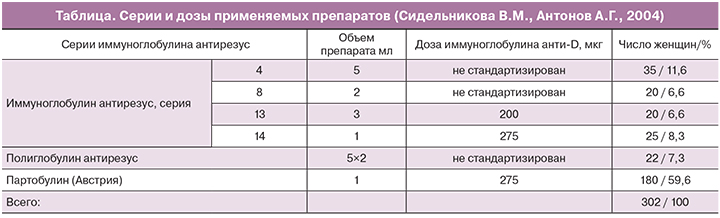
У каждой третьей пациентки при введении отечественного иммуноглобулина отмечалась местная болезненность и инфильтрация в месте инъекции, что было связано с необходимостью введения большого объема иммуноглобулина и повышенным содержанием альбумина. В дальнейшем использование Партобулина рекомендовано для практической деятельности. Проведенное исследование и полученные данные легли в основу докторской диссертации В.М. Сидельниковой по теме: «Антенальная диагностика, лечение гемолитической болезни плода при резус-сенсибилизации и меры ее профилактики», защита которой состоялась в 1976 г. Автор сделала вывод, что иммуноглобулин анти-резус в качестве профилактики резус-сенсибилизации обладает высокой эффективностью, его широкое внедрение является весьма перспективным. Однако было отмечено, что отечественные препараты не стандартизированы в мкг. К сожалению, за 40 лет ситуация в России не изменилась.
Метод иммунопрофилактики ГБН основан на применении иммуноглобулина не только после родов, но и во время беременности при отсутствии антител. В развитых странах мира антенатальная профилактика стала рутинной в клинической практике еще в прошлом веке. В Великобритании вводили 500 IU (100 мкг) в 28 и 34 недели или 1000 IU (200 мкг) – между 28 и 30 неделями. В США иммуноглобулин использовали у всех беременных с резус-отрицательной кровью в 28–30 недель в дозе 300 мкг [26]. Внедрение послеродовой иммунопрофилактики в практику в 1970 году позволило снизить частоту материнской резус-(D)-иммунизации в мире с 14% до 1–2%, применение антенатальной иммунопрофилактики – до 0,1% [10, 14]. В нашей стране в конце прошлого века не проводилась профилактика резус-сенсибилизации даже после родов, не говоря о введении иммуноглобулина беременным.
Параллельно исследованиям В.М. Сидельниковой, в роддоме № 23 (ныне ГБУЗ «ЦПСиР ДЗМ») проводилась работа по профилактике ГБПиН с использованием закупленного за рубежом препарата Партобулин (Австрия), а также отечественного иммуноглобулина человека анти-резус Rh0(D), произведенного на Ивановской и Московской станциях переливания крови (СПК), Россия. Иммуноглобулин Ивановской СПК применяется в нашей стране до настоящего времени, на Московской СПК иммуноглобулин сегодня не производится.
Эра антенатальной профилактики в России начинается с 1994 года благодаря исследованиям Г.М. Савельевой и М.А. Курцера [2, 16]. С декабря 1994 г. по сентябрь 1995 г. на базе ЦПСиР проводились исследования препарата иммуноглобулина G антирезус Rho(D) моноклонального человеческого «Резоклон», разработанного ГНЦ РАМН и ТОО «Гематолог», Москва, Россия. В отличие от поликлонального иммуноглобулина, который получают из плазмы здоровых людей, иммунизированных резус-положительными клетками, моноклональный препарат синтезируют из β-клеток человека или яичника китайских хомячков [29], в связи с чем, передача инфекционного агента исключена. Разрешение клинических испытаний препарата «Резоклон» выдано Фармакологическим комитетом Минздравмедпрома РФ (протокол № 16 заседания от 27.10.94). Каждая доза препарата содержала 150 мкг (750 инт.ед.) специфического иммуноглобулина анти-Rho (D).
Результаты исследований показали, что моноклональный препарат по эффективности не уступает поликлональному анти-резус иммуноглобулину. Введение моноклонального иммуноглобулина не вызывало каких-либо местных и общих реакций, а также осложнений ни у одной пациентки. Препарат хорошо переносился родильницами. Рекомендовано максимально быстро внедрить препарат в практическое здравоохранение, но из-за проблем с финансированием это сделать не удалось.
Существующий отечественный иммуноглобулин человека анти-резус Rh0(D), применяемый в России с 80-х годов, не стандартизирован, в связи с этим с целью антенатальной профилактики до сих пор используются иммуноглобулины зарубежных производителей.
В 2003 г. на территории РФ зарегистрирован антирезусный иммуноглобулин – Бей Роу-Ди (Bayer Corporation Biological Products, США, 300 мкг). В 2004 г. Департаментом здравоохранения осуществлена централизованная закупка данного препарата для применения в женских консультациях и акушерских стационарах с целью профилактики резус-сенсибилизации и ГБПиН.
С 2004 по 2006 гг. в ЦПСиР в качестве послеродовой профилактики ГБПиН гаммаглобулин Гипер РОУ С/Д использован у 350 пациенток [16]. Иммуноглобулин вводили по одной дозе (300 мкг) внутримышечно однократно в течение первых 2 часов после родов родильницам с Rh0(D)-отрицательной кровью, несенсибилизированным к фактору Rh0(D), после определения резус-принадлежности ребенка экспресс-методом и подтверждения результатов в лаборатории при помощи гелевых методик. Антитела через 3 и 6 месяцев после введения препарата не обнаружены ни у одной из пациенток.
В этот же период в ЦПСиР проведено обследование 250 пациенток с резус-отрицательной кровью, не сенсибилизированных к Rho(D) антигену, у которых прервана беременность на различных сроках (от 9 до 14 недель гестации), у 2 из 250 – выполнена лапароскопическая тубэктомия по поводу внематочной беременности. У всех 250 женщин муж имел резус-положительную кровь. Иммуноглобулин человека анти-резус Rh0(D) [Россия] был использован у 207 из 250, гаммаглобулин Гипер РОУ С/Д – у 43. Всем введена 1 доза препарата. При повторном обследовании (у 55 из 250) в сроки от 3 до 12 месяцев антитела не определялись ни в одном из наблюдений.
В ходе проведенных исследований антенатальная профилактика ГБ гаммаглобулином Гипер РОУ С/Д произведена у 150 пациенток с резуc-отрицательной кровью во время беременности без явлений сенсибилизации (у всех отец плода имел резус-положительную кровь). Всем 150 беременным введена одна доза препарата (1500 ед., что соответствует 300 мкг), осложнений во время беременности не выявлено. 120 из 150 пациенткам, родившим ребенка с резус-положительной кровью, в родильном блоке в течение 2 часов после родов введена вторая доза (1500 ед.). Антитела через 3 и 6 месяцев после введения препарата не обнаружены ни у одной из наблюдаемых.
В последующие годы в связи с недостаточным количеством имеющегося гаммаглобулина Гипер РОУ С/Д на отечественном рынке появились другие препараты зарубежного производства: КамРОУ 1500 МЕ/2 мл (300 мкг), KAMADA, Ltd. (Израиль); Резонатив 1250 МЕ/2 мл (312 мкг), Октафарма АБ (Швеция); Иммуно Кедрион 1500 МЕ/2 мл (300 мкг), KEDRION, S.p.A. (Италия).
В дальнейшем в целях пренатальной охраны здоровья новорожденных, оптимизации мероприятий по обеспечению населения медикаментами, сохранения и укрепления здоровья беременных, последние внесены в льготную категорию граждан, имеющих право на социальную поддержку в виде обеспечения лекарственными средствами и изделиями медицинского назначения бесплатно или с 50% скидкой (Распоряжение Правительства Москвы от 05.09.2008 года № 2028-РП «О внесении изменений в распоряжение Правительства Москвы от 10.08.2005 №1506-РП» [30]). Приказом Департамента здравоохранения г. Москвы от 06.10.2008 года №748 «О лекарственном обеспечении беременных женщин» [31] утвержден перечень медикаментов, рекомендованных для получения в аптечных пунктах по рецептам врача акушера-гинеколога женских консультаций, в который включен препарат антирезусный иммуноглобулин.
С 2012 года и по сегодняшний день порядок антенатальной профилактики регламентируется Приказом МЗ РФ № 572н от 1.11.2012 [32], а также Клиническим протоколом МЗ РФ от 18 мая 2017 г. N 15–4/10/2–330 [33]. Согласно этим документам у резус-отрицательных беременных необходимо проводить: а) обследование отца ребенка на групповую и резус-принадлежность; б) анализ крови на резус-антитела (при резус-положительной принадлежности отца ребенка) – 1 раз в месяц. При резус-положительной крови отца ребенка и отсутствии резус-антител в крови беременной в 28 недель вводится иммуноглобулин человека антирезус RH0(D).
Первое упоминание о необходимости диагностики резус-принадлежности плода относится к 1974 году [34]. Авторы оценивали резус-несовместимость между кровью матери и плода у 125 беременных с резус-отрицательной кровью методом Джонса, выявляя фетальные эритроциты в мазке крови матери. Более точными были результаты на 36–40-й неделе. С 2017 года появилась возможность определения Rh-положительных эритроцитов плода в периферической крови беременной при помощи теста ООО «ТестГен», основанного на выявлении фетального гена резус-фактора методом ПЦР. Определение резус-принадлежности плода во время беременности дало возможность своевременно предпринять меры по предупреждению развития ГБН.
На сегодняшний день основными являются следующие профилактические мероприятия ГБПиН:
- переливание крови с учетом резус-фактора;
- сохранение первой беременности у женщины с резус-отрицательной кровью;
- проведение специфической профилактики – введение иммуноглобулина анти-резус Rh0(D) пациенткам с резус-отрицательной кровью без явлений сенсибилизации:
- в течение 48 часов после родов резус-положительным плодом,
- после прерывания беременности на любом сроке,
- после операции по поводу внематочной беременности.
Для профилактики ГБПиН при неосложненной беременности у пациенток с резус-отрицательной кровью без явлений сенсибилизации вводится 1 доза препарата (1500 ед.) гаммаглобулина при сроке 28 недель гестации. Во время осложненной беременности независимо от срока гестации выделяют следующие показаниями к применению антирезус-гаммаглобулина (1 доза препарата):
- начавшийся выкидыш;
- проведение инвазивных процедур (биопсии хориона, амниоцентеза, кордоцентеза);
- наложение швов на шейку матки (при истмико-цервикальной недостаточности);
- инструментальное удаление плацентарной ткани при пузырном заносе;
- травма брюшной полости;
- редукция одного эмбриона после ЭКО.
Вторую дозу препарата (1500 ед.) вводят в течение 72 часов после родов, если родившийся ребенок резус-положительный.
На сегодняшний день, несмотря на наличие четкого алгоритма использования мероприятий по профилактике ГБПиН, а также соответствующих нормативных документов, регламентирующих их применение [32, 33], актуальной остается проблема эффективности профилактики резус-сенсибилизации. Причин неэффективности, на наш взгляд, может быть несколько: безответственное отношение медицинского персонала к вопросам своевременного введения иммуноглобулина во время беременности, после родов, аборта или прочих манипуляций; отсутствие препарата или его высокая его стоимость; а также неадекватность вводимой дозы антирезус-гаммаглобулина.
В подтверждении последнего предположения стоит отметить, что в последние годы причиной сенсибилизации у ряда пациенток явилась не отсутствие постнатальной профилактики ГБН, а недостаточная доза препарата. Как же определить необходимую дозу иммуноглобулина?
Известно, что для расчета дозы анти-резус иммуноглобулина нужно учитывать количество крови плода, попавшей в кровоток матери через плаценту [35–38]. Как было сказано ранее, наиболее распространенным считается метод оценки Клейхауэра-Бетке [23]. В основе теста лежит феномен вымывания гемоглобина матери (НЬА) из эритроцитов в цитратно-фосфатном буфере¸ в то время как фетальный гемоглобин (HbF) не вымывается. После соответствующей обработки в мазке периферической крови матери производят подсчет количества фетальных клеток [23]. Если объем плодово-материнского кровотечения не превышает 25 мл, вводят стандартную дозу анти-Rh0(D)-иммуноглобулина (300 мкг); при объеме 25–50 мл – дозу увеличивают вдвое (600 мкг).
К сожалению, сегодня в России метод Клейхауэра-Бетке не применяется. У родовспомогательных учреждений имеется выбор: либо налаживать его использование, либо вдвое увеличивать дозу антирезус-иммуноглобулина в случаях отслойки плаценты, ручного обследования матки и кесарева сечения. Последний вариант для стационаров в финансовом отношении менее выгодный. Мы рекомендуем не увеличивать финансовую нагрузку на учреждение, а внедрять метод Kleihauer-Betke.
В XXI веке научного прогресса и инновационных технологий на смену рутинным приходят новейшие профилактические методики. Так, последнее время широкое распространение получило проведение генетического обследования мужа. Известно [39], что при гомозиготном генотипе отца (D/D) все потомство имеет резус-положительную кровь, при гетерозиготном типе ребенок может иметь как резус-отрицательную кровь, так и резус-положительную, а вероятность рождения здоровых детей возрастет до 50%. Наличие отягощенного акушерского анамнеза (гибель детей от ГБ) у пациенток с резус-сенсибилизацией, а также гетерозиготного генотипа по резус-фактору (RHD+/RHD-) у отца плода является показанием к проведению экстракорпорального оплодотворения (ЭКО) с последующей преимплантационной генетической диагностикой (ПГД).
После оплодотворения в геномах бластомеров определяется RHD ген (расположен на левом плече первой хромосомы). Далее осуществляется подсадка в полость матки только резус-отрицательных эмбрионов: с генотипом RHD-/RHD-. В период 2004–2006 гг. в Москве, в том числе, в ГБУЗ «ЦПСиР ДЗМ», для москвичей ЭКО с ПГД проводилось за счет бюджетных средств. На сегодняшний день возможно выполнение ЭКО по полису обязательного медицинского страхования (ОМС). Генетическое консультировании, определение генотипа отца по резус-фактору перед ЭКО и ПГД оплачиваются за счет личных средств граждан.
Не стоит забывать, что возникновение ГБ при несовместимости крови матери и плода, помимо RH-D, возможно и по другим факторам и антигенам [40]: системы Kell-cellano (Kk), Duffy [Fy(a)-Fy(b)], Kidd (Jk), MNSs, Pp, Lutheran (LauLub). ГБН при перечисленных видах сенсибилизации встречается редко. Иммунопрофилактики редких видов сенсибилизации не существует.
Таким образом, спустя 50 лет от начала эры иммунопрофилактики ГБПиН, эта проблема все еще не решена в России. К сожалению, на сегодняшний день в нашей стране отсутствует отечественный стандартизированный антирезус-гаммаглобулин, а высокая стоимость импортных аналогов не позволяет широко применять их в практике акушеров-гинекологов. До настоящего времени недостаточно внедрены в практическое здравоохранение обязательные мероприятия, направленные на иммунопрофилактику ГБПиН. Для оказания эффективной помощи беременным с резус-отрицательной кровью необходимо строгое выполнение Приказа МЗ РФ № 572н от 1.11.2012 [32], а также Клинического протокола МЗ РФ от 18 мая 2017 г. N 15–4/10/2–330 [33].



