В современном здравоохранении проблема нарушения акта мочеиспускания – одна из актуальных и социально значимых. Известно, что среди женщин в возрасте 20–40 лет в 25–30% случаев встречаются неосложненные инфекции мочевыводящих путей, причем в 85% острых и 60% хронических рецидивирующих циститов выявляется E. сoli [1]. Среди женщин, впервые перенесших острый цистит, у 24% рецидив происходит через 6 месяцев, а более чем у 50% – в течение 1 года [2]. В крупных популяционных исследованиях выявлена распространенность гиперактивного мочевого пузыря (ГМП), которая составила 15–20% среди женщин и около 6% среди взрослых девочек (15–20 лет) [3]; распространенность ГМП среди женской популяции США составила в 2003 г. более 20%.
Слизистая мочевого пузыря часто колонизируется уропатогенными микроорганизмами, такими как E. сoli, вирулентность которой обусловлена способностью связываться посредством фимбрий с гликосфинголипидами/гликопротеинами, находящимися на поверхности уроэпителиальных клеток слизистой. В исследованиях последних лет показано, что фимбрии играют двоякую роль во взаимодействии макроорганизма и E. coli: с одной стороны, они способствуют прикреплению и дальнейшей репликации бактерий, а с другой – образующиеся при адгезии с оболочкой уроэпителиальной клетки-комплексы запускают иммунный ответ посредством toll-like receptor 4 (TLR4) [4].
Рathogen-associated molecular patterns (PAMPs), продуцирующиеся при внедрении E. coli, являющейся причиной неосложненных инфекций мочевыводящих путей в 70–90% случаев, распознаются несколькими видами TLR, включая TLR 1, 2, 4, 5, 6 и 11 [5–7]. Известно, что в организме человека некоторые штаммы E. сoli могут размножаться, не вызывая воспалительную реакцию, вследствие чего развивается бессимптомная бактериурия (ББУ) [8]. Таким образом, низкий уровень экспрессии TLR4 на уроэпителиальных клетках ассоциирован с развитием пиелонефрита, рецидивирующего цистита и ББУ [9].
 В некоторых исследованиях показано, что помимо уроэпителия, в распознавании липополисахаридов бактериальных клеток при ББУ активно участвуют также TLR4 клеток миелоидного происхождения, в частности, нейтрофилы. B. Ragnarsdottir и соавт. [10] и A. Smithson и соавт. [11] показали, что сниженный уровень экспрессии TLR4 и CXCR1 нейтрофилов коррелирует с развитием пиелонефрита, рецидивирующего цистита и ББУ у детей и женщин в пременопаузе.
В некоторых исследованиях показано, что помимо уроэпителия, в распознавании липополисахаридов бактериальных клеток при ББУ активно участвуют также TLR4 клеток миелоидного происхождения, в частности, нейтрофилы. B. Ragnarsdottir и соавт. [10] и A. Smithson и соавт. [11] показали, что сниженный уровень экспрессии TLR4 и CXCR1 нейтрофилов коррелирует с развитием пиелонефрита, рецидивирующего цистита и ББУ у детей и женщин в пременопаузе.
Этиология и патогенез ГМП остаются не изученными. В последнее время накапливается все больше данных об инфекционном генезе рефрактерного ГМП, характеризующегося сохранением его симптомов после проведения пациенткой лечения более чем двумя М-холиноблокаторами с тренировкой мочевого пузыря в течение более чем 1 года [12]. Впервые в исследовании R.K. Khasriya и соавт. [13], а затем другими исследователями было выявлено, что внутриклеточная бактериальная колонизация может быть причиной ГМП. Рядом авторов при изучении биоптатов мочевого пузыря, взятых у пациентов с ГМП, были также выявлены признаки воспаления. Следовательно, у части больных с симптомами резистентного ГМП воспалительные изменения детрузора при отсутствии инфекции мочевого тракта могут являться патогенетическим звеном развития данного заболевания.
В последнее время в литературе появились данные о существовании в мочевых путях популяции клеток, способных к спонтанным колебаниям мембранного потенциала, а именно особых интерстициальных клеток (ИК), имеющих нейрогенное происхождение и мигрирующих в процессе онтогенеза в висцеральные органы [14]. ИК несут нейрональный маркер – Kit-рецептор тирозинкиназы (CD117+) и маркер клеток мезенхимального происхождения виментин [14–16], что используется для идентификации этих клеток в тканях разных органов. Исследования последних лет показали, что ИК помимо желудочно-кишечного тракта обнаруживаются в мускулатуре многих органов – миокарде, фаллопиевых трубах, желчном пузыре, поджелудочной железе [14, 17], а также в органах мочеполовой системы – в почечной лоханке и мочеточнике, мочевом пузыре, уретре, предстательной железе, кавернозных телах полового члена. В связи с этим была выдвинута гипотеза, предполагающая, что именно эти клетки за счет пейсмейкерной функции обеспечивают спонтанную миогенную активность окружающих их гладкомышечных клеток [14, 18, 19]. Амплитуда их ритмических сокращений ниже, чем амплитуда сокращений, инициирующих мочеиспускание, и составляет 5–12% [14]. До недавнего времени роль спонтанной ритмической активности практически не учитывалась, поскольку ее физиологическая функция была неясной, и новые данные позволили предположить, что спонтанная ритмическая активность мочевого пузыря является механизмом регуляции его тонуса и может участвовать в передаче информации в центральную нервную систему о степени наполненности мочевого пузыря [14, 20].
Результатом наличия многих пейсмейкерных зон в детрузоре и не координированности их активности являются низкоамплитудные сокращения отдельных групп гладкомышечных клеток, формирующие тонус детрузора, что проявляется в симптомах ГМП.
Целью нашей работы стало выявление морфологических особенностей и изучение экспрессии TLR4 и CD117 при резистентном ГМП и хроническом цистите у женщин репродуктивного возраста и в перименопаузе.
Материал и методы исследования
Исследование выполнено на биоптатах задней стенки мочевого пузыря и перешеечной области, взятых у женщин в ходе цистоуретроскопии с биопсией стенки мочевого пузыря в ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России совместно с ФГБУ НИИ урологии Минздрава России. Исследовано 30 биоптатов, из них 16 получены от пациенток с диагнозом хронический рецидивирующий цистит и 14 – от пациенток с резистентным ГМП (табл. 1).
 Критериями отбора для исследования были: возраст пациенток от 18 до 55 лет; наличие симптомов ГМП: поллакиурия (мочеиспускание более 8 раз в день), ноктурия (более 1 мочеиспускания за ночь) в течение более 3 месяцев; наличие у пациентки как минимум 3 ургентных позывов к мочеиспусканию с недержанием мочи или без него (степень 3 или 4) в течение 3 дней по данным дневника мочеиспусканий; объем остаточной мочи не более 30 мл; диагноз ГМП, подтвержденный комбинированным уродинамическим исследованием; наличие в анамнезе неэффективного лечения М-холиноблокаторами (не менее 2 препаратов в течение не менее 3 месяцев); смешанный тип недержания мочи с преобладанием ургентного компонента; пациентки с хроническим рецидивирующим циститом (не менее 2 эпизодов обострения в 6 месяцев или 3 эпизода в год).
Критериями отбора для исследования были: возраст пациенток от 18 до 55 лет; наличие симптомов ГМП: поллакиурия (мочеиспускание более 8 раз в день), ноктурия (более 1 мочеиспускания за ночь) в течение более 3 месяцев; наличие у пациентки как минимум 3 ургентных позывов к мочеиспусканию с недержанием мочи или без него (степень 3 или 4) в течение 3 дней по данным дневника мочеиспусканий; объем остаточной мочи не более 30 мл; диагноз ГМП, подтвержденный комбинированным уродинамическим исследованием; наличие в анамнезе неэффективного лечения М-холиноблокаторами (не менее 2 препаратов в течение не менее 3 месяцев); смешанный тип недержания мочи с преобладанием ургентного компонента; пациентки с хроническим рецидивирующим циститом (не менее 2 эпизодов обострения в 6 месяцев или 3 эпизода в год).
Средний возраст пациенток составил 40,6±10,4 года. В группе больных ГМП средний возраст составил 38,0±5,4 года, с хроническим циститом – 41,8±2,3 года. Отсутствие достоверных различий по возрасту (p=0,45) позволило провести корректное сравнение указанных морфологических характеристик.
1. Морфологические методы исследования
Материал фиксировали в 10% нейтральном формалине с фосфатным буфером, обрабатывали в аппарате гистологической проводки тканей фирмы «Pool Scientific Instruments» (Швейцария) и заливали в парафин. Суммарное время фиксации, проводки и заливки материала, как правило, не превышало 48 ч. Затем готовились серийные парафиновые срезы (не менее 12 серийных срезов) толщиной 4–5 микрон. Срезы фиксировали на предметные стекла, покрытые адгезивом (полилизин) и инкубировали в термостате при 37 оС в течение 12 ч. Далее срезы депарафинировали и обезвоживали в батарее из 3 ксилолов, 2 абсолютных спиртов, 2 95% спиртов, 80 и 70% спирта и дистиллированной воды. По стеклу от каждого случая окрашивали гематоксилин-эозином и толуидиновым синим (для выявления тучных клеток).
2. Иммуногистохимические методы исследования
Проводились на депарафинированных срезах толщиной 4–5 мкм, расположенных на стеклах, покрытых APES-слоем (A. Janice, 1983). Неокрашенные срезы от каждого случая обрабатывались с помощью стандартного метода иммуногистохимии. В качестве первичных антител использовались моноклональные и поликлональные антитела к CD117, с-kit (YR145) (Cell Marque, 1:100), toll-like receptor 4 (TLR4) (Abbiotec, 1:100).
Оценка интенсивности реакции для TLR4 проводилась по 6-балльной системе: 2 балла – до 20% окрашенных клеток; 4 балла – от 20 до 40% окрашенных клеток; 6 баллов – более 40% окрашенных клеток, а для CD117 – по проценту окрашенных клеток в 5 полях зрения на увеличении 40, что необходимо для более точной оценки экспрессии маркера.
Статистический анализ данных проводили с помощью программ Statistica 10.0 (StatSoft) и Sigma Stat 3.5 (Systat Sowtware Inc.). Вычисляли среднее и стандартную ошибку среднего, а также медианы и межквартильный размах. Межгрупповые сравнения проводили с помощью U-теста Манна–Уитни и критерия Пирсона. Проводили также корреляционный анализ по методу Спирмена. Различия считали статистически значимыми при достигнутом уровне значимости p≤0,05.
Результаты исследования
В ходе морфологического исследования полученных биоптатов были получены характерные патоморфологические особенности представленных нозологий: в группе с клинически подтвержденным циститом биоптаты, как правило, представлены поверхностными слоями слизистой мочевого пузыря, с плоскоклеточной метаплазией в виде многослойного плоского эпителия (МПЭ), с признаками атрофии, в подлежащей строме – диффузная лимфоплазмоцитарная инфильтрация, склероз, гиалиноз стенок сосудов, полнокровие и атрофия мышечных волокон (рис. 1 в, г см. на вклейке). В группе пациенток с ГМП наблюдалась отличная гистологическая картина – биоптаты чаще были представлены поверхностными слоями слизистой мочевого пузыря, покрытой с многорядным эпителием (МРЭ) или метаплазированным МПЭ с гиперкератозом, в подслизистом слое – отек, склероз, тонкостенные сосуды, очаговая воспалительная инфильтрация, а также отмечалась очаговая гипертрофия мышечных волокон (рис. 1 а, б).
 Исследование выявило значимые различия в выраженности некоторых морфологических параметров. Так, атрофия эпителия и атрофия мышечного слоя были более выражены у больных хроническим циститом, отек стромы и гипертрофия мышечного слоя – в группе с ГМП (p<0,05).
Исследование выявило значимые различия в выраженности некоторых морфологических параметров. Так, атрофия эпителия и атрофия мышечного слоя были более выражены у больных хроническим циститом, отек стромы и гипертрофия мышечного слоя – в группе с ГМП (p<0,05).
Межгрупповые сравнения, проведенные с помощью критерия χ2, также выявили статистически значимые различия в частоте обнаружения атрофии эпителия и мышечного слоя при хроническом цистите, отека стромы и гипертрофии мышечного слоя при ГМП (p<0,05).
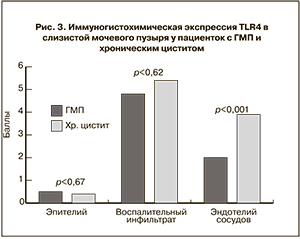
При оценке иммуногистохимической экспрессии TLR4 маркер выявлялся в виде коричневого окрашивания цитоплазмы эпителия, клеток воспалительного инфильтрата и в цитоплазме клеток эндотелия сосудов (рис. 2 а, б см. на вклейке). В связи с тем, что в группе с хроническим циститом при морфологическом исследовании биоптатов чаще выявлялась плоскоклеточная метаплазия с высокой экспрессией TLR4, а при ГМП – многорядный эпителий, также с высокой экспрессией рецептора, следует оценивать общую экспрессию маркера в эпителии в группах, которая значимо не различалась.
Клетки воспалительного инфильтрата также экспрессировали TLR4 (лимфоциты, макрофаги, лейкоциты и др.) в большом количестве в обеих группах, однако статистически значимых различий по группам не выявлено (рис. 3). Однако наличие экспрессии TLR4 в клетках эндотелия сосудов отмечено в основном в группе с хроническим циститом, что, возможно, отражает интенсивность воспалительной реакции в группе данных пациентов.
При иммуногистохимической оценке экспрессии CD117 было обнаружено коричневое окрашивание цитоплазмы клеток стромы и воспалительного инфильтрата (рис. 2 в, г см. на вклейке). Следует отдельно отметить, что толуидиновым синим CD117 положительные клетки не окрашивались, что позволило нам дифференцировать пейсмейкерные и тучные клетки.
При оценке экспрессии CD117 в воспалительном инфильтрате в строме отмечено высокое накопление маркера в клетках в обеих группах, однако при ГМП отмечается тенденция к более высокой экспрессии маркера, особенно в клетках стромы, что, вероятно, является следствием наличия большего количества клеток с пейсмейкерной активностью в стенке мочевого пузыря при данной патологии (рис. 4). Таким образом, нами выявлены морфологические особенности ГМП в виде гипертрофии гладкомышечных клеток и, напротив, атрофия при хроническом цистите и иммуногистохимические особенности – более высокая экспрессии CD117 при ГМП.
Корреляционный анализ объединенных данных обеих групп позволил выявить общие для них характеристики протекания патологических процессов. Интересно, что интенсивность экспрессии TLR4 в эндотелии обнаруживает положительную корреляцию средней силы с атрофией мышц (r=0,812) и отрицательную – с гипертрофией мышц (r=– 0,812).
Интенсивность экспрессии TLR4 в многорядном эпителии в группе пациенток с хроническим циститом не обнаруживала статистически значимой корреляции с атрофией мышц, а с гипертрофией мышц корреляция была положительной (r=0,828).
Обсуждение
В проведенном нами исследовании продемонстрировано, что, несмотря на похожую симптоматику при хроническом цистите и ГМП: учащенное мочеиспускание (более 8 раз в день и более 2 раз за ночь), ургентные позывы к мочеиспусканию, малые или средние объемы мочи при мочеиспускании, дискомфорт во время акта мочеиспускания и др., гистологическая картина отличается. Так, многорядный эпителий наиболее часто встречался в биоптатах стенки мочевого пузыря, полученных от пациенток с подтвержденным ГМП, в то время как плоскоклеточная метаплазия более характерна для хронического цистита; атрофия эпителия и атрофия мышечного слоя были более выражены у больных хроническим циститом, отек стромы и гипертрофия мышечного слоя – в группе ГМП. Тем не менее, в обеих группах отмечались характерные признаки воспалительного процесса: выраженная лимфоплазмоцитарная инфильтрация стромы, гиалиноз и полнокровие сосудов, отек стромы и склероз.
При иммуногистохимической оценке степени экспрессии TLR4 в слизистой мочевого пузыря значимых отличий между группами не выявлено, что, вероятно, связано с наличием общего патологического процесса в тканях – воспаления. Так как TLR4 обеспечивают врожденный иммунитет путем распознавания химических структур, синтезируемых микроорганизмами, а также эндогенных лигандов, образующихся при повреждении собственных тканей организма [20], они являются первыми сигнальными молекулами, распознающими лиганды микроорганизмов и координирующими иммунный ответ слизистой оболочки женского урогенитального тракта [21]. Связывание TLR4 c лигандом приводит к выработке цитокинов и антимикробных пептидов, что опосредуется внутриклеточной передачей сигнала двумя возможными путями. Первый путь связан с включением адаптерного белка MyD88 (белок первичного ответа миелоидной дифференцировки 88), который активирует ядерный транскрипционный фактор NF-kB, инициирующий в ядре транскрипцию генов провоспалительных цитокинов и антимикробных пептидов. Кроме того, TLR 4 способны запускать иммунный ответ по MyD88-независимому пути. Он осуществляется посредством адаптерного белка, индуцирующего интерферон-1β (Toll/ИЛ-1 domain containing adaptor inducing interferon-1β, TRIF), что приводит к фосфорилированию интерферон-регулирующего фактора-3 (IRF-3) [22]. Альтернативный путь стимулирует выработку интерферонов I типа и активацию интерферон-индуцируемых генов [23, 24].
Таким образом, мы пришли к выводу о схожести этиопатогенетического характера обоих заболеваний, в основе которого, очевидно, лежит воспалительный процесс различной степени выраженности, чем объясняется наличие экспрессии TLR4 в клетках эндотелия сосудов в группе с хроническим циститом, что, возможно, отражает большую интенсивность воспалительной реакции в группе данных пациентов.
Кроме того, при анализе иммуногистохимической экспрессии CD117 в клетках воспалительного инфильтрата стромы обнаружена высокая концентрация маркера в группе ГМП и хронического цистита, что подтверждает теорию о том, что именно эти клетки за счет пейсмейкерной функции обеспечивают спонтанную миогенную активность окружающих их гладкомышечных клеток, приводящую к их гипертрофии. Помимо этого, данный факт объясняет и отличия в клинической картине: например, при хроническом цистите ургентные позывы и поллакиурия чаще отмечаются при обострении заболевания, в то время как при ГМП данная симптоматика носит относительно стойкий постоянный характер. Эти отличия, по-видимому, связаны с наличием большего количества клеток с пейсмейкерной активностью при ГМП ввиду обнаруженной нами более выраженной тенденции к высокой экспрессии CD117, чем при хроническом цистите. Очевидно, данные клетки при хроническом цистите вне обострения неактивны, что косвенно подтверждается при гистологическом исследовании выявлением атрофии мышечных клеток.
Заключение
Гипертрофия мышечных клеток и высокая концентрация CD117+ клеток в слизистой стенки мочевого пузыря при ГМП, возможно, являются следствием гиперактивности пейсмейкерных клеток, которая возникла в результате воспаления в слизистой, что подтверждается также высокой экспрессией TLR4.
При хроническом цистите отмечается атрофия мышечных клеток в стенке мочевого пузыря и более выраженный склероз, что является следствием длительно протекающего хронического воспалительного процесса.
Полученные данные подтверждают гипотезу о воспалительном генезе ГМП, что может быть использовано для оптимизации тактики лечения таких пациенток.
Однако данное исследование проведено на малом количестве материала и носит пилотный характер, поэтому необходимо проведение дальнейших научно-исследовательских работ в этом направлении.