Частота рождения недоношенных детей в последнее десятилетие не имеет тенденции к снижению. Данный показатель вариабелен и в большинстве развитых стран Европы находится в диапазоне от 5 до 10%, в Китае – 6%, в различных регионах России составляет от 4 до 16% [1, 2]. Сепсис и тяжелые инфекции остаются одной из актуальных проблем современной неонатологии, несмотря на улучшение показателей выживаемости глубоко недоношенных детей. Клинические проявления раннего неонатального сепсиса (РНС) развиваются у новорожденных в первые трое суток. Основными микроорганизмами, вызывающими РНС у доношенных детей, являются Escherichia coli, Streptococcus agalactiae, Staphylococcus aureus, Listeria spp. [3, 4]. Критерии клинической диагностики РНС у доношенных новорожденных в настоящее время хорошо известны и стандартизованы. У недоношенных детей, родившихся до завершения 34 недели беременности, спектр возбудителей, вызывающих РНС, несколько иной, чем у доношенных новорожденных. Наиболее частыми возбудителями РНС у глубоко недоношенных детей являются Ureaplasma spp., Mycoplasma spp., Fusobacterium spp. Streptococcus spp., Bacteroides spp. и Prevotella spp. [5, 6].
Следует также отметить, что истинная частота РНС, вызванного анаэробными микроорганизмами, в настоящее время неизвестна.
В силу неполноценности механизмов врожденного иммунитета бактериальные инфекции у глубоко недоношенных детей имеют склонность к быстрой генерализации и тяжелому течению. Клиническая картина инфекционных заболеваний часто маскируется другими патологическими состояниями. Частой причиной возникновения угрожающих жизни осложнений при РНС у таких детей является отсроченная постановка диагноза и, как следствие, позднее начало целенаправленной терапии [7].
Ранняя диагностика септического процесса у недоношенных новорожденных сложна ввиду неспецифического характера клинических симптомов, отсутствия надежных диагностических критериев и высокочувствительных биомаркеров. Основными методами обследования новорожденных детей при подозрении на РНС в настоящее время являются микробиологические (посев крови на стерильность), клинико-лабораторные (клинический анализ крови с определением количества лейкоцитов и нейтрофилов в периферической крови, подсчет нейтрофильного индекса, определение белков острой фазы воспаления) и инструментальные (рентгенологическое исследование органов грудной полости) [8].
Традиционная диагностика путем анализа гемокультуры имеет низкую чувствительность и требует длительного времени для проведения исследования. Частота обнаружения возбудителя в крови у больных с сепсисом по данным различных авторов не превышает 45%, а отсутствие бактериемии не исключает развития РНС при наличии основных критериев этого заболевания [9, 10]. В случае выявления возбудителя РНС, как правило, требуется не менее 48 часов для идентификации вида и определения чувствительности к антибиотикам. При этом многие анаэробные бактерии относятся к некультивируемым формам, то есть не растут на питательных средах и могут быть идентифицированы в биологических жидкостях лишь благодаря применению молекулярно-генетических методов. Однако, учитывая крайне незначительное количество возбудителя в кровотоке, прямое определение микроорганизмов в крови сопряжено со значительными технологическими трудностями и не обладает достаточной чувствительностью для ранней диагностики.
Количество лейкоцитов в периферической крови у глубоко недоношенных детей, так же как и у доношенных, зависит от времени взятия образца крови после рождения и имеет ограниченное значение в постановке диагноза РНC. Нейтрофильный индекс (отношение незрелых форм нейтрофилов к их общему количеству) в большей степени позволяет исключить, нежели подтвердить наличие инфекционного процесса в периоде новорожденности [7]. Анализ белков острой фазы воспаления в сыворотке крови при РНС также не всегда является информативным. Выявляемые нередко рентгенологические изменения в виде снижения пневматизации легочной ткани и усиления бронхо-сосудистого рисунка у недоношенных детей не являются специфичными для РНС [3, 10].
Значительным потенциалом в отношении быстрой диагностики РНС, понимания патогенеза, оценки эффективности проводимого лечения и прогнозирования исходов могут обладать молекулярные биомаркеры. Идеальный биомаркер должен быть элементом патогенеза РНС, обладать достаточной чувствительностью и специфичностью. Современные биомаркеры могут быть использованы не только как индикаторы наличия/отсутствия сепсиса, но и для дифференциальной диагностики бактериальной, грибковой и вирусной инфекции, а также для мониторинга эффективности терапии, прогноза развития осложнений и исхода заболевания. Важными факторами должны являться также легкость сбора материала, неинвазивный характер, быстрота исследования, возможность стандартизации в различных клинических лабораториях и точность методики измерения [11, 12]. Биомаркер должен отвечать требованиям концепции SMART, то есть быть:
S – specific and sensitive – чувствительным и специфичным;
M – measurable – измеряемым;
A – available and affordable – доступным;
R – responsive and reproducible – воспроизводимым;
T – timely – своевременным [13].
Таким образом, поиск новых биомаркеров РНС у недоношенных новорожденных представляется особенно актуальным. В последние годы большое внимание уделяется определению роли генов иммунного ответа в патогенезе развития РНС у новорожденных. Хорошим маркером активности гена может служить уровень специфической м-рибонуклеиновой кислоты (мРНК). Применение молекулярно-генетических методов исследования, в частности полимеразной цепной реакции (ПЦР) с детекцией результатов в режиме реального времени (РТ-ПЦР), позволяет с высокой точностью определить количество конкретной изоформы мРНК целевого гена в любом доступном биоматериале. Ответ может быть получен через несколько часов после взятия биоматериала, а широкое распространение технологии РТ-ПЦР в клинико-диагностических лабораториях делает это исследование доступным врачам различных специальностей. Таким образом, анализ транскрипционного профиля генов иммунного ответа полностью соответствует требованиям концепции SMART и может быть использован для ранней диагностики РНС.

Целью исследования стал поиск ранних диагностических биомаркеров РНС у недоношенных новорожденных с использованием молекулярно-генетических методов.
Материал и методы исследования
В период с 08.2012 г. по 03.2015 г. был обследован 71 недоношенный ребенок, проходивший лечение в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) ФГБУ НЦАГиП им. В.И. Кулакова. Исследование было одобрено этическим комитетом Центра. Критериями включения в исследование были: гестационный возраст новорожденных 32 недели и менее и наличие дыхательных расстройств. Из исследования были исключены дети с гемолитической болезнью новорожденных, а также с врожденными пороками развития, требующими срочного хирургического вмешательства.
Все новорожденные с целью диагностики РНС были обследованы согласно протоколу, разработанному в ОРИТН отдела неонатологии и педиатрии ФГБУ НЦАГиП им. В.И. Кулакова и включающему анализ гемокультуры, рентгенологическое исследование органов грудной полости, оценку содержания белков острой фазы воспаления (С-реактивный белок), клинический анализ крови с определением абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса [8].
По результатам проведенного клинико-лабораторного и клинико-инструментального обследования в возрасте 72 часов жизни делали вывод о наличии или отсутствии РНС. Диагноз РНС ставился на основании двух или более клинических симптомов и одного или более лабораторных признаков системной воспалительной реакции, или при наличии инфильтративных изменений в легких по данным рентгенографии органов грудной полости [7].
Все дети, включенные в исследование, были разделены на 2 группы: первую группу составили 40 новорожденных с РНС (основная группа), вторую – 31 ребенок с респираторным дистресс-синдромом (РДС) без клинических проявлений РНС (группа сравнения). Сбор биологического материала (венозная кровь (ВК) и буккальный соскоб (БС)) осуществляли у новорожденных в первые часы жизни, сразу после поступления в ОРИТН до начала медикаментозной терапии и энтерального кормления. Клетки БС получали путем взятия соскоба из защечной области в пробирки с раствором для стабилизации мРНК (лизирующий раствор набора «Проба НК» (ДНК-Технология, Россия)). Кровь для исследования забиралась в пробирку с антикоагулянтом (этилендиаминтетрауксусная кислота). Во избежание деградации мРНК пробирки с кровью немедленно транспортировали в отделение биобанка, где производилось ее аликвотирование (по 100 мкл) в лизирующий раствор набора «Проба НК» (ДНК-Технология, Россия) для стабилизации мРНК. До момента исследования все образцы хранились при -80°С.
Проводили измерение уровней экспрессии следующих генов, участвующих в иммунном ответе: цитокины (интерлейкины (IL)1b, IL6, IL8, IL10, IL12а, IL15, IL18, фактор некроза опухоли (TNF)a, трансформирующий фактор роста (TGF)b1, интерферон γ (IFNG)), транскрипционные факторы (TBX21, GATA3, RORC2), поверхностные клеточные структуры (CD45, CD68, CD69), толл-подобные рецепторы (TLR2, TLR4, TLR9), матриксная металлопротеиназа (MMP8).
Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. Объем образцов после выделения составил 100 мкл. В работе использовались коммерческие реактивы (ДНК-Технология, Россия). Производитель гарантировал отсутствие амплификации на матрице геномной ДНК исследуемых и референсных генов. Это позволило не использовать дополнительный этап обработки нуклеиновых кислот ДНК-азой. Реакцию обратной транскрипции (ОТ) ставили в объеме 40 мкл (в реакцию брали 33 мкл образца). В качестве праймеров для ОТ использовали специфические олигонуклеотиды. Реакцию проводили при температуре 40˚С в течение 30 мин, с последующей инактивацией обратной транскриптазы при 95˚С в течение 5 минут. Для увеличения объемов образцов после ОТ кДНК разводили в 5 раз в ТЕ-буфере. Амплификацию осуществляли в режиме реального времени на приборе «ДТ-384» в объеме 12,5 мкл по следующей программе: 1 цикл – 80˚С 30 сек, 94˚С 1 мин 30 сек; 50 циклов – 94˚С 20 сек, 62˚С 20 сек; 10˚С – хранение 94ºС Измерение уровня флуоресценции проводили на каждом цикле при температуре 62ºС по каналу FAM. Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по четырем референсным генам HPRT1, TBP, B2M, GUSB. Использован метод сравнения индикаторных циклов (метод Δ∆Cр).
Статистическую обработку результатов исследования уровней экспрессии генов проводили с использованием методов непараметрического анализа. Исследованные количественные показатели представлены в виде Ме (L-H), где Ме – медиана, L – нижний квартиль, Н – верхний квартиль.
Для наглядности представления экспрессионного профиля была проведена нормировака на уровень экспрессии соответсвующего гена в группе сравнения. Значения Ме в группе сравнения были приняты за 1, а значения Ме в исследуемой группе показывали, во сколько раз уровень экспрессии гена был выше или ниже по отношению к группе сравнения. Для сопоставления двух групп по количественным признакам использовался U-критерий Манна–Уитни. Статистическую значимость различий двух или нескольких относительных показателей оценивали с помощью критерия χ2. Различие между группами полагали статистически значимым при p<0,05. Для дискриминации образцов в группах использовался многофакторный анализ (бинарная логистическая регрессия), который позволил вычислить вероятность «классификации в группу наличия признака или заболевания» (Р) для каждого клинического образца. Для рассчёта оптимального значения величины порога отсечения Р (точки cut off) использовали ROC-анализ (Receiver Operator Characteristic).
По техническим причинам у 4 детей не удалось получить образцы БС. В 13 случаях экспрессия референсных генов в образцах БС была крайне низкой ввиду недостаточного количества биологического материала. Также из исследования были исключены 2 образца крови (по 1 из каждой группы) в связи с присутствием ингибиторов ПЦР.
 Результаты исследования
Результаты исследования
Клиническая характеристика новорожденных представлена в таблице. По большинству перинатальных параметров обе группы пациентов были сопоставимы.
Анализ уровня экспрессии мРНК показал, что транскрипты всех изучаемых генов были детектированы как в клетках БС (n=54), так и в клетках ВК (n=69) новорожденных. Первоначально в ВК и БС был исследован пул из 20 маркеров, однако в результате проведенного первичного анализа ряд генов: IL6, IL12A, IL10, IL18, RORC2 в клетках ВК и IL6, IL10, IL15, IFNG, TLR9 в клетках БС были исключены из дальнейшего анализа ввиду низкого уровня экспрессии (менее 103 копий мРНК на образец). Значения уровней экспрессии мРНК других генов находились в области линейного диапазона и детектировались во всех образцах, что позволяло использовать их для дальнейшего анализа. Количество анализируемых транскриптов в образцах варьировало в диапазоне от 103 до 106 копий мРНК/образец.
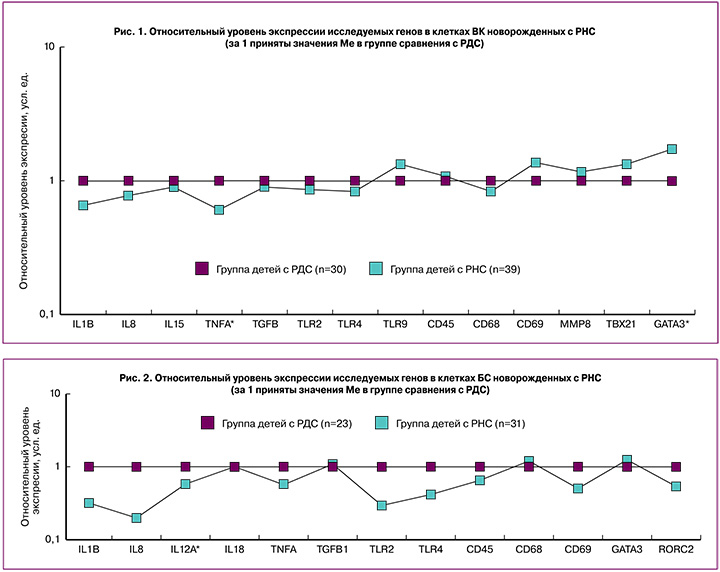
В результате проведения сравнительного анализа нами были получены статистически значимые различия в отношении ряда изучаемых маркеров в клетках БС и ВК у недоношенных новорожденных с наличием РНС и без признаков инфекции. В клетках ВК недоношенных новорожденных с РНС было выявлено достоверное снижение экспрессии TNFA в 2 раза (p=0,021) и повышение GATA3 в 2 раза (p=0,045) по сравнению с группой сравнения (рис. 1).
Была выявлена тенденция к повышению экспрессии мРНК TLR9 в группе новорожденных с РНС по отношению к группе сравнения, однако различия не достигли уровня статистической значимости (p=0,066). Также в группе новорожденных с РНС отмечалось общее снижение экспрессии некоторых генов врожденного иммунитета (TLR2, TLR4) и провоспалительных цитокинов (IL1B, IL8).
В результате анализа транскриптов в клетках БС в группе детей с признаками РНС получено достоверное снижение экспрессии мРНК IL12А в 2 раза (p=0,003) по сравнению с группой детей с дыхательной патологией неинфекционного генеза. Следует отметить общее снижение представленности транскриптов некоторых генов провоспалительных цитокинов (IL1B, IL8) и толл-подобных рецепторов (TLR2, TLR4) в группе детей с проявлениями РНС (рис. 2).
При построении математической модели для дифференциальной диагностики РНС использовался многофакторный анализ (бинарная логистическая регрессия). В результате анализа методом обратной селекции были идентифицированы два 2 ключевых гена (IL12A и CD68), экспрессия которых вносит наибольший вклад для дискриминации групп. Значение экспрессии этих генов в клетках БС дало возможность дифференцировать новорожденных с РНС и новорожденных с дыхательными нарушениями иного генеза. Уравнение классифицирующей функции, полученное при многофакторном анализе, имело вид:
Y= -20,48×[IL12A]+0,22×[CD68]+0,40, где
[IL12A] – уровень экспрессии мРНК IL12A в БС,
[CD68] – уровень экспрессии мРНК CD68 в БС.
Необходимо отметить, что анализируемые маркеры ВК не вошли в модель, что может быть связано с высокой информативностью БС, так как развитие РНС связывают с наличием микроорганизмов в генитальном тракте матери, инфицирование которыми приходит внутриутробно или во время родов при прохождении через родовые пути [8]. В качестве входных ворот инфекции в данном случае выступает ротоглотка новорожденного, и состояние локального иммунитета в ней может определять вероятность инфицирования.
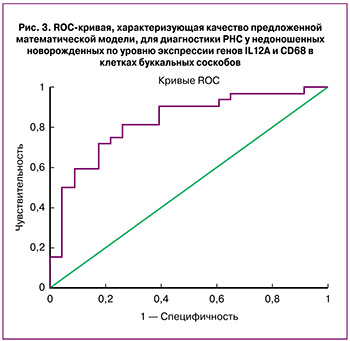
Для определения качества предложенной диагностической модели РНС с использованием полученного линейного уравнения был выполнен ROC-анализ. Площадь под ROC-кривой (AUC) составила 0,83 (0,72–0,94, р<0,05), что согласно экспертной шкале для оценки предсказательной способности модели позволило классифицировать ее как «очень хорошую». Чувствительность и специфичность предложенной модели в области порогового значения составила 81 и 74% соответственно (рис. 3). В качестве порогового значения (точка cut-off) выбрано значение функции, соответствующее максимальной сумме чувствительности и специфичности предложенной модели, которое составило 0,45. Значения показателей функции выше 0,45 следует классифицировать как маркер РНС.
Обсуждение
В процессе нормально протекающей беременности иммунная система плода и иммунная система матери находятся в состоянии равновесия и иммунологической толерантности. «Иммунологическая провокация» со стороны плода по отношению к материнскому организму может привести к преждевременным родам. В связи с чем, в норме иммунный ответ новорожденных смещен в сторону противовоспалительного Th2-ответа.
При реализации РНС инфицирование плода бактериальными патогенами чаще всего происходит антенатально восходящим путем вследствие проникновения микроорганизмов из цервикального канала с последующим развитием хориоамнионита, а также при внутриутробном заглатывании амниотической жидкости или в результате аспирации инфицированных околоплодных вод во время родов [14]. Наличие патогенных и условно-патогенных микроорганизмов приводит к стимуляции иммунокомпетентных клеток, и клеток буккального эпителия, что влечет за собой изменение уровня экспрессии ряда молекул данными клетками. Взаимодействие структур микроорганизмов с паттерн-распознающими рецепторами, прежде всего толл-подобными рецепторами (TLR-2, TLR-4)
на поверхности дендритных клеток, макрофагов, эпителиальных клеток приводит к изменению синтеза TNF-α, IL-1β, IL-6, IL-8, IL-12 [15, 16]. Преобразование транскрипционной активности одних клеток приводит к направленной миграции других и, как следствие, к изменению локального клеточного состава. Все эти события предшествуют развитию РНС и происходят в процессе антенатального или интранатального инфицирования плода.
Отличительной чертой иммунной системы недоношенных новорождённых является малочисленный пул моноцитов и нейтрофилов, который не способен бороться в полной мере с патогенными микроорганизмами, по сравнению с детьми, рожденными в срок [17]. Индуцированные мононуклеары новорожденных по сравнению со взрослыми людьми секретируют заметно меньше провоспалительных Th1-поляризационных цитокинов (TNF-α, интерферон (IFN)-γ и субъединицы p70 IL-12), в то время как секреция IL-6, цитокина с противовоспалительными и Th2-поляризующими свойствами, у них значительно выше [18, 19]. Достоверное увеличение экспрессии транскрипционного фактора GATA3 в клетках ВК, ответственного за дифференцировку наивных Th-лимфоцитов в сторону Th2-клеток в группе недоношенных детей с признаками врожденной инфекции свидетельствует о смещении иммунологического ответа в сторону противовоспалительного, что вероятно связано с поддержанием состояния иммунологического равновесия во внутриутробной среде.
Показано, что врожденный иммунитет недоношенных детей при внутриутробном инфицировании развивается быстрее по сравнению с неинфицированными детьми, при этом выявлено истощение пула моноцитов при активации механизмов иммунной защиты новорожденных, подвергавшихся внутриутробному воздействию патогенов [20]. На этом фоне первостепенное значение для защиты новорожденных от инфекции принадлежит факторам врожденного иммунитета, среди которых наиболее значимыми являются фагоциты, способные быстро мигрировать к месту инвазии патогена, распознавать его и обезвреживать за счет действия бактерицидных ферментов и небелковых молекул [21].
Проведенное исследование показало, что как в клетках ВК, так и в клетках БС в группе недоношенных детей, развивших РНС после рождения, имеется общая тенденция к снижению экспрессии мРНК генов врожденного иммунитета TLR2, TLR4, IL1B, IL8 и TNFA по сравнению с группой новорожденных с дыхательными нарушениями неинфекционной природы. Данные результаты могут свидетельствовать либо о врожденной недостаточности иммунной системы таких детей, либо являются следствием истощения компонентов системы врожденного иммунитета вследствие внутриутробного течения инфекции.
В результате анализа транскриптов в клетках БС в группе детей с признаками РНС нами получено достоверное снижение экспрессии мРНК IL12А в 2 раза по сравнению с группой детей с дыхательной патологией неинфекционного генеза. Похожая картина описана для слизистой влагалища при вагинитах, ассоциированных с чрезмерным ростом условно-патогенных микроорганизмов, что свидетельствует о единых механизмах мукозального иммунитета. На большой выборке пациенток было показано снижение представленности транскриптов IL12A и IL18 в клетках соскобов слизистой влагалища [20]. Основными клетками-продуцентами IL12 являются моноциты, макрофаги, дендритные клетки, нейтрофилы, активированные лимфоциты. Возможно, снижение количества транскрипта IL12A в клетках БС недоношенных новорожденных с РНС связано с миграцией антиген презентирующих клеток в региональные лимфоузлы для презентации антигенов Т-лимфоцитам.
Таким образом, транскрипционный профиль клеток слизистой ротовой полости может служить дополнительным критерием дифференциальной диагностики РНС. Предложенный способ основан на измерении экспрессии генов в клетках БС новорожденных и имеет ряд преимуществ перед традиционно применяемыми диагностическими методиками, а именно: неинвазивность процедуры получения биологического материала, быстрота выполнения исследования (около 4 ч от момента поступления образца в лабораторию до получения результатов). Очевидны и возможные перспективы широкого использования данного подхода в будущем для диагностики и оценки эффективности проводимой терапии у новорожденных.
Заключение
Течение РНС у недоношенных детей сопровождается общим состоянием иммуносупрессии, которое проявляется в изменении экспрессии генов IL12A в клетках буккального эпителия и TNFA и GATA3 в ВК. Оценка профиля экспрессии генов врожденного иммунитета в клетках БС является информативным и неинвазивным методом диагностики РНС у недоношенных новорожденных. В ходе проведенного исследования создана математическая модель, позволяющая на основании определения уровня экспрессии генов-кандидатов IL12A и CD68 в клетках БС недоношенных детей, с высокой чувствительностью и специфичностью диагностировать РНС. Необходимо проведение дальнейших исследований на большой выборке новорожденных с целью совершенствования предложенной диагностической методики. Применение в клинической практике данных молекулярных биомаркеров позволит валидировать их использование для улучшения результатов диагностики и лечения РНС. В эру персонализированной медицины биомаркеры могут также служить ключевым инструментом для индивидуального подбора и контроля эффективности терапии у новорожденных с клиникой РНС, находящихся в критическом состоянии.
По результатам проведенного исследования в «Федеральный институт промышленной собственности» (ФИПС) подана заявка на изобретение «Способ диагностики раннего неонатального сепсиса у новорожденных первых суток жизни по профилю экспрессии мРНК в клетках буккального соскоба» (регистрационный №2016115704).



