Назначение низкомолекулярных гепаринов (НМГ) во время беременности до сих пор остается дискуссионным вопросом. Проблема прокоагулянтных изменений в системе гемостаза в этот важный период жизни женщины находится на стыке специальностей, и до настоящего времени обсуждается необходимость коррекции выявленных изменений [1–3].
Одним из компонентов патогенеза акушерских осложнений является не диагностированное состояние протромботической готовности [1, 3, 4]. Как правило, исследование системы гемостаза у беременных редко проводится в первую беременность. Чаще всего это женщины с осложненным акушерским анамнезом (ОАА).
В настоящее время нет четких клинических рекомендаций, которые бы регламентировали назначение и контроль антикоагулянтной профилактики у женщин с ОАА (вследствие доказанной патологии системы гемостаза) с целью улучшения исхода наступившей беременности. Современные рекомендации, в том числе отечественные, по проблемам назначения НМГ, касаются лишь вопросов тромбопрофилактики в антенатальном и постнатальном периодах и не рассматривают влияние назначения НМГ на наступление, пролонгацию и успешный исход беременности. Показания к данной профилактике основаны на балльной оценке совокупности факторов риска и не предусматривают лабораторный контроль за назначенной профилактикой и индивидуального подхода [5–8].
Физиологическая беременность протекает с развитием гиперкоагуляции, которая обусловлена увеличением уровня факторов свертывания, повышением агрегации тромбоцитов и снижением активности системы фибринолиза и протеина S [9, 10]. Но если у женщины есть исходная предрасположенность к патологической гиперкоагуляции или исходное протромботическое состояние, возможно, произойдет реализация клинически значимых акушерских осложнений и/или тромбоза.
Данные исследователей показывают тесную связь между ОАА и патологическим гиперкоагуляционным состоянием (протромботической готовностью), являющимся одним из основных факторов риска в развитии акушерских осложнений, так как именно плацента является основным органом – мишенью в этих условиях. Также имеются данные, которые свидетельствуют о пользе применения НМГ и аспирина с целью снижения риска возможных осложнений, не только тромботических, но и акушерских [1–3, 11–14].
По данным зарубежных авторов вопрос назначения гепаринов для улучшения исходов беременности у женщин с ОАА также является спорным, исключение составляет антифосфолипидный синдром. Однако исследования в основном нацелены на сравнение групп с различными дозировками того или иного НМГ или НМГ+ацетилсалициловая кислота (АСК) и плацебо, с включением или исключением женщин с тромбофилиями, но не предусматривают лабораторный контроль назначенной терапии [15–20].
Большинство стандартных исследований показателей гемостаза изолированно оценивают тот или иной этап свертывания крови. Полученные результаты (иногда разнонаправленные) довольно часто не позволяют принять убедительное решение о необходимости назначения антитромботических препаратов (при явной клинике или ОАА), а также не обеспечивают эффективный мониторинг за уже назначенной терапией [21].
С введением в практику глобальных тестов оценки системы гемостаза появились гораздо более широкие возможности по индивидуальному контролю не только за антикоагулянтами, но и за комбинацией антикоагулянтов с дезагрегантами с прогнозированием, как риска кровотечения, так и эффективности назначенной терапии, что особенно актуально во время беременности. С этой целью с успехом используются тромбоэластометрия (ROTEM/ТЭГ) и тромбодинамика [22, 23].
Тромбодинамика (ТД) – это тест для исследования пространственной динамики роста сгустка. Основные параметры метода: а) время задержки образования сгустка Tlag (мин); б) начальная скорость роста сгустка Vi (мкм/мин); в) стационарная скорость роста сгустка Vst (мкм/мин); г) размер сгустка CS (мкм); д) плотность сгустка D (усл. ед.); е) время спонтанного тромбообразования Tsp (мин) – является маркером сугубо патологического гиперкоагуляционного состояния. Для каждого триместра беременности определены допустимые референсные диапазоны [24]. Выявленная патологическая хронометрическая гиперкоагуляция (патологическое увеличение скоростей) предполагает назначение антикоагулянтов, а структурная гиперкоагуляция (патологически увеличенная плотность сгустка) и спонтанные сгустки – сочетание антикоагулянтов с дезагрегантами.
При использовании глобальных тестов для оценки эффективности и безопасности назначенной антитромботической терапии важно помнить о цели назначения исследования. Если забор крови осуществляется на пике действия НМГ (через 3–4 часа после инъекции), результат позволяет оценить риск кровотечений, что особенно актуально на 36–37-й неделе беременности для принятия решения о времени отмены НМГ перед родами. Если забор крови осуществляется на исходе действия НМГ (через 12–24 часа от последней инъекции, непосредственно перед очередной инъекцией), результат позволяет оценить риск тромботических осложнений, провести коррекцию дозы в случае необходимости [23].
В данной работе представлены предварительные результаты исследования, целью которого является апробация применения НМГ (часто в сочетании с дезагрегантами) в индивидуально подобранной дозировке для улучшения исхода беременности у женщин с ОАА. Мониторинг терапии и подбор дозы НМГ осуществляется под контролем ТД, основным преимуществом которой является возможность отличить патологическую гиперкоагуляцию от физиологической. Считаем обоснованным именно индивидуальный подбор дозы НМГ и АСК, причем не только у женщин с ОАА и доказанной тромбофилией, но и в случае ОАА и носительства генетических протромботических полиморфизов. Индивидуальный подбор дозы, по полученным данным, позволяет существенно улучшить исход беременности и снизить риск геморрагических осложнений.
Несмотря на то что исследование еще продолжается, предварительные результаты показывают эффективность выбранной тактики и позволяют сделать предварительные выводы.
Цель исследования: обоснование необходимости применения и лабораторного мониторинга НМГ (в сочетании с/или без АСК) у беременных с ОАА для улучшения исхода наступившей беременности.
Материал и методы исследования
В настоящее время в исследование включены 58 пациенток (набор продолжается, ожидаемое число включенных пациенток – 100). Медиана по возрасту в выборке на данный момент 31 год (23–45 лет). Пациентки распределяются в 4 подгруппы: бесплодие (в анамнезе), ранние выкидыши до 12 недель (в анамнезе), поздние выкидыши с 12 до 22 недель (в анамнезе), преждевременные роды с 22 до 36 недель (в анамнезе).
Критерии включения:
- наличие в анамнезе бесплодия, неудач ЭКО, выкидышей на различных временных сроках, преждевременных родов;
- предыдущие неудачные попытки вынашивания беременности без применения антитромботической терапии, либо удачное вынашивание предыдущих беременностей на фоне антитромботической терапии.
В табл. 1 представлены данные по срокам включения в исследование по группам. Наибольшее количество пациенток было включено в первом триместре (26 человек), и во втором триместре (25 человек), причем подавляющее большинство из них – в сроки до 20 недель.
На этапе включения всем пациенткам проведено исследование следующих параметров системы гемостаза: генетический паспорт (тромбофилия, кардиориск), D-димер, протеин С, антитромбин (АТ) III, растворимый фибрин-мономерный комплекс (РФМК), плазминоген, XIIa-зависимый фибринолиз, фибриноген, тромбодинамика. В последующем за время наблюдения проводился контроль: каждые 2 недели – D-димер, XII а зависимый фибринолиз, каждые 4 недели – тромбодинамика (забор крови осуществлялся перед очередной инъекцией НМГ – на исходе действия – для оценки риска тромботических осложнений). Назначение или коррекция дозы НМГ проводились в случае выявления патологической хронометрической гиперкоагуляции (увеличение скоростей или размера сгустка). Назначение или увеличение дозы АСК проводились в случае выявления патологической структурной гиперкоагуляции (увеличение плотности и/или размеров сгустка) и/или выявлении спонтанного образования сгустков (но не более 150 мг/сут).
Оборудование и реагенты: Генетический паспорт «Тромбофилия. Кардиориск» (ДТ Прайм, ДТ Лайт; ООО «ДНК-Технология»); D-димер (CA-1500. CS2000i, «Siemens Inc»); протеины С и S (CA-1500. CS2000i, «Siemens Inc»); АТ III (антитромбин III) (CA-1500. CS2000i, «Siemens Inc»); РФМК (НПО «Ренам»); Плазминоген (CA-1500. CS2000i, «Siemens Inc»); XIIa зависимый фибринолиз (НПО «Ренам»); Фибриноген (CA-1500. CS2000i, «Siemens Inc»); Волчаночный антикоагулянт (CA-1500. CS2000i, «Siemens Inc»); Тромбодинамика (Система диагностическая лабораторная «Регистратор тромбодинамики Т-2» и наборы реагентов, ООО «ГемаКор»).
Статистическая обработка данных проведена с использованием программ «MedCalc Statistical Software 14» и «Origin Pro 8.1». С учетом того, что анализируемые выборки не подчиняются закону нормального распределения, в качестве меры среднего выбрали медиану [25].
Плазму для анализа получали из образцов крови, заготовленных стандартным образом в вакуумных пластиковых пробирках с 3,2% (0,109 М) цитратом натрия при соотношении крови к цитрату – 9:1. Определение параметров стандартных тестов проводили в бедной тромбоцитами плазме, для получения которой кровь центрифугировали 15 мин при 1600 g и комнатной температуре и отбирали верхнюю часть (~ 75%) полученной плазмы. Для проведения теста тромбодинамики использовали свободную от тромбоцитов плазму, которую получали путем дополнительного центрифугирования бедной тромбоцитами плазмы в течение 5 мин при 10 000 g и комнатной температуре. Для анализа отбирали верхнюю часть (~ 90%) полученной свободной от тромбоцитов плазмы.
В табл. 2 представлены данные по срокам назначения НМГ. В трех группах (бесплодие, ранние выкидыши, преждевременные роды) в подавляющем большинстве случаев НМГ были назначены в сроки до 10 недель. Обращает на себя внимание группа пациенток с поздними выкидышами в анамнезе, это беременные, которым был назначен НМГ после первого исследования ТД уже на более поздних сроках (после 15 недель).

Результаты исследования
Тромбофилии и носительство протромботических полиморфизмов
В настоящее время роль врожденной тромбофилии как фактора риска развития акушерских осложнений оспаривается многими авторами, также противоречивы данные о вкладе носительства протромботических полиморфизмов [1, 3, 4, 12, 26–30].
Проведен анализ распространенности носительства наиболее изученных протромботических полиморфизмов по группам. Данные представлены в табл. 3.
В группе с бесплодием в анамнезе выявлено полное отсутствие мутации FV и FII, при относительно небольшом (по сравнению с другими группами) носительстве протромботических полиморфизмов, что приводит к заключению, что бесплодие у данных пациенток в большей степени связано не с патологией системы гемостаза, а с имеющейся гинекологической патологией. Но на фоне проведения стимуляции суперовуляции или назначения эстрогенов (в рамках протокола ВРТ) формируется протромботическое состояние, требующее коррекции.
В группе с ранними выкидышами обращает внимание присутствие мутации FV (10%), резкое увеличение процента носительства полиморфизмов ITGА2 (56,7%) и ITGВ3, а также PAI-1 (56,7%) по сравнению с группой с бесплодием в анамнезе. На основании полученных данных можно предположить, что коррекция нарушений в системе гемостаза, обусловленных достаточно высокой частотой носительства указанных полиморфизмов, уже с самых ранних сроков позволяет смоделировать физиологическое состояние кровотока в спиральных артериях в момент нидации плодного яйца и избежать патологии первой волны инвазии синцитиотрофобласта (полноценное короткодистанционное погружение бластоцисты).
В группе с поздними выкидышами выявлено максимальное носительство мутации FV (33%) и полиморфизмов ITGА2 (83,4%) и PAI-1 (100%). Полученные данные позволяют сделать предположение, что в генезе потерь беременности на поздних сроках (от 12 до 22 недель) одним из основных патогенетических механизмов потенциально является именно протромботическое состояние.
В группе с преждевременными родами в анамнезе зафиксировано носительство мутации FV (7%) и гена протромбина FII (14%), что позволяет предположить, что тромбофилия начинает оказывать свое патологическое влияние на поздних сроках беременности. Также обращает внимание достаточно высокий процент носительства полиморфизмов ITGА2 (85,7%) и PAI-1 (92,9%).
Показатели системы гемостаза и ТД
Проведен анализ показателей системы гемостаза и ТД, полученных на этапе включения пациенток в исследование, то есть в стартовой точке. На этом этапе подавляющее число пациенток уже получали НМГ. Забор крови в этом случае проводился до очередной инъекции (на исходе действия препарата). Обращает на себя внимание только группа с поздними выкидышами в анамнезе, ни одна из этих пациенток НМГ до включения в исследование не получала.
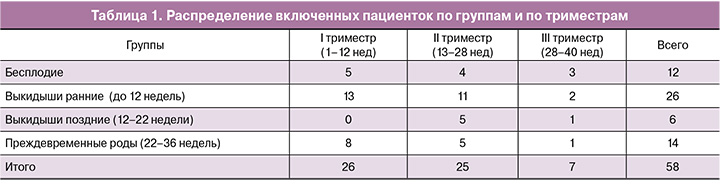
На рис. 1 представлено распределение параметра теста ТД Vst в стартовой точке наблюдения. Прерывистой линией нанесена граница референсного диапазона норм для условно здоровых беременных. Звездочкой отмечено статистически достоверное отличие между выборками.
Параметр ТД стационарная скорость (Vst) имеет достоверно более высокие значения в группе с поздними выкидышами (до 22 недель), это группа беременных, которые не получали НМГ до проведения первого исследования
Наибольший процент спонтанного тромбообразования (33,3%) также регистрируется в группе с поздними выкидышами (до 22 недель). Данный показатель свидетельствует о высокой протромботической готовности и предполагает назначение не только НМГ, но и АСК.
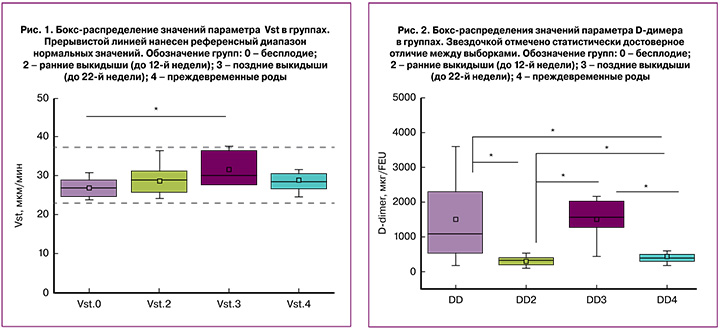
На рис. 2 представлены распределения значений D-димера в зависимости от группы. Статистически достоверного отличия по уровню D-димера не было выявлено только между группами с бесплодием и поздними потерями (до 22 недель), которые демонстрируют максимальные значения уровня D-димера на этапе включения. Это связано, вероятно, с тем, что подавляющее большинство пациенток с бесплодием были включены в исследование на момент прохождения программы ВРТ/ЭКО, которая часто сопровождается выраженной патологической гиперкоагуляцией вследствие назначения препаратов для стимуляции суперовуляции и хорионического гонадотропина человека.
Кроме того, беременные с поздними выкидышами в анамнезе не получали НМГ до включения в исследование. На основании полученных данных можно предположить, что показатель D-димера полезен и показателен для оценки протромботической готовности до назначения НМГ, но менее информативен в процессе мониторинга эффективности назначенной терапии.
Во всех группах выявлена стойкая положительная корреляция между стационарной скоростью роста сгустка (Vst) и размером сгустка (CS), что представляется логичным и объясняет «кинетику» роста сгустка – «чем выше скорость, тем выше размер». В группе с поздними выкидышами в анамнезе, которая не получала терапию до включения в исследование, выявлена стойкая обратная корреляция (–0,71) между показателем активности фибринолитической системы и размером сгустка, то есть чем медленнее распадается сгусток (чем более выражен гипофибринолиз), тем больше размер образующегося сгустка. Это свидетельствует о необходимости оценки активности фибринолитической системы как важного маркера патологической гиперкоагуляции.
Кроме того, обращает на себя внимание положительная корреляция (0,57) между уровнем D-димера и стационарной скоростью роста сгустка (Vst) по данным ТД у беременных с поздними выкидышами в анамнезе. То есть у женщин, не получавших терапию НМГ, повышенный D-димер достоверно свидетельствует о патологической гиперкоагуляции, что подтверждает наше предположение о целесообразности оценки его исходного значения при принятии решения о необходимости назначения терапии НМГ.
У пациенток 4-й группы (с преждевременными родами в анамнезе) выявлена положительная корреляция между гипофибринолизом и повышенным уровнем D-димера (0,62), гипофибринолизом и высокой плотностью сгустка (0,68). В этой группе самый высокий процент носительства гомозиготного варианта PAI-1, что предопределяет наиболее выраженные нарушения в системе фибринолиза, сопровождающиеся соответственно более выраженным протромботическим состоянием.
На основании полученных результатов после проведения первого исследования (включения в протокол) была проведена коррекция дозы НМГ (эноксапарин), либо принято решение о назначении антитромботической терапии. До включения в исследование подавляющее большинство пациенток получали эноксапарин в дозах 0,2 мл 1 раз в сутки – в 35 случаях; 0,2 мл 2 раза в сутки – в 9 случаях; вессел дуэф – в 2 случаях, и часть пациенток получала АСК с 12 недель 50 мг однократно в сутки.
На основании динамического контроля терапии НМГ и АСК по показателям уровня D-димера, фибринолиза и ТД была проведена коррекция доз препаратов. К моменту проведения статистической обработки доза эноксапарина была увеличена: до 0,2 мл 2 раза в день у 38 пациенток (65,5%); до 0,6 мл (0,4 мл + 0,2 мл) у 8 пациенток (13,8%); до 0,4 мл 2 раза в день у 3 пациенток (5,2%) и до 1,0 мл (0,6 + 0,4 мл) у 2 пациенток (3,4%). Доза АСК 50 мг в сутки осталась без изменения у 45 пациенток (77,6%); была увеличена до 100 мг – у 9 пациенток (15,5%) и до 150 мг в сутки – у 4 пациенток (6,9%).
К моменту проведения статистического анализа роды в срок произошли у 24 пациенток (41,7%), ни одной потери беременности не было.
Обсуждение
Таким образом, при анализе носительства наиболее распространенных врожденных тромбофилий и полиморфизмов системы гемостаза выявлена высокая значимость для потерь беременности на разных сроках полиморфизмов ITGA2, ITGB3 и PAI-1, при сравнительно небольшом вкладе врожденных тромбофилий. В связи с чем женщин с ОАА на этапе подготовки к беременности необходимо обследовать не только на носительство врожденной тромбофилии (как фактор риска потерь на больших сроках), но и на носительство наиболее значимых протромботических полиморфизмов.
На основании полученного опыта, данных исследования, полученных результатов хотелось бы сделать предварительные комментарии:
Суточную дозу НМГ необходимо делить на 2 инъекции, если позволяет дозировка;
У беременных с привычным невынашиванием в анамнезе доза НМГ не должна назначаться стандартно, расчет дозировки НМГ не может быть осуществлен исходя из веса и требует индивидуального подбора и контроля по результатам ТД;
В случае выявления высокой плотности сгустка по данным ТД и/или выявлении спонтанного образования сгустков в тесте ТД необходимо к терапии НМГ добавлять аспирин (даже при нормальных показателях агрегации тромбоцитов).
По предварительным данным, назначение НМГ с максимально ранних сроков обеспечило 100% пролонгирование беременности в исследовании. Коррекция профилактических доз НМГ «на увеличение» проведена в 87,9% случаев, в 3,4% случаев доза НМГ была повышена до терапевтической (коррекция антитромботической терапии проводилась в большей степени по данным теста ТД). На данный момент в протоколе преодолены критические точки: бесплодие – 100%; потери на ранних сроках (до 12 недель) – 100%; потери на поздних сроках (до 22 недель) – 84,5%; преждевременные роды (до 36 недель) – 33%. Роды в срок произошли у 24 пациенток (41,7%), ни одной потери беременности на данный момент протокола не отмечено.
Таким образом, можно сделать следующие выводы:
- Пациентки с ОАА на этапе предгравидарной подготовки нуждаются в комплексной оценке системы гемостаза, назначении НМГ и АСК с этапа зачатия в случае исходной патологической гиперкоагуляции.
- Метод ТД полезен для исходной оценки системы гемостаза, мониторинга антикоагулянтной и дезагрегантной терапии у женщин с ОАА; чувствителен к скрытой гиперкоагуляции и позволяет подобрать оптимальную и безопасную дозу препаратов.
- Назначение антикоагулянтной терапии у пациенток с ОАА (даже в случае предшествующих потерь на поздних сроках), с наиболее ранних сроков позволяет существенно улучшить исход наступившей беременности.
Заключение
Большинство исследований (в том числе зарубежных), которые проводились и проводятся в настоящее время у беременных с ОАА с целью улучшения исходов беременности, ставят перед собой задачи оценить эффективность разных сочетаний НМГ с АСК или без АСК и плацебо. Дозы препаратов назначаются стандартно, не предусмотрен лабораторный контроль, то есть подбор дозы индивидуален [15, 16, 18–20]. Наше глубокое убеждение состоит в том, что в каждом конкретном случае решение о назначении антитромботической терапии (НМГ с или без АСК) должно приниматься индивидуально, исходя из анамнеза пациентки (личного акушерского, семейного тромботического), при выявлении протромботического состояния и проводиться под жестким контролем показателей системы гемостаза. И в этом плане перспективно использование теста тромбодинамики. Только индивидуальный подход к каждой женщине позволит добиться максимального результата.



