Одной из актуальных проблем современного акушерства остается преэклампсия (ПЭ), представляющая мультисистемное заболевание. В настоящее время принято выделять два основных варианта ПЭ в зависимости от ее течения: раннюю, ассоциированную с нарушением инвазии трофобласта, и позднюю, обусловленную нарушением иммунологической толерантности [1, 2]. Ключевыми процессами развития плаценты являются инвазия и миграция клеток трофобласта в эндометрий, клеточная пролиферация, апоптоз, и ангиогенез, обеспечивающий ремоделирование спиральных артерий [3–5]. Синхронная регуляция каждого из этих процессов ассоциирована с активизацией или выключением большого количества генов, расположенных в разных хромосомах. Важная роль во временной регуляции фукционирования генов принадлежит микроРНК [6]. МикроРНК – короткие одноцепочечные молекулы длиной 20–25 нуклеотидов, осуществляющие регуляцию экспрессии генов на посттранскрипционном уровне [7]. По данным базы данных miRBase у человека выявлено 2216 зрелых молекул микроРНК, контролирующих функциональную активность трети генов генома [8]. При использовании современной технологии полногеномного скрининга было показано, что в плаценте экспрессируются более 600 разных микроРНК, большая часть из которых синтезируются в клетках трофобласта [9]. Они участвуют практических во всех фундаментальных клеточных процессах развития плаценты от момента прикрепления бластоцисты и до ее отторжения при родах, включая адаптацию эмбриона к иммунной системе матери, миграцию, инвазию, клеточную пролиферацию, апоптоз, ангиогенез. Отклонение уровня экспрессии этих микроРНК от нормы ассоциируется с нарушениями плацентации, приводящими к различным осложнениям беременности [10–13].
К плацентарным микроРНК относятся также has-mir-29b-3р, has-mir-34a-5p, has-mir-141-3p и miR-376с-3p, экспрессия которых выявлялась в плазме и сыворотке крови беременных [9]. В ряде работ было показано, что содержание этих микроРНК может меняться при угрозе прерывания беременности, отслойке плаценты, задержке роста плода и ПЭ [11, 14, 15]. В связи с этим целью настоящей работы было исследование экспрессии has-mir-29b-3р, has-mir-34a-5p, has-mir-141-3p* и miR-376с-3p в плазме крови у беременных с ПЭ.
Материал и методы исследования
В исследование были включены 36 женщин, обследованных и родоразрешенных в ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. В зависимости от диагноза и разработанных критериев включения пациентки были разделены на две группы (случай-контроль). В I (основную) группу были включены 18 беременных с ПЭ, во II (контрольную) – 18 беременных без ПЭ.
Критерии включения: в I группу – наличие ПЭ, установленной по данным клинического обследования, результатам функциональных методов исследования; во II группу – отсутствие ПЭ по данным клинического обследования, результатам функциональных методов исследования.
Критерии исключения: тяжелая экстрагенитальная патология, многоплодная беременность, пороки развития плода.
Всем беременным, включенным в исследование, был выполнен стандартный набор обследований и произведен забор крови для реализации задач, поставленных в исследовании. Все беременные были ознакомлены с целью и методами исследования, дали письменное согласие на их участие в научном исследовании.
Возраст беременных, включенных в исследование, колебался от 19 до 46 лет и составил в среднем 30,6±7,8 и 28,9±4,5 года соответственно по группам. На основании изучения соматических и гинекологических заболеваний, были выявлены различия в частоте перенесенных инфекционных заболеваний в детстве: в I группе чаще встречались ОРВИ (38,9%, OR=5,1 (0,8–29,2)) и ангина (38,9%, OR=2,2 (0,5–9,6)), в то время как во II группе преобладали коклюш (16,7%) и пневмония (38,9%, OR=1,2 (0,3–1,2)). В структуре заболеваний ЛОР-органов у пациенток основной группы имел место хронический гайморит (16,7%, OR=1,6, (0,2–10,9)), у пациенток II группы – хронический тонзиллит (33,3%, OR=0,2, (0,4–1,6)). Среди заболеваний дыхательной системы у пациенток основной группы встречались в 22,2% хронический бронхит (11,1%) и бронхиальная астма (11,1%).
Заболевания мочевыделительной системы чаще встречались у пациенток контрольной группы, с преобладанием хронического пиелонефрита (50%, OR=1,6, (1,2–10,9)). При анализе заболеваний сердечно-сосудистой системы было выявлено достоверное увеличение частоты хронической артериальной гипертензии в основной группе (11,1%). При этом среднее артериальное давление в I и II группах составило 113±10,0/73±9,6 и 106±10,9/87±7,7 мм рт. ст. соответственно. При изучении структуры заболеваний эндокринной системы достоверных отличий получено не было.
Следует отметить более частое развитие осложнений течения беременности в основной группе в сравнении с контрольной.
Все пациентки были родоразрешены в доношенном сроке. В основной группе средний срок составил 38,9±0,8 недели беременности, в контрольной группе – 39,1±1 недели. При этом частота оперативного родоразрешения в основной группе была значительно выше, чем в контрольной – 77,8% (n=14) и 33,3% (n=6), OR=7 (2–31) соответственно.
Среди рожденных детей обращает на себя внимание более высокая оценка по шкале Апгар и больший вес при рождении во II группе.
Образцы периферической крови собирали в пробирки с ЭДТА и немедленно центрифугировали при 1600g в течение 10 минут. Надосадок отбирали и повторно откручивали при 13000g в течение 10 минут. Плазму расфасовывали по пробиркам по 500 мкл и помещали на хранение при -80° C. Суммарную РНК выделяли из 100 мкл плазмы с использованием набора реагентов miRNeasy Mini Kit (Qiagen GmbH, Hilden, Germany) в соответствии с инструкцией к нему. Реакцию обратной транскрипции проводили, используя коммерческие микроРНК-специфические праймеры и набор реактивов TaqMan microRNA Reverse Transcription Kit (Life Technologies, Grand Island, NY). Измерение уровня экспрессии микроРНК проводили методом количественной полимеразной цепной реакции в реальном времени с использованием коммерческих праймеров TaqMan miRNA Assay (Life Technologies, Grand Island, NY), набора реагентов TaqMan Universal PCR Master Mix (Life Technologies, Grand Island, NY) и детектирующего амплификатора ДТ-96 (компания ДНК-Технология, Россия). Количественное измерение микроРНК проводили в условных единицах путем оценки ∆Сt и нормализации по отношению к объему плазмы крови. В табл. 1 приведено описание микроРНК, исследовавшихся в данной работе.
Статистическую обработку результатов исследования экспрессии микроРНК проводили методом непараметрического анализа с использованием программы Statistica 10, IBM SPSS Statistics v22. Для сопоставления двух групп по количественным признакам применяли U-критерий Манна–Уитни. Различие между группами полагали статистически значимыми при р<0,05. Для выявления точки отсечки положительных результатов диагностического теста и определения его диагностической точности использовались бинарная логистическая регрессия и ROC-кривая.
Результаты исследования
Все пациентки, включенные в исследование, были сопоставимы по исходной клинико-анамнестической характеристике для снижения возможного влияния особенностей соматического или гинекологического статуса на профиль выделяемых микроРНК. Более высокая частота осложнений беременности в основной группе не имела статистической значимости в связи с небольшой выборкой. Вместе с тем, отсутствие вышеуказанных достоверных различий также нивелировало влияние других осложнений беременности на уровень изучаемых микроРНК, что позволяет говорить о взаимосвязи изменения уровней экспрессии с развитием ПЭ.
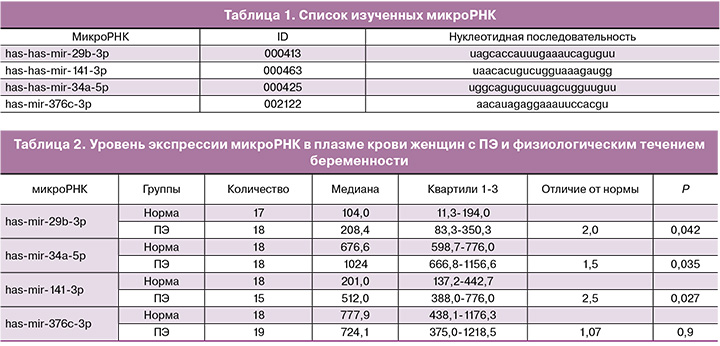
Было изучено содержание микроРНК в плазме периферической крови у беременных в норме и при ПЭ (табл. 2). Экспрессия трех микроРНК: has-mir-29b-3р, has-mir-34a-5p и has-mir-141-3p была значительно повышена в плазме крови беременных с ПЭ по сравнению с контрольной группой. В то же время не было выявлено различий в экспрессии miR-376с-3p, но отмечалась высокая степень разброса по уровню экспрессии в исследуемых группах.
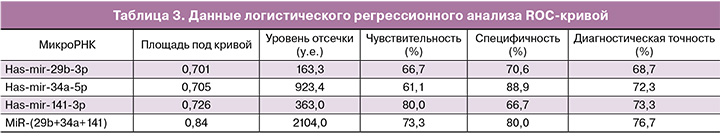
Был проведен ROC-анализ и логистический регрессионный анализ результатов экспрессии микроРНК в плазме крови у исследуемых групп беременных (табл. 3). Анализ показал, что уровень экспрессии has-mir-141-3p выше 363 у.е. позволял диагностировать ПЭ с чувствительностью 80,0%, но с низкой специфичностью 66,6%. Наоборот, уровень экспрессии has-mir-34a-5p выше 923,4 у.е. позволяет диагностировать заболевание с высокой специфичностью (88,9%), но с низкой чувствительностью (61,1%). Максимальная диагностическая точность достигалась только при одновременной оценке уровня экспрессии трех микроРНК: has-mir-29b-3р, has-mir-34a-5p и has-mir-141-3p. Результирующий уровень экспрессии одновременно по трем микроРНК у каждого пациента оценивался по формуле: М=5,9А1+2А2+А3, где А1, А2 и А3 – значения уровня экспрессии has-mir-29b-3р, has-mir-34a-5p и has-mir-141-3p соответственно. ROC-анализ одновременно по трем микроРНК позволил диагностировать ПЭ с чувствительностью 73,3%, специфичностью 80% и диагностической точностью 76,7% при значении результирующего уровня экспрессии (М) более 2104,4 у.е.
Обсуждение
На сегодняшний день имеются убедительные данные, показывающие присутствие в плазме крови беременных внеклеточных плацентарных микроРНК. Показано, что их содержание может меняться при возникновении угрозы прерывания беременности, отслойке плаценты, задержке роста плода, ПЭ [11, 14, 15]. Циркулирующие в крови микроРНК упакованы в микровезикулы и обладают высокой стабильностью к факторам внешней среды, что делает их перспективной моделью в качестве диагностических маркеров для оценки состояния плаценты и характера течения беременности. Настоящая работа посвящена оценке эффективности диагностики ПЭ на основании данных измерения уровня экспрессии микроРНК has-mir-29b-3р, has-mir-34a-5p, has-mir-141-3p* и miR-376с в плазме периферической крови беременных.
Известно, что в клетках трофобласта has-mir-29b-3р индуцирует апоптоз путем прямого взаимодействия с мРНК гена MCL1 (myeloid cell leukemia-1), кодирующего анти-апоптотический белок, входящий в семейство Bcl-2 [16]. Кроме того, данная микроРНК ингибирует в плаценте процессы инвазии путем прямого взаимодействия с ММР2 (матриксная металлопротеиназа 2) и ангиогенеза взаимодействуя с VEGFA (сосудистый эндотелиальный фактор роста 1) и INGB1 (интегрин β1). Повышенный уровень свободной внеклеточной has-mir-29b-3р в плазме крови ассоциируется с различными осложнениями беременности, в том числе и с ПЭ [17]. Полученные в настоящей работе данные также показали повышенный уровень экспрессии has-mir-29b-3р в плазме крови беременных с ПЭ.
Повышенная экспрессия has-mir-34a-5p в плацентарных клетках ингибирует процессы пролиферации, инвазии и миграции путем прямого ингибирования трансляционной функции мРНК гена MYC, продуктом которого является многофункциональный фосфопротеин – транскрипционный регулятор комплекса генов, обеспечивающих пролиферативные и апоптотические процессы в клетке [18]. При ПЭ в плаценте уровень экспрессии has-mir-34a-5p повышен в 3–5 раз, однако данных о содержании ее в плазме крови на сегодняшний день отсутствуют [18, 19]. Исследования, проведенные в настоящей работе, показали повышенную по сравнению с нормой экспрессию has-mir-34a-5p в плазме крови беременных с ПЭ (р=0,035). Более того, из четырех изученных в работе микроРНК только для has-mir-34a-5p были получены значимые показатели логистической регрессии, а именно, что при уровне экспрессии выше 891,4 у.е. чувствительность диагностики составила 83%, специфичность – 61% и диагностическая точность – 72,2%.
Несмотря на то что has-mir-141-3p является одной из наиболее высоко экспрессирующихся в плаценте микроРНК, о ее роли при осложнениях беременности известно недостаточно. Показано, что при ПЭ значительно увеличивается содержание в плазме крови внеклеточной has-mir-141-3p [15]. Полученные в настоящей работе данные также показали более высокую экспрессию has-mir-141-3p в плазме крови беременных с ПЭ, по сравнению с контрольной группой.
MiR-376с играет важную роль в обеспечении пролиферации клеток трофобласта, миграции и инвазии. Было показано, что при ПЭ значительно снижается уровень экспрессии miR-376с как в плаценте, так и в плазме периферической крови [10]. Однако в настоящей работе не было выявлено различий в содержании этой микроРНК в плазме крови у женщин с физиологическим течением беременности и ПЭ.
Заключение
Таким образом, проведенное исследование показало, что экспрессия трех из четырех микроРНК значительно повышена в плазме крови беременных с ПЭ по сравнению с контрольной группой. Количественная оценка экспрессии только has-mir-34a-5p или суммированный показатель экспрессии по трем микроРНК – has-mir-29b-3р, has-mir-34a-5p и has-mir-141-3p в плазме крови в сроках после 30 недель позволяют с высокой диагностической точностью (72–76,7%) дифференцировать беременных с ПЭ и обосновывают перспективность их применения в акушерстве.



