Первичный гиперпаратиреоз и беременность
Первичный гиперпаратиреоз (ГПТ) считается третьим по распространенности эндокринным заболеванием с частотой 1–2% в общей популяции. Наиболее частой причиной первичного ГПТ является аденома околощитовидных желез (80–85%), гиперплазия и множественные аденомы встречаются в 10–20% случаев [1]. На долю рака околощитовидных желез приходится от 1 до 5% случаев первичного ГПТ [1]. ГПТ беременных – редкое состояние, его истинная распространенность остается неизвестной. Незначительное повышение паратгормона (ПТГ) и кальция могут оставаться незамеченными на протяжении всей беременности, и в большинстве случаев выявление заболевания является случайной находкой. При этом осложнения ГПТ во время беременности наблюдаются в 67% случаев у матерей и в 80% у плодов. Без лечения в 20–30% случаев это состояние может привести к гибели плода или новорожденного [2]. Учитывая высокий риск развития осложнений, как у матери, так и у ребенка, разработка методов ранней диагностики и своевременное лечение нарушений фосфорно-кальциевого обмена в данной группе пациентов представляет большое значение.
Особенности метаболизма кальция во время беременности
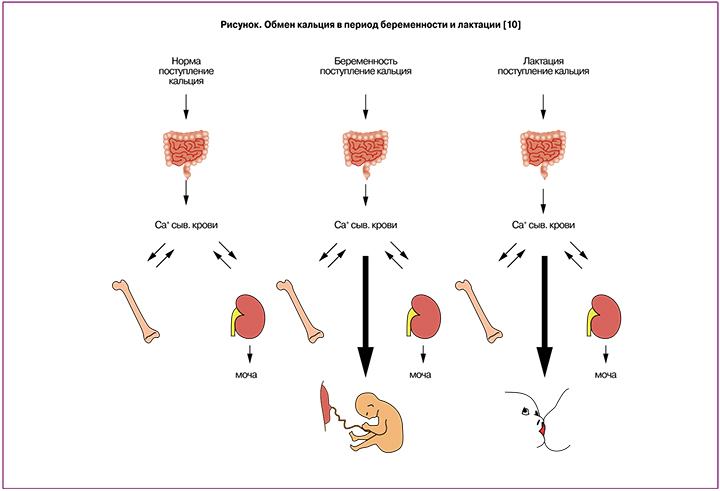
Регуляция фосфорно-кальциевого обмена во время беременности претерпевает значительные изменения, необходимые для развития плода. При нормально протекающей беременности увеличивается общий объем плазмы крови и развивается физиологическая гемодилюция, повышается скорость клубочковой фильтрации, что проявляется гиперкальциурией у матери, отмечается гестационная гипоальбуминурия и, как следствие, снижение уровня общего кальция [3]. При этом показатели ионизированного кальция (физиологически активной фракции) остаются неизменными [4, 5]. Для нормальной минерализации скелета и поддержания физиологических процессов плоду в среднем требуется около 30 г кальция, при этом 80% кальция плод аккумулирует в течение третьего триместра [6]. Кальций проникает через плацентарный барьер по градиенту концентраций 1,0:1,4 [7]. Повышение потребности плода в кальции покрывается за счет включения ряда компенсаторных механизмов (рисунок).
Во время беременности повышается реабсорбция кальция в кишечнике матери, данный процесс сохраняется на протяжении всей беременности, и снижается после родоразрешения. По данным K.O. O’Brien и соавт., абсорбция кальция во время беременности составляет 15,30±5,53 ммоль/сут, а через 3–4 недели после родов у нелактирующих женщин – 8,09±5,18 ммоль/сут [7]. Увеличение абсорбции кальция связывают прежде всего с двукратным увеличением содержания кальцитриола (1,25(OH)2D3) и повышением экспрессии в кишечнике кальбидина – витамин D-зависимого кальций-связывающего протеина [8]. Увеличение концентрации 1,25(OH)2D3 наблюдается на 20-й неделе [9]. Регуляция метаболизма витамина D у беременной женщины в основном зависит от активности 1α-гидроксилазы почек, уровень которой также значимо увеличивается во время беременности [7, 10]. Ряд клинических исследований демонстрирует более низкую концентрацию циркулирующего 1,25-ОН-D у беременных женщин с удаленной или отсутствующей почкой на гемодиализе [7, 11]. Несмотря на то что ПТГ является основным стимулятором почечной 1α-гидроксилазы, во время беременности значимое влияние на ее активность оказывают эстрогены, пролактин и плацентарный лактоген [11]. Плацента также продуцирует 1α-гидроксилазу, и считается, что именно автономная плацентарная секреция 1,25-ОН-D приводит к удвоению материнского 1,25-ОН-D. Также важную роль в регуляции фосфорно-кальциевого обмена и повышении активности 1α-гидроксилазы почек играют ПТГ-подобные пептиды (parathyroid hormone-related protein — PTHrP, ПТГпП) [12].
Концентрация ПТГпП в крови значимо увеличивается во время беременности и достигает максимальных значений к третьему триместру, что подтверждается при кордоцентезе. ПТГпП синтезируются множеством тканей плода и матери: плацента, амнион, децидуальная оболочка, околощитовидные железы плода, молочные железы, пуповина. ПТГпП отвечают за стимулирование 1α-гидроксилазы в почках и, как следствие, увеличение 1,25-ОН-D [13]. При этом подавляется секреция ПТГ, что необходимо для регуляции плацентарного транспорта кальция [14].
Аминотерминальная часть молекулы пептида стимулирует резорбцию костной ткани, усиливает реабсорбцию кальция почками и ускоряет транспорт кальция через плаценту, а карбокситерминальная – подавляет активность остеокластов, предотвращая таким образом избыточную резорбцию костей [13].
Данные в отношении изменения ПТГ во время беременности достаточно противоречивы: от уменьшения его уровня у беременных на 10–30% по сравнению с небеременными до значительного его повышения [15]. Ранее существовала теория физиологического ГПТ во время беременности, основанная на повышении концентрации ПТГ при снижении уровня кальция в сыворотке крови. При этом до 20–21-й недели беременности содержание ПТГ снижается до 1,5±0,5 пмоль/л в первом триместре и до 0,9±0,4 пмоль/л во втором триместре, с последующим повышением до 1,4±0,5 пмоль/л после 20-й недели [16]. Другие авторы указывают, что уровень ПТГ на протяжении трех триместров беременности остается на нижней границе референсных значений либо повышается [17]. Однако его уровень не достигает верхней границы к доношенному сроку беременности [11]. Результаты последних исследований отвергают теорию физиологического ГПТ беременности. Расхождения в значениях ПТГ при беременности могут быть обусловлены несовершенством диагностических методик определения молекулы гормона и выявлением в больших количествах неактивных фрагментов ПТГ (С-концевых фрагментов) в сочетании со снижением уровня общего кальция. Таким образом, динамика биологически активного ПТГ во время беременности характеризуется тенденцией к низко-нормальному диапазону (0–30% значения ПТГ вне беременности) в течение первого триместра, с последующим увеличением до средне-нормального диапазона. Тенденция к повышению уровня ПТГ во время беременности в норме является ответом на недостаточное потребление кальция, что в исследованиях, как правило, наблюдалось у азиатских женщин [9, 18]. В норме уровень ПТГ сыворотки матери физиологически повышается в поздние сроки беременности – в период обызвествления скелета плода [19].
Костное ремоделирование матери характеризуется постепенным усилением резорбтивных процессов к 28-й неделе беременности, на фоне стабильного формирования новой кости. Повышение костной резорбции достигает значимости только к 36-й неделе беременности, что приводит к компенсаторному повышению маркеров формирования новой кости [5, 11]. Таким образом, беременным и кормящим женщинам необходимо потреблять сопоставимое количества кальция для адекватного восполнения его содержания в течение каждого из периодов в зависимости от потребностей плода. Одним из возможных механизмов, препятствующих избыточной резорбции кальция из костей матери, является повышение сывороточного уровня кальцитонина. Основными его источниками во время беременности являются щитовидная железа, молочные железы, децидуальная ткань и плацента [15].
Данные изменения в сочетании с изменениями секреции гормонов, регулирующих обмен кальция и фосфора, затрудняют своевременную постановку диагноза ПГПТ.
Околощитовидные железы плода и гомеостаз кальция
Развитие околощитовидных желез плода происходит в период с 5-й по 12-ю неделю беременности, и с 10–12-й недели гестации они начинают секретировать собственный ПТГ. Уровень самостоятельной продукции ПТГ во внутриутробном периоде не достаточен, но после рождения младенца отмечается его повышение. Молекулы ПТГ и кальцитонина не проходят через плацентарный барьер. Концентрации кальция в крови плода регулируется путем его активного транспорта и обеспечивается, как увеличением концентрации 1,25(ОН)2D3, так и повышением его реабсорбции в кишечнике в организме матери [20]. При кордоцентезе концентрация ионизированного кальция в пуповинной крови плода выше (1,37±0,07 ммоль/л) нормальных значений (1,03-1,29 ммоль/л). Удаление плаценты приводит к падению концентрации ионизированного кальция у новорожденных до 1,00–1,17 ммоль/л в первые 1–2 дня жизни [21]. Активный транспорт кальция через плаценту не зависит от уровня материнского ПТГ, но частично регулируется плацентарной и плодной секрецией ПТГпП. Плазменный уровень ПТГ остается относительно низким в неонатальном периоде и минимально реагирует на гипокальциемию в течение первых 2–3 дней жизни, что приводит к транзиторной неонатальной гипокальциемии. Уровень кальция увеличивается до нормальных значений в течение 5–7 дней [11]. Снижение секреции ПТГ новорожденного при снижении уровня кальция обусловливает большую вероятность развития гипокальциемии. Особенно это характерно для детей, рожденных от матерей с длительной гиперкальциемией, пренатальное развитие околощитовидных желез которых подавляется в течение всей беременности [11, 20]. Таким образом, первичный ГПТ во время беременности представляет серьезную угрозу для здоровья как матери, так и плода. В отсутствии квалифицированного лечения болезнь осложняется нарушением развития плода и внутриутробной гибелью.
Постановка диагноза ПГПТ во время беременности
Гиперкальциемия относится к одним из основных биохимических маркеров ПГПТ. При беременности в результате активного транспорта кальция от матери к плоду и повышения его экскреции с мочой, гипоальбуминемии, уровень общего кальция может снижаться, что значимо затрудняет своевременную постановку диагноза. Таким образом, первичная диагностика ГПТ при беременности должна основываться на оценке кальциемии с определением ионизированной формы, являющейся наиболее информативным показателем [22].
Диагноз первичной ГПТ должен быть заподозрен при выявлении повышения альбумин-скорректированного или ионизированного кальция, при гипофосфатемии в сочетании с увеличением уровня ПТГ. Кроме того, обследование на предмет ГПТ должно проводиться в случае любых метаболических нарушений костной системы, при нетравматических переломах, при рецидивирующей мочекаменной болезни, при стойком панкреатите и рецидивирующих язвах желудка или двенадцатиперстной кишки, при нарушении ритма сердца и выявлении другой кардиальной патологии, при инсипидарном синдроме [23]
Основным методом топической диагностики при беременности в данной ситуации является ультразвуковое исследование (УЗИ) шеи, которое обладает 68% чувствительностью и 94% специфичностью [24]. Компьютерная томография, сцинтиграфия околощитовидных желез, магнитно-резонансная томография обычно не используются из-за потенциального риска для плода [25, 26].
Наследственные синдромы, такие как синдром множественных эндокринных неоплазий 1-го и 2-го типа (МЭН 1, МЭН 2), семейный изолированный гиперпаратиреоидизм, гиперпаратиреоидизм – челюстной синдром, доброкачественная семейная гипокальциурическая гиперкальциемия должны исключаться в случае молодого возраста пациенток в сочетании с отягощенной наследственностью и подозрением на наличие других компонентов синдромов [27, 28].
Клинические проявления и осложнения со стороны матери и плода
Согласно данным литературы примерно в 23% случаев первичный ГПТ при беременности может протекать асимптомно [29]. При этом единственным проявлением заболевания остается гиперкальциемия, выявление которой, к сожалению, не всегда приводит к выяснению ее причины, определению уровня ПТГ и поиску образований околощитовидных желез.
Развитие клинических проявлений коррелирует со степенью выраженности гиперкальциемии и характеризуется как костными, так и висцеральными нарушениями. Затруднения в своевременной диагностике первичного ГПТ во время беременности обусловлены неспецифичностью большинства начальных симптомов заболевания. Возникновение общей и мышечной слабости, повышенной утомляемости, жажды, полиурии, никтурии, диспепсии часто расценивается как естественное течение беременности [11].
Нефролитиаз считается одним из наиболее частых проявлений первичного ГПТ во время беременности и встречается в 26–36% наблюдений [30, 31].
К другим нарушениям относятся депрессия, запоры, низкотравматичные переломы, нарушения ритма сердца у матери, панкреатит, гиперкальциемический криз или неукротимая рвота беременных [32, 33]. В ряде случаев отсутствие своевременной диагностики и лечения заболевания приводит к развитию острой почечной и сердечно-сосудистой недостаточности. Поражение центральной нервной системы возникает только при крайне выраженной гиперкальциемии и проявляется психозами, изменением сознания от сумеречного до комы [29].
Согласно данным литературы артериальная гипертензия и преэклампсия наблюдается у 25% беременных женщин с манифестной формой первичного ГПТ [34]. В ряде работ продемонстрированы достоверные корреляции между аденомой околощитовидных желез и последующим развитием преэклампсии, даже в случае хирургического удаления аденомы за 5 лет до беременности. Предположительно в основе данной взаимосвязи лежит эндотелиальная дисфункция и инсулинорезистентность, характерные как для первичного ГПТ, так и преэклампсии [34, 35].
Гиперкальциемический криз – наиболее опасное осложнение первичного ГПТ, который чаще развивается в раннем послеродовом периоде после прекращения оттока материнского кальция через плаценту к плоду. В этих случаях уровень кальция обычно превышает 3,5 ммоль/л, сопровождается тошнотой, рвотой, крайне выраженной слабостью и психическими расстройствами [36]. По данным литературы гиперкальциемический криз ассоциирован в 25% наблюдений с перинатальной смертностью и в 50% – неонатальной тетанией. В ряде случаев развивается уремия, приводящая к летальному исходу [37].
Осложнения со стороны плода отмечаются в 80% случаев первичного ГПТ у беременных, не получивших своевременное патогенетическое лечение [38]. Наиболее частым и серьезным осложнением материнской гиперкальциемии является гипокальциемия новорожденных, проявляющаяся как тетанией, так и мертворождением. Кроме того, не исключено прямое токсическое воздействие гиперкальциемии на плод, что повышает риск остановки развития беременности и самопроизвольных ее прерываний. M.M. Shangold и соавт. проанализировали 63 случая первичного ГПТ, развившегося во время беременности. Согласно полученным данным перинатальные осложнения отмечались в 46% наблюдений, неонатальные осложнения – в 45%. Тетания являлась основной причиной смертности. Перинатальная смертность зафикcирована в 25% случаев [35].
Неонатальная гипокальциемия наблюдается более чем в 50% случаев первичного ГПТ во время беременности [36, 39]. Неонатальное снижение уровня кальция и тетания развиваются вследствие внутриутробного подавления функционирования околощитовидных желез плода на фоне гиперкальциемии и ГПТ матери [40]. Сразу же после рождения ребенка необходимо перевести в отделении интенсивной терапии, определить уровень кальция. Купирование гипокальциемии и вызванной ею тетании, а также «синдрома голодных костей» у детей проводится препаратами кальция и витамина D. Неонатальная гипокальциемия, как правило, является транзиторной и сохраняется в течение первых 3–5 месяцев жизни ребенка [36, 38, 41].
К другим фетальным осложнениям относятся преждевременные роды (13%), внутриутробная задержка роста плода, неонатальная тетания (25%), мертворождение и редко – стойкий гипопаратиреоз [42].
Проводилось ретроспективное исследование 77 пациенток с развитием первичного ГПТ во время беременности. Согласно результатам работы, первичный ГПТ во время беременности ассоциирован с 3–5-кратным повышением риска выкидыша, который, как правило, наблюдался в конце первого и начале второго триместра. Потеря плода чаще наблюдалась при повышении кальция в сыворотке матери более чем 2,85 ммоль/л, хотя выкидыши происходили и при его меньших значениях. Риск потери плода прямо коррелирует с увеличением материнской сывороточного уровня кальция R=0,972 [22].
Лечение первичного ГПТ во время беременности
Хирургическое лечение
Хирургическое лечение является единственным эффективным методом при повышении уровня кальция более 2,75 ммоль/л [25]. A. Kristofferson и соавт. продемонстрировали больший риск осложнений при родах (53 против 12,5%) и осложнений у детей в неонатальном периоде (24 против 2,5%) среди женщин, отказавшихся от операции (n=70), по сравнению с пациентками, перенесшими паратиреоидэктомию (n=39) [42]. По данным крупного мета-анализа T.R. Kelly и соавт., консервативная терапия ГПТ во время беременности приводила к увеличению частоты неонатальных осложнений (53%) по сравнению с хирургическим удалением аденомы околощитовидных желез (только 12,5%). Кроме того, паратиреоидэктомия эффективно устраняет стойкую гиперкальциемию матери и, как следствие, уменьшает риски развития осложнений у плода [41].
Оптимальным считается выполнение паратиреоидэктомии во втором триместре беременности, когда завершен органогенез и риск преждевременных родов по сравнению с третьим триместром значимо ниже [29]. Однако некоторые авторы указывают на возможность успешного хирургического удаления образования околощитовидных желез независимо от гестационного периода при наличии показаний [26, 29]. Тем не менее, при выявлении первичного ГПТ в третьем триместре беременности вопрос о целесообразности хирургического лечения остается спорным и должен решаться в индивидуальном порядке. В случае если операция может быть отсрочена (умеренно выраженная гиперкальциемия), хирургическое удаление образования околощитовидных желез должно быть выполнено как можно раньше после родоразрешения с целью предупреждения гиперкальциемического криза. В ряде случаев требуется одновременное выполнение кесарева сечения и паратиреоидэктомии, что снижает риски как для плода, так и для матери [43, 44].
Эффективность паратиреоидэктомии в профильном учреждении достигает 95%, при этом риск послеоперационных осложнений составляет всего 1–3% (парез возвратного нерва, гипокальцемия). Интраоперационное определение ПТГ необходимо для оценки радикальности операции [45].
Как и в общей популяции, наилучшими для минимально инвазивных вмешательств являются случаи с предоперационной визуализацией аденомы, особенно, при ее типичном расположении [25, 46]. Учитывая невозможность использования сканирования области околощитовидных желез с Тс-99m во время беременности, в случае отсутствия топических данных УЗИ на этапе предоперационной подготовки предпринимается открытая ревизия всей паратиреоидной области. Эти вмешательства рекомендуется осуществлять только во втором триместре и только у пациенток со значительным повышением ПТГ (более чем в два раза), при гиперкальциемии превышающей 3 ммоль/л [43, 47]. В 15% описанных случаев наблюдалась эктопия аденом околощитовидных желез, что осложняет поиск на дооперационном этапе, однако известно несколько клинических случаев удаления аденомы, располагавшейся в средостении, с применением стернотомии и торакоскопии [29].
Консервативное ведение
В случае мягких форм первичного ГПТ с умеренным повышением уровня кальция допускается консервативное ведение пациенток с применением интенсивной регидратации и ограничением потребления кальция и, при необходимости, добавлением петлевых диуретиков для форсированного диуреза [2, 10, 35]. При недостаточности витамина D рекомендуется назначение нативных препаратов витамина D, что препятствует дальнейшему вторичному повышению уровня ПТГ и необходимо для профилактики развития неонатальной гипокальциемии в раннем послеродовом периоде и синдрома «голодных» костей у матери [48, 49]. Однако быстрое насыщение препаратами витамина D может привести к гиперкальциемическому кризу, поэтому рекомендуется использование небольших доз и частый контроль показателей фосфорно-кальциевого обмена [50].
Медикаментозная терапия
Фармакотерапия первичного ГПТ при беременности лимитирована вследствие потенциального вреда для развития плода.
Кальцитонин относится к препаратам категории C. Его применение при беременности возможно только в случае если ожидаемый эффект терапии превышает потенциальный риск для плода (контролируемых исследований безопасности применения у беременных женщин не проведено). Данный гормон синтезируется парафолликулярными клетками, его гипокальциемический эффект реализуется за счет прямого ингибирования остеокластов. Кальцитонин не проникает через плацентарный барьер, что считается его преимуществом. Однако низкая эффективность и риск развития тахифилаксии ограничивает его применение во время беременности [10].
Бисфосфонаты относятся к классу препаратов категории С. Вне беременности данные препараты могут использоваться при выявлении жизнеугрожающей гиперкальциемии, однако их использование при беременности резко лимитировано, так как они проникают через плацентарный барьер. В настоящее время отсутствуют контролируемые рандомизированные клинические исследования безопасности применения алендроновой кислоты при беременности и в период лактации. В исследовании на животных, использование высоких доз бисфосфонатов (в 8 раз превышающих среднетерапевтические) у беременных крыс характеризовалось тератогенным эффектом: появление костных мальформаций и нарушение эндохондриального развития костей плода [51]. В литературе представлены единичные случаи использования бисфосфонатов при беременности, не сопровождавшиеся развитием тератогенных эффектов; тем не менее, их назначение не рекомендуется [51].
Аллостерический модулятор кальций-чувствительных рецепторов околощитовидных желез – цинакальцет – относительно новый препарат в лечении ГПТ. Его эффект реализуется через кальций-чувствительные рецепторы вследствие повышения их чувствительность к уровню внеклеточного кальция, что сопровождается снижением концентрации ПТГ и кальция [52]. Исследования на беременных крысах и кроликах показали, что цинакальцет проникает через плаценту, при этом эмбриотоксического воздействия не выявлялось. Беременные крысы ежедневно получали препарат в дозе 50 мг/кг (эквивалентно 720 мг у человека), что приводило к умеренному снижению массы тела плода и матери [53]. При назначении 25 мг/кг в сутки беременным кроликам (эквивалентно 180 мг у человека), значимых побочных эффектов на развитие плода не фиксировалось. Также, как и в исследовании на крысах, наблюдалось умеренное снижение аппетита и массы тела у матери [54].
На сегодняшний день отсутствуют достоверные данные о влиянии препарата на обмен кальция плода. Кальций-чувствительные рецепторы присутствуют в плаценте, следовательно, применение цинакальцета может нарушить трансплацентарный транспорт кальция и вызвать подавление секреции ПТГ плода и, как следствие, последующую неонатальную гипокальциемию. С другой стороны, отрицательное влияние кальцимиметиков на активность околощитовидных желез плода, находящихся в супрессивном состоянии на фоне первичного ГПТ у матери, не представляется значимым [11, 54].
C. Horjus и соавт. описали клинический случай безопасного применения цинакальцета у беременной женщины без развития осложнений, как со стороны плода, так и матери. Лечение данным препаратом было инициировано на 32-й неделе беременности при выявлении жизнеугрожающей гиперкальциемии матери более 3,96 ммоль/л. Монотерапия цинакальцетом не обеспечила достижение нормокальциемии, поэтому к терапии был присоединен кальцитонин. Данное комбинированное лечение позволило сохранить нормальный уровень кальция в течение оставшегося срока беременности [54]. K. Nadarasa и соавт. представили уникальный клинический случай монотерапии цинакальцетом беременной пациентки с раком околощитовидных желез. Пациентка получала данный препарат в дозе 120 мг в сутки с 1-го по 3-й триместр беременности, когда было выполнено кесарево сечение. В послеоперационном периоде у ребенка отмечалось развитие транзиторной гипокальциемии, сохранявшейся в течение месяца, других значимых осложнений не определялось [55]. Несмотря на то что в обоих случаях использование цинакальцета было успешным, требуются дальнейшие исследования его применения во время беременности.
Заключение
Развитие первичного ГПТ во время беременности наблюдается достаточно редко. Незначительное повышение ПТГ и кальция могут длительно оставаться незамеченными, так как симптомы данного заболевания при беременности остаются неспецифичными. Тем не менее, первичный ГПТ ассоциирован с высоким риском развития осложнений матери, ребенка, а также высокой смертностью. Ранняя диагностика и выбор оптимальной тактики являются приоритетными в данной группе пациентов. Хирургическое лечение является единственным эффективным и предпочтительным методом лечения в случае тяжелых форм заболевания. Однако в случае мягких форм первичного ГПТ допускается консервативное ведение под тщательным контролем показателей фосфорно-кальциевого обмена.



