В норме у здоровой женщины во время беременности последовательно развивается ряд существенных изменений в системе гемостаза, обусловленных меняющимся гормональным фоном [1, 2]. Понимание механизмов данных изменений позволяет избежать гипердиагностики патологических процессов и необоснованного назначения медикаментов, а знание допустимых референсных диапазонов для ключевых гемостазиологических лабораторных показателей обеспечивает максимальное разграничение нормы и патологии [3].
 Понятие «норма» имеет различные значения. В контексте лабораторных измерений «нормальный» может означать «среднее в популяции», «вне болезни» или «попадающий в статистический диапазон». Тем не менее, очень важно знать характеристики конкретной популяции, прежде чем сравнивать отдельные результаты теста с соответствующим референсным диапазоном [3, 4]. Так, использование в качестве референсных диапазонов в случае обследования беременных женщин или новорожденных значения для взрослой популяции, мужчин среднего возраста или небеременных женщин некорректно [2]. Важно понять, как физиологические изменения, происходящие в организме женщины во время беременности, влияют на результаты различных тестов до принятия решения клиницистами, является ли конкретное значение патологическим, требуется ли дальнейшее обследование или лечение. Гормональная перестройка во время беременности влечет за собой значительные изменения в метаболизме [2,5]. В результате в течение беременности лабораторные показатели могут значительно отличаться от таковых у небеременных женщин.
Понятие «норма» имеет различные значения. В контексте лабораторных измерений «нормальный» может означать «среднее в популяции», «вне болезни» или «попадающий в статистический диапазон». Тем не менее, очень важно знать характеристики конкретной популяции, прежде чем сравнивать отдельные результаты теста с соответствующим референсным диапазоном [3, 4]. Так, использование в качестве референсных диапазонов в случае обследования беременных женщин или новорожденных значения для взрослой популяции, мужчин среднего возраста или небеременных женщин некорректно [2]. Важно понять, как физиологические изменения, происходящие в организме женщины во время беременности, влияют на результаты различных тестов до принятия решения клиницистами, является ли конкретное значение патологическим, требуется ли дальнейшее обследование или лечение. Гормональная перестройка во время беременности влечет за собой значительные изменения в метаболизме [2,5]. В результате в течение беременности лабораторные показатели могут значительно отличаться от таковых у небеременных женщин.
 Беременность влияет на регуляцию свертывания крови преимущественно за счет повышения уровня эстрогенов, что приводит к увеличению выработки тромбина и повышению свертывающей способности крови. Это изменение можно рассматривать как подготовку к ожидаемой кровопотере в родах [2]. Было показано, что беременность ассоциирована с повышением ряда факторов свертывания крови, таких как фибриноген, VII, VIII, X, XII, фактор Виллебранда (ФВ), а также со снижением активности протеина S – одного из физиологических антикоагулянтов [6, 7]. Известно, что при беременности в норме повышается количество циркулирующих продуктов деградации фибрина [8, 9], поэтому уровень D-димера у беременных не отражает наличие тромботических осложнений.
Беременность влияет на регуляцию свертывания крови преимущественно за счет повышения уровня эстрогенов, что приводит к увеличению выработки тромбина и повышению свертывающей способности крови. Это изменение можно рассматривать как подготовку к ожидаемой кровопотере в родах [2]. Было показано, что беременность ассоциирована с повышением ряда факторов свертывания крови, таких как фибриноген, VII, VIII, X, XII, фактор Виллебранда (ФВ), а также со снижением активности протеина S – одного из физиологических антикоагулянтов [6, 7]. Известно, что при беременности в норме повышается количество циркулирующих продуктов деградации фибрина [8, 9], поэтому уровень D-димера у беременных не отражает наличие тромботических осложнений.
В литературе приводятся референсные интервалы для гемостазиологических исследований у беременных [7, 8, 10–14], но не во всех исследованиях соблюдаются рекомендации Международной ассоциации клинической химии (IFSS) и Института клинических лабораторных стандартов (CLSI) [15–19]. Кроме того, существенное значение имеет исследуемая популяция, тип лабораторного оборудования и используемые методы [16, 20, 21]. Таким образом, как правило, каждая лаборатория должна использовать собственные валидированные (выверенные) референсные интервалы в зависимости от срока беременности для конкретной популяции, конкретных методов и лабораторного оборудования, прежде чем они начнут использоваться клиницистами.
Материал и методы исследования
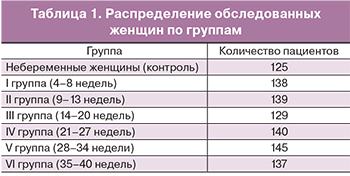
В исследование были включены 828 женщин в возрасте 21–39 лет с одноплодной неосложненной беременностью. Пациентки были распределены на 6 подгрупп в зависимости от гестационного срока (4–8, 9–13, 14–20, 21–27, 28–34 и 35–40 недель). Критериями исключения были нарушения гемостаза (патологические кровотечения, тромботические состояния) в анамнезе и в течение данной беременности, протеинурия, артериальная гипертензия, преэклампсия. В контрольную группу вошли 125 небеременных женщин в возрасте 19–39 лет.
Взятие крови осуществляли утром, натощак из периферической вены в закрытые вакуумные системы S-Monovette фирмы Sarstedt (Германия) с антикоагулянтом цитратом натрия (3,2%) в соотношении 1:9. При этом первую порцию крови никогда не использовали для исследований гемостаза, так как содержащаяся в ней тканевая тромбокиназа могла повлиять на получаемые результаты. Во избежание свертывания сразу после взятия кровь тщательно перемешивали. Для проведения исследований получали цитратную плазму, бедную тромбоцитами, путем центрифугирования в течение 15 мин при 3000 об./мин при комнатной температуре (20–25 ˚С). Все коагуляционные исследования выполнялись в течение 2 часов после взятия крови.
Исследования проводились на автоматическом анализаторе STA-Compact (Diagnostica Stago, Франция) клоттинговыми, хромогенными и иммунотурбидиметрическими методами. Были исследованы следующие параметры гемостаза: протромбиновое время (ПВ), активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), активность антитромбина III (АТ III), протеина С, концентрация фибриногена, D-димера, ФВ.
Статистическую обработку данных проводили с использованием пакета статистических программ MedCalc 14.8.1. Проверка вариационных рядов на нормальность проводилась с помощью теста Шапиро–Уилкоксона. Референсные интервалы (2,5 и 97,5 персентили с 90% доверительным интервалом) рассчитывались согласно требованиям CLSI C23-A2 [15, 19]. Сравнение рядов выполнялось с использованием непараметрических методов (U-тест Манна–Уитни). Критерием статистической достоверности считали р<0,05.
Результаты
Референсные интервалы в зависимости от срока беременности были рассчитаны на основании анализа данных, полученных в 6 группах беременных женщин (табл. 1).
Полученные референсные интервалы в группе здоровых небеременных женщин активного репродуктивного возраста представлены в табл. 2.
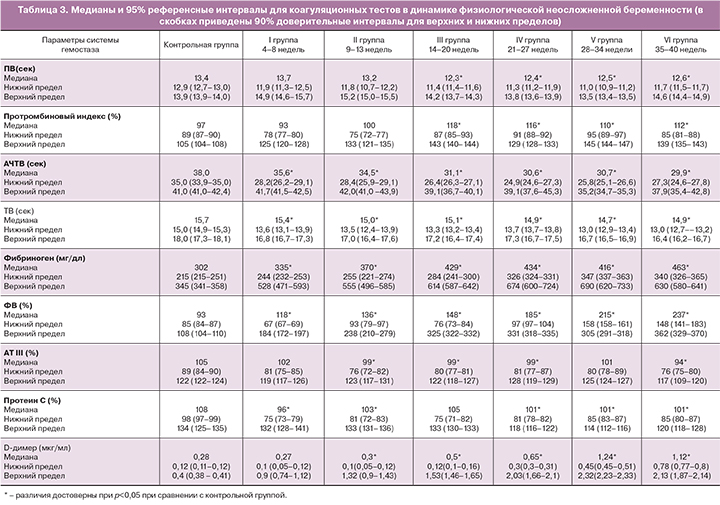
Медианы, референсные интервалы и доверительные интервалы для верхних и нижних пределов для коагуляционных показателей в группах беременных женщин в сроках 4–8, 9–13, 14–20, 21–27, 28–34, 35–40 недель представлены в табл. 3.
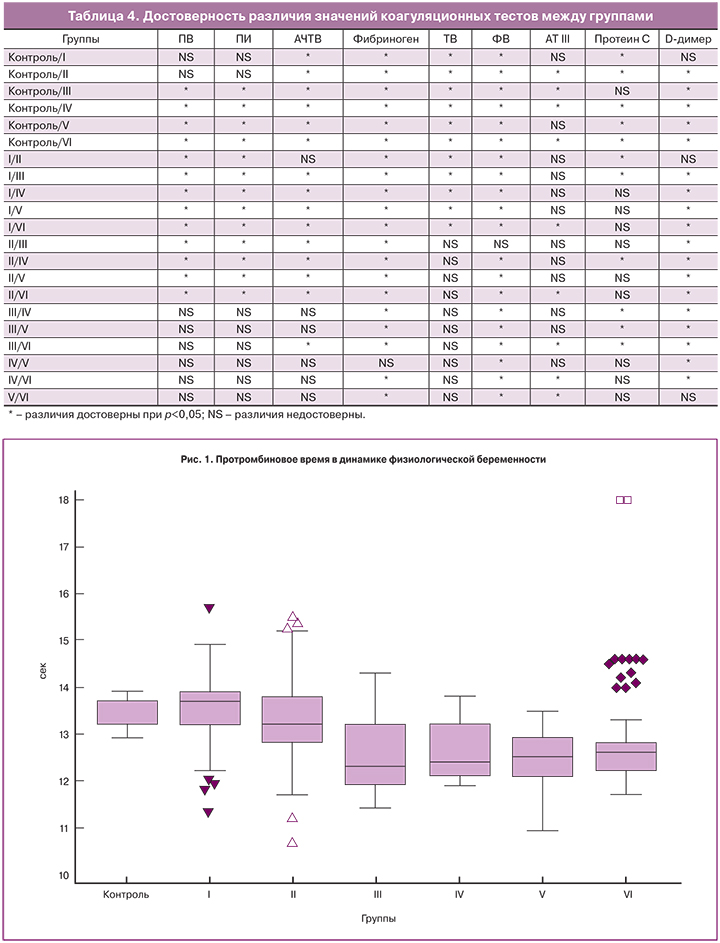
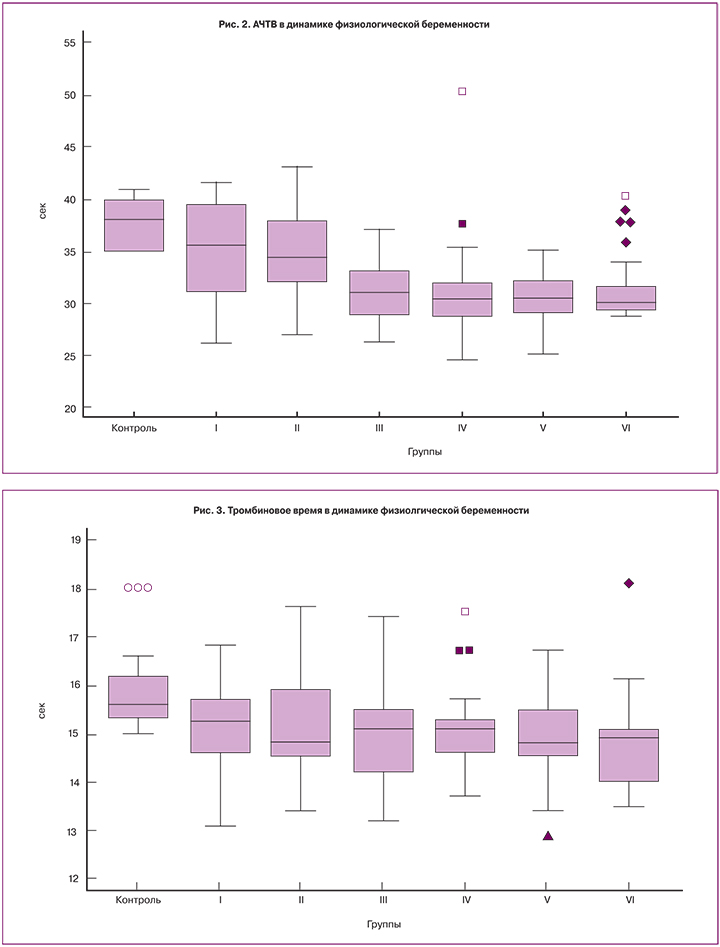
Изменения исследуемых гемостазиологических показателей в динамике физиологической беременности показаны на рис. 1–8, а достоверность различий между группами – в табл. 4.
При сравнении с контрольной группой, медианы исследуемых показателей значимо отличались во всех группах беременных женщин (табл. 4).
При сравнении исследуемых групп в сроке более 13 недель беременности медианы ПВ, АЧТВ и ТВ были достоверно короче, чем в более ранние сроки (рис. 1–3). Значения медиан для фибриногена, ФВ и D-димера достоверно возрастали с увеличением гестационного срока и достигали максимальных значений в третьем триместре (рис. 4–6), превышая к концу беременности исходный уровень (до беременности) в 1,6, 2,5 и 4,2 раза соответственно.
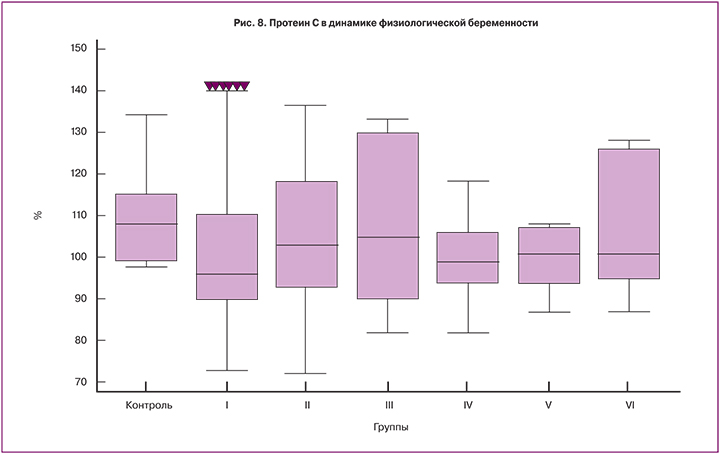
При оценке уровня АТ III были отмечены значимо более низкие значения медианы на 35–40-й неделе беременности (рис. 7). Значения медиан уровня протеина С были на сроке 14–20 недель достоверно выше, чем в других группах беременных (рис. 8).

Обсуждение
Лабораторные тесты играют значимую роль в диагностике различных типов нарушений в системе гемостаза.
Врачи-клиницисты оценивают результаты гемостазиограммы, опираясь на соответствующие референсные интервалы. Таким образом, предоставление лабораториями корректных референсных интервалов является неотъемлемой частью диагностического процесса. При этом их получение сопряжено с определенными трудностями, поскольку достаточно трудно сформировать группу полностью здоровых индивидуумов, в данном случае беременных женщин. В различных исследованиях было показано, что опорные значения, полученные на базе конкретного госпиталя, идеально подходят для интерпретации, поскольку они основываются на сходных популяционных условиях [3, 19, 20, 22]. В нашей работе при получении выборки пациентов мы сделали все возможное, чтобы обеспечить необходимое количество пациенток для каждого гестационного срока. В результате было получено 828 образцов крови у пациенток, госпитализированных в наш Центр или наблюдающихся амбулаторно. Мы установили специфические референсные интервалы для 8 показателей гемостаза (ПВ, АЧТВ, ТВ, фибриногена, ФВ, D-димера, АТ III, протеина С). Надежность полученных данных определяется достаточным размером выборки.
Медианы всех показателей в динамике беременности достоверно отличались от таковых у небеременных женщин (табл. 4).
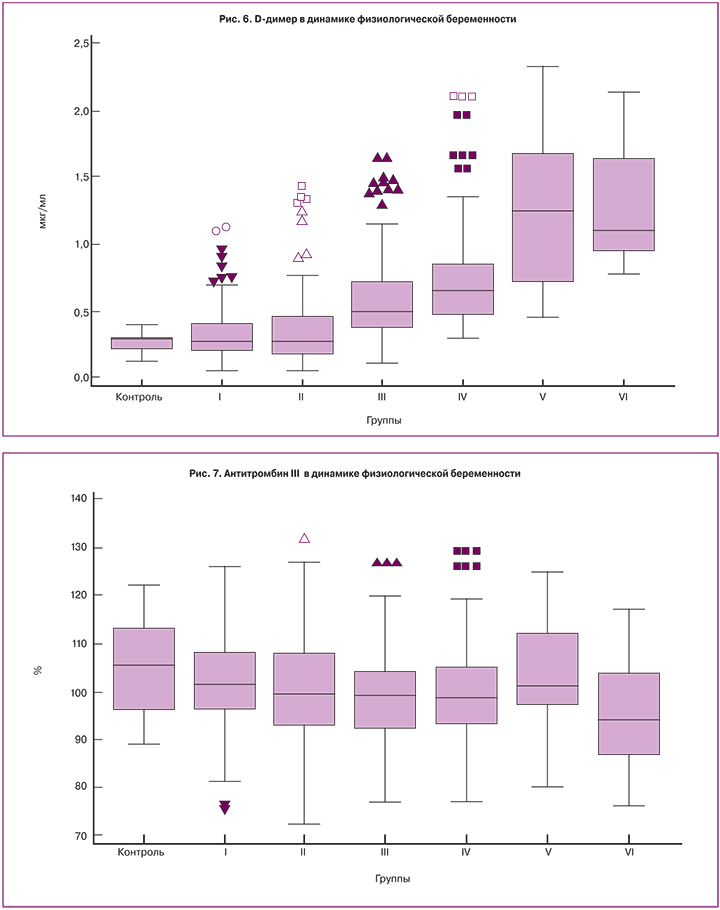
Нормальная беременность как гиперкоагуляционное состояние ассоциируется с повышением уровня различных факторов свертывания, в том числе ФВ и фибриногена, с увеличением синтеза и активности тромбина [2]. В данном исследовании уровень фибриногена значимо возрастал к 20-й неделе спонтанной беременности, оставался относительно постоянным в сроке 21–34 недели и увеличивался к последним неделям. Прирост уровня ФВ по сравнению с исходным к концу первого триместра составлял до 46%, а к родам – до 150%.
ПВ, ТВ и АЧТВ имели тенденцию к укорочению с возрастанием гестационного срока. ПВ и АЧТВ достигали минимальных значений в 21–27 недель беременности, в то время как тромбиновое время достигало своего минимума в 28–34 недели.
Значения медиан АТ III и протеина С были ниже, чем у небеременных женщин и стабильными на протяжении всей беременности. Отмечались более низкие значения АТ III перед родами и более высокие значения протеина С в сроке 14–20 недель.
Концентрация D-димера непрерывно возрастала на протяжении всей беременности. По данным различных авторов, во втором триместре до 70% здоровых беременных женщин имеют значения D-димера, превосходящие 0,5 мкг/мл, а в третьем – до 95% [23].
Таким образом, в результате данной работы было показано, что референсные значения, используемые в группе здоровых небеременных женщин и мужчин, не подходят для интерпретации результатов гемостазиограммы у беременных. Кроме того, должны учитываться особенности диагностического оборудования и реагентной базы, поскольку референсные интервалы для большого количества лабораторных исследований являются метод-зависимыми. Так, в данной работе исследования проводились на автоматическом анализаторе STA-Compact (Diagnostica Stago, Франция) клоттинговыми, хромогенными и иммунотурбидиметрическими методами.
В результате были сформированы референсные интервалы для восьми гемостазиологических показателей в зависимости от срока физиологической беременности согласно правилам, регламентированным руководствами CLSI и IFCC. Полученные интервалы могут быть использованы в других клинико-диагностических лабораториях после соответствующей валидации, согласно требованиям Института клинических и лабораторных стандартов (CLSI). Предполагается, что любая лаборатория может использовать референсные интервалы как свои собственные, если при тестировании 20 образцов со сходными клиническими характеристиками не более 2 результатов выходят за границы данных референсных интервалов [15, 18, 19].
Таким образом, для оценки исследованных параметров системы гемостаза у беременных необходимо использовать референсные значения, рассчитанные для каждого гестационного возраста. Использование у беременных референсных значений для небеременных женщин может привести к неправильной интерпретации гемостазиограммы.



