Согласно статистическим данным, рак шейки матки (РШМ) является вторым наиболее распространенным видом рака среди женщин во всем мире [1]. Проблема предшествующих диспластических процессов шейки матки также остается актуальной на протяжении последних десятилетий. Выделяют цервикальные интраэпителиальные неоплазии различной степени выраженности: слабые, умеренные и тяжелые (CIN I, CIN II, CIN III). При этом развитие инвазивного рака из CIN, как правило, протекает медленно и может длиться десятилетиями [2], что дает возможность для эффективного обнаружения патологических процессов на этапе преинвазивной фазы болезни.
Практически все неоплазии шейки матки развиваются в присутствии вируса папилломы человека (ВПЧ). Инфицирование эпителиальной ткани ВПЧ сопровождается интеграцией ДНК вируса в геном клетки и последующей экспрессией вирусных онкогенных белков E6 и E7. Таким образом, реализуется модель вирус-опосредованного канцерогенеза. В трансформированных клетках включаются сложные многоступенчатые механизмы накопления генетических изменений, приводящие к нарушению регуляции клеточного цикла [3].
Онкобелки Е6 и E7, взаимодействуя с белком ретинобластомы pRb, вызывают последующую инактивацию опухоль-супрессорного белка р53 – ключевого регулятора пролиферации [4, 5]. Еще одним свойством ВПЧ-онкобелка Е7 является его выраженное иммуносупрессивное действие, которое снижает эффективность иммунокорригирующих методов лечения с применением интерферонов и иммуномодуляторов [6].
В развитии опухолевых процессов важную роль играют эпигенетические нарушения экспрессии генов. В результате аномального метилирования подавляется образование белковых продуктов, необходимых для нормального клеточного цикла, дифференцировки и апоптоза [7–9]. К настоящему времени идентифицировано много генов, основной причиной инактивации которых при развитии патологий шейки матки являются эпигенетические повреждения [7]. В частности, у пациенток с CIN гиперметилированы гены-супрессоры опухолевого роста HIC1, MLH1, RASSF1, MGMT, N33, CDH1 [10].
В развитии инвазивного плоскоклеточного РШМ ключевую роль играет ангиогенез, индуцируемый, в частности, фактором роста эндотелия сосудов (VEGF). В клетках, инфицированных ВПЧ 16-го типа, обнаружен высокий уровень экспрессии VEGF, активируемый онкогеном E6 путем прямой стимуляции [11].
К основному методу терапии CIN относится хирургическое вмешательство, включающее лазерную, электрическую и радиоволновую эксцизию или конизацию. Также используют такие деструктивные манипуляции, как криодеструкция и диатермокоагуляция [12]. При CIN I тактика может различаться в зависимости от индивидуальных особенностей пациентки. Для восстановления нормального физиологического микробиоценоза влагалища после хирургического вмешательства пациенткам назначаются эубиотические препараты.
Следует отметить, что, несмотря на применение различных органосохраняющих хирургических процедур, подобное лечение зачастую ведет к посттерапевтическим рецидивам, а также сопряжено с развитием осложнений, отражающихся на репродуктивной функции пациенток [13]. В связи с этим представляет интерес поиск терапевтических методов, способствующих обратному регрессу неопластических процессов, что позволит избежать оперативного вмешательства и связанных с ним осложнений.
 В состав препарата промисан входят два вещества: индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG). В одной капсуле содержится 90 мг I3C и 45 мг EGCG. Эти субстанции обладают мультитаргетным действием, то есть их мишенями являются не один, а несколько патологических молекулярных механизмов [10, 14, 15]. Противоопухолевая активность I3C как средства профилактики и лечения РШМ была подтверждена в плацебо-контролируемых клинических исследованиях [16]. Получены данные и об активности EGCG в отношении цервикальных дисплазий при пероральном приеме в дозе 200 мг в день в течение 12 недель [17]. Помимо этого, в комплексной терапии CIN II степени промисан снижает метилирование генов MLH1, HIC1, RASSF-1А, восстанавливая противоопухолевую защиту клеток, а также снижая вероятность рецидива после хирургического вмешательства [18].
В состав препарата промисан входят два вещества: индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG). В одной капсуле содержится 90 мг I3C и 45 мг EGCG. Эти субстанции обладают мультитаргетным действием, то есть их мишенями являются не один, а несколько патологических молекулярных механизмов [10, 14, 15]. Противоопухолевая активность I3C как средства профилактики и лечения РШМ была подтверждена в плацебо-контролируемых клинических исследованиях [16]. Получены данные и об активности EGCG в отношении цервикальных дисплазий при пероральном приеме в дозе 200 мг в день в течение 12 недель [17]. Помимо этого, в комплексной терапии CIN II степени промисан снижает метилирование генов MLH1, HIC1, RASSF-1А, восстанавливая противоопухолевую защиту клеток, а также снижая вероятность рецидива после хирургического вмешательства [18].
Активные субстанции I3C и EGCG направленно воздействуют на патогенетические механизмы развития папилломавирусной инфекции, подавляют воспаление, ингибируют рост диспластических клеток, блокируя пути стимуляции патологической клеточной пролиферации, индуцируемые ростовыми факторами, подавляют неоангиогенез и повышение инвазивной активности трансформированных клеток, стимулируют их апоптоз [19–21]. При этом эти вещества не вызывают осложнений и не оказывают отрицательных побочных эффектов.
Целью настоящего исследования являлась оценка эффективности лечения пациенток с диагнозом CIN I–II степени с использованием препарата промисан.
Материал и методы исследования
В исследование были включены 218 пациенток с диагнозом CIN I–II, наблюдавшихся в ФГБУ Российский научный центр рентгенорадиологии (РНЦРР). Возраст женщин колебался от 21 до 40 лет (средний возраст составил 27,8±0,7 года). Критерием включения больных в исследование являлось: желание беременности, возраст старше 18 лет, отсутствие лечения дисплазии в предыдущие 4 месяца. Критерием исключения являлось обнаружение злокачественной опухоли органов репродуктивной системы или другой локализации, инфекция мочеполовой системы в фазе активного воспаления, заболевания сердечно-сосудистой и нервной систем, почечная или печеночная недостаточность, возраст старше 40 лет. При обследовании были использованы следующие методы: клинико-анамнестический, цитологическое исследование мазков с поверхности шейки матки и цервикального канала, ВПЧ-типирование, ультразвуковое исследование органов малого таза, кольпоскопия, цитологическое и гистологическое обследование.
Пациентки были распределены в три группы. Первая группа (118 пациенток) получала препарат промисан по 2 капсулы 2 раза в день на фоне приема эубиотиков в виде вагинальных свечей. Пациенткам второй группы (60) проводилось хирургическое радиоволновое лечение, включающее конусовидное удаление шейки матки с использованием аппарата Surgitron (США). В третьей группе (40) проводилось динамическое наблюдение, которое прекращалось при отрицательной динамике данных цитологического исследования. Длительность лечения составила 12 месяцев. В течение этого периода были запланированы четыре визита на контрольные обследования (каждые 3 месяца).
Окончательная (через 12 месяцев) эффективность терапии оценивалась гистологически: забор ткани для гистологической оценки выполнялся прицельно под контролем кольпоскопа с помощью конхотомных биопсийных щипцов для исключения коагуляции краев биоптата. Устанавливался гистологический диагноз для каждого индивидуального случая. Критерием эффективности служила регрессия CIN.
 Эффективность также оценивалась визуально динамикой результатов кольпоскопического обследования и результатами цитологического исследования, которое проводилось в цитологической лаборатории РНЦРР и использовались две методики оценки материала: окраска по Романовскому–Гимзе с 4 классами дифференцировки состояния эпителия шейки матки и жидкостная цитология.
Эффективность также оценивалась визуально динамикой результатов кольпоскопического обследования и результатами цитологического исследования, которое проводилось в цитологической лаборатории РНЦРР и использовались две методики оценки материала: окраска по Романовскому–Гимзе с 4 классами дифференцировки состояния эпителия шейки матки и жидкостная цитология.
Особенно важным критерием положительной оценки был фактор элиминация ВПЧ-инфекции (ПЦР диагностика) в соскобе эпителия шейки матки и цервикального канала пациенток. Основные демографические показатели были предварительно проанализированы: рост, возраст, масса тела, статус ВПЧ, метод контрацепции, курение (фактор риска). Полученные данные свидетельствуют о возможности объединения пациенток в группы для анализа, согласно задачам исследования, считая выборку исследования гомогенной.
Для определения статистической значимости различий между группами был использован критерий χ2. Статистическую обpаботку матеpиала выполняли с использованием стандаpтного пакета пpогpамм пpикладного статистического анализа Statistica v. 6.0. Кpитический уpовень значимости пpинимали pавным 0,05.
Результаты и обсуждение
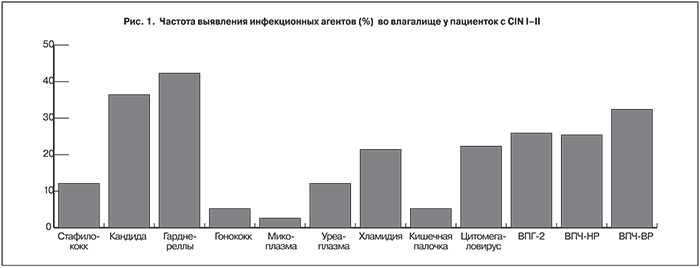
Основной целью исследования было доказательство возможности консервативного излечения CIN I–II, а также обоснование применения препарата промисан в качестве патогенетической профилактики РШМ. Цервикальную интраэпителиальную неоплазию мы прежде всего рассматриваем как морфологический ответ на хронический воспалительный процесс во влагалище, связанный с нарушенным биоценозом. Причем, как правило, имеет место сочетание самых разнообразных инфекционных агентов. На нашем материале (рис. 1) у всех пациенток выявлены те или иные инфекционные агенты, в том числе ВПЧ. С наибольшей частотой 48,3% диагностирована гарднерелла. Вирус папилломы человека установлен в 57,8% наблюдений. Вирус простого герпеса 2-го серотипа обнаружен в 25,9%.
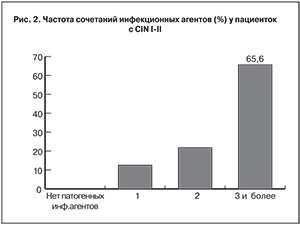
Но самое главное, в подавляющем числе наблюдений отмечена ассоциация инфекционных агентов (рис. 2), что свидетельствует о выраженных изменениях биоценоза и, как следствие, о нарушении регенерационных процессов в зоне плоского эпителия шейки матки.
Таким образом, доминирующим фактором, сопровождающим CIN I–II, является хронический инфекционный процесс, формирующий патогенетическую базу цервикальной интраэпителиальной неоплазии. В наших исследованиях также установлена наиболее частая ассоциация папилломовирусной инфекции с цитомегаловирусом (36,4%) и бактериальным вагинозом (62,8%) (рис. 3).
Причинно-следственная связь диспластических процессов плоского эпителия шейки матки и хронической инфекции в нашем исследовании является как бы маркером оценки эффективной терапии. Нормализация кольпоскопической картины и данных цитологического исследования в определенном смысле отражает идею патогенетической терапии, а элиминация вируса становится убедительным фактором противоопухолевой профилактики. На рис. 4 представлены данные анализа группы больных с CIN I–II, которым предпринята консервативная терапия.
Результаты исследования свидетельствуют о том, что наиболее полно эффективность подобного варианта лечения проявляется через 12 месяцев. Однако элиминация вирусной инфекции достаточно убедительно была зафиксирована уже на 6 месяце лечения, снизившись с 56,4 до 12,2%. То, что клинические (кольпоскопические) и цитологические изменения наступают спустя год, находит свое объяснение в динамике смены плоского эпителия, которая в среднем происходит через 120–150 дней. Вероятно, для клинической и цитологической реализации наиболее полного лечебного эффекта необходимы 2–3 обновления плоскоэпителиального покрова шейки матки. Этот фактор в значительной степени обосновывает и корректирует сроки лечения в подобных клинических ситуациях.
Несколько иная ситуация была характерна для пациенток, которым было выполнено радиохирургическое вмешательство (рис. 5).

В первую очередь надо отметить, что динамика нормализации покровного эпителия шейки матки (по данным кольпоскопического обследования) через 6 месяцев гораздо более выраженная: лишь в 23,3% наблюдений имелись нарушения в кольпоскопической картине плоскоэпителиального покрова шейки матки, в то время, как за этот же срок таких пациенток в I группе было 65,5%. Практически мало изменился инфекционный фон за этот отрезок времени – ВПЧ-инфекция сохранилась у большинства пациенток (63,3%), что намного выше, если сравнить этот критерий с I группой (12,2%), где отмечено практически 5-кратное уменьшение. Однако наиболее впечатляющие данные проявились через год наблюдений. Если в группе с консервативной терапией все три критерия стабильно подошли с положительной динамикой (нормализация данных кольпоскопического обследования, элиминация вируса, нормальная цитограмма), то в группе с радиохирургическим лечением к 12-му месяцу отмечена четкая тенденция ухудшения и клинических, и цитологических данных. Частота ВПЧ инфекции практически осталась на том же уровне. При сравнении группы пациенток с консервативной терапией обнаружено значимое различие в частоте выявления ВПЧ через 3 и 6 месяцев терапии (p=0,965 и p=0,172 соответственно по критерию χ2), что свидетельствует о преимущественной эффективности консервативной терапии, имеющей мультитаргетное направление.
Интересна с точки зрения понимания динамики СIN третья группа, где пациенткам не проводилось никакое лечение. Эти данные отражены на рис. 6.
За 12 месяцев наблюдения практически мало изменилась визуальная клиническая симптоматика. Увеличилось на 7,5% (с 40 до 52,5%) число наблюдений с присутствием вируса папилломы человека. Вместе с тем у трети пациенток – n=13 (32,5%) самостоятельно нормализовалась цитограмма. Надо отметить, что у большинства больных (10) в этой группе ВПЧ не был диагностирован. Трех пациенток (7,5%) после 6-месячного мониторинга и 5 пациенток (12,5%) после 12-месячного мониторинга пришлось исключить из дальнейшего наблюдения ввиду ухудшения данных цитологического исследования. Во всех этих ситуациях отмечено присутствие вируса папилломы человека. Таким образом, естественная история развития CIN I–II разнонаправлена. Естественно, возникает закономерный вопрос: какова наиболее адекватная тактика, учитывающая акушерско-гинекологическую и онкологическую сторону проблемы? По результатам проведенного исследования следует основной вывод: при всех вариантах CIN I–II следует придерживаться тактики консервативного лечения. Лишь при вариантах неэффективной терапии в течение 12 месяцев следует прибегать к хирургическому лечению. Мы видим, что не всегда цервикальная интраэпителиальная неоплазия индуцируется вирусной инфекцией. В наших наблюдениях сочетание ВПЧ и CIN отмечено в 57,8%. Более дифференцированная тактика на самом начальном этапе терапии возможна лишь при молекулярно-биологических тестах, характеризующих начальный канцерогенез. Что касается места хирургического метода в лечении CIN I–II, то окончательная эффективность его может быть потенцирована противовоспалительной терапией. Иными словами, любому хирургическому вмешательству на шейке матки должна предшествовать и далее ее сопровождать противовоспалительная (а при инфекции во влагалище и санирующая) терапия. Уже известно из многих источников, что компонент промисана индол-3-карбинол является эффективным ингибитором провоспалительных цитокинов. Этот эффект принципиально важен, так как на протяжении всего канцерогенеза воспаление формирует условия, обеспечивающее персистенцию опухолевого процесса. Кроме того, регенерация на фоне инфекции сопряжена с множеством осложнений, что ухудшает окончательный результат. Наконец последнее: любое хирургическое вмешательство при доброкачественных и злокачественных процессах – это не патогенетическое лечение. Необходимость патогенетической составляющей в ходе терапии и длительно после нее позволяет обеспечить эффективную нормальную регенерацию с последующей эффективной профилактикой рецидива. Иными словами, современное хирургическое лечение дисплазии шейки матки должно начинаться с консервативной терапии и продолжиться виде уже обозначенной консервативной терапии. Статистический анализ также показал значимость различий между группой хирургического лечения пациенток и группой динамического наблюдения по частоте исчезновения поражений эпителия экзоцервикса: p<0,001 (критерий χ2).
Заключение
Таким образом, современная тактика терапии CIN I–II у пациенток репродуктивного возраста на первом этапе должна быть ориентирована на консервативное лечение с включением препарата промисан как эффективного мультитаргетного средства и нормализации биоценоза влагалища, что будет способствовать реализации щадящих, органосохраняющих принципов.



