Эритропоэтин (ЭПО) является гормоном, ответственным за пролиферацию и дифференцировку клеток, что связано с угнетением апоптоза в ЭПО-чувствительных тканях [1, 2]. Фактором, индуцирующим синтез ЭПО, является гипоксия различного генеза [1], в том числе плацентарная ишемия [2–4]. Предполагается, что экспрессия ЭПО в плаценте играет роль в процессах выживания клеток трофобласта [2]. Кроме того, секреции ЭПО при фетальной гипоксии придают огромное значение в связи с его нейропротективным действием, которое связано с антиапоптозным и ангиогенез стимулирующим эффектами [3].
Преэклампсия (ПЭ) остается одной из основных причин материнской и перинатальной заболеваемости и смертности [5, 6]. Согласно наиболее признанной гипотезе, формирование ПЭ происходит на ранних сроках беременности: ряд предрасполагающих факторов приводит к нарушению инвазии трофобласта, развитию недостаточности маточно-плацентарного кровотока и ишемии плаценты [5, 6].
В настоящее время активно изучается участие ЭПО в патогенезе развития ПЭ, однако сведения об этом достаточно противоречивы [4, 7–10]. Изучение ЭПО-статуса и плацентарной экспрессии ЭПО при беременности, осложнившейся ПЭ, представляет несомненный клинический интерес и расширяет представления о патогенезе формирования и нарастания тяжести ПЭ.
Целью настоящего исследования стало определение значимости ЭПО сыворотки крови и его плацентарной экспрессии в патогенезе развития ПЭ.
Материал и методы исследования
Нами проведено исследование «случай-контроль» 39 беременных женщин, которые получали стационарное лечение в родильном доме клиники ГБОУ ВПО ЮУГМУ Минздрава России. Критерием включения беременных в исследование было информированное согласие женщины на участие в исследовании. Критерии исключения: онкологические заболевания, ВИЧ-инфекция, туберкулез, тяжелая соматическая патология, психические заболевания, наркомания. План исследования соответствует законодательству России, международным этическим нормам и нормативным документам исследовательских организаций, одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава России. Изучены особенности течения беременности и родов, определена адекватность продукции ЭПО, проведено морфологическое исследование плацент.
В зависимости от наличия ПЭ и степени ее тяжести [7] выделены: 1-я группа (контрольная) – 11 женщин, течение беременности которых не осложнилось развитием ПЭ; 2-я группа – 14 беременных с умеренной ПЭ; 3-я – 14 пациенток с тяжелой ПЭ. Средний возраст женщин 1-й группы составил 27,00±1,67 года, 2-й – 27,63±1,05 года, 3-й – 30,36±1,64 года.
Иммунологические методы: определение ЭПО сыворотки крови матери (почечного и плацентарного происхождения, нельзя исключить наличие ЭПО плодового происхождения) – твердофазный хемилюминесцентный иммуноферментный анализ (сэндвич) с использованием анализатора IMMULITE 2000 EPO (DPC, США). Данный метод определения ЭПО позволяет выявить несколько фракций, идентичных по молекулярной массе, но различающихся по величине их изоэлектрических точек, что свидетельствует о гетерогенности в структуре углеводной части гормона [11]. Рассчитывали коэффициент адекватности продукции ЭПО (КАэпо – отношение логарифма наблюдаемого сывороточного ЭПО к логарифму предполагаемого сывороточного ЭПО, в норме КАэпо 0,8–1,2 свидетельствует об адекватной продукции ЭПО) [12].
Исследовали 11 плацент женщин 1-й группы, 15 – 2-й группы (в том числе 2 плаценты из бихориальной биамниотической двойни), 17 – 3-й группы (в том числе 2 плаценты из бихориальной биамниотической двойни, 3 плаценты из трихориальной триамниотической тройни). Иммуногистохимическое исследование использовали для оценки в симпластотрофобласте, эндотелии капилляров, макрофагах стромы ворсин (плодовая часть плаценты) и фетальных эритроцитах капилляров ворсин плаценты экспрессии ЭПО. В качестве первичных специфических антител использовали моноклональные антитела к ЭПО (N-19): sc-1310-R, Santa Cruz Biotechnology, Inc., California, USA. Количественное исследование для маркера ЭПО проводили в 10 случайно выбранных полях зрения при увеличении 400, подсчитывая количество клеток, дающих интенсивное связывание пероксидазы в 1 мм2. Просмотр и фотосъемку микропрепаратов осуществляли на микроскопе «Leica» (Germany) с использованием цифровой фотокамеры «Carl Zeiss Jena» (Germany).
Все статистические расчеты были выполнены с помощью пакетов программ: SPSS 12.1, Statistica for Windows 6.0, STADIA 6.3 prof. Для оценки различий между группами обследуемых применен аппарат проверки статистических гипотез с использованием критериев Манна–Уитни, χ2 Пирсона; отношение правдоподобия, линейно-линейная связь; Тау Гудмена и Краскала; коэффициент неопределенности при уровне значимости критерия 0,05. Для выявления степени корреляционной зависимости между показателями использовался непараметрический корреляционный анализ с расчетом коэффициента непараметрической корреляции Спирмена.
Результаты исследования и обсуждение
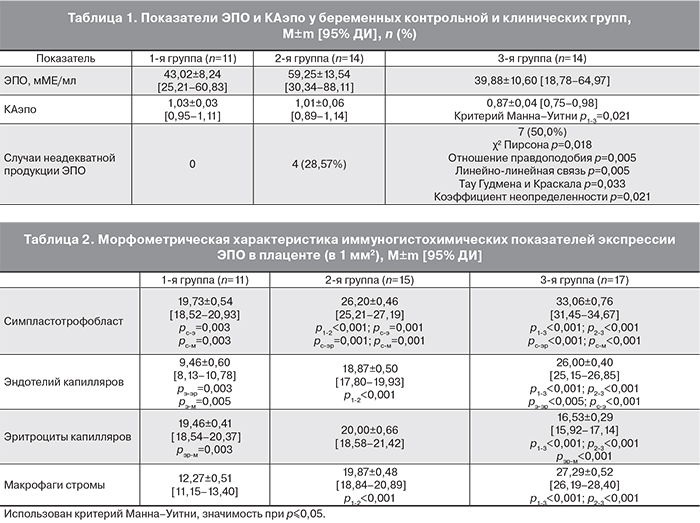
На современном этапе актуальной проблемой является изучение связи фетальных и неонатальных исходов с уровнем ЭПО в материнской и плодовой плазме крови, в амниотической жидкости, плаценте [3, 7, 9, 10]. Поэтому мы решили изучить ЭПО-статус беременных женщин, которые участвовали в нашем исследовании (табл. 1).
В сравнении с группой контроля при умеренной ПЭ нами выявлена тенденция к увеличению, а при тяжелой ПЭ – к снижению уровня сывороточного ЭПО, однако статистически значимых отличий не установлено. Показатель КАэпо при тяжелой ПЭ оказался достоверно меньше, чем в контрольной группе. Только при ПЭ нами были зарегистрированы случаи неадекватной продукции ЭПО (КАэпо менее 0,8), причем частота выявления оказалась наибольшей при тяжелой ПЭ (50,0% случаев).
Согласно данным современной литературы, повышенную продукцию ЭПО в условиях гипоксии тесно связывают с синтезом провоспалительных цитокинов (фактор некроза опухоли-α, интерлейкин-1), так как участок гена, инициирующий транскрипцию ЭПО, имеет практически идентичную последовательность кодонов в цепи ДНК с участками генов указанных цитокинов, экспрессия которых регулируется парциальным давлением кислорода [13]. Провоспалительные цитокины способствуют клеточному апоптозу, нарушению продукции ЭПО и снижению чувствительности эритроидных прекурсов к его действию [14], являясь антагонистами ЭПО. Как мы предполагаем, показатель ЭПО изменяется на разных стадиях патологического процесса, сопровождающегося длительной гипоксией и повышенной продукцией провоспалительных цитокинов. Этим, возможно, объясняются неоднозначные результаты исследований, посвященных изучению ЭПО-статуса при различных патологиях, в том числе и во время беременности. Действительно, N. Yazihan и соавт. (2007), S. Zamudio и соавт. (2007) отмечают увеличение ЭПО в крови женщин с ПЭ [4, 10].
R. Hershkovitz и соавт. (2005) не выявили статистически значимых изменений концентрации ЭПО при ПЭ [8]. В.А. Бурлев и соавт. (2007) зарегистрировали синдром неадекватной продукции ЭПО у беременных с ПЭ [7].
В настоящее время доказано, что ткани матки, плаценты, эмбриональные ткани являются одновременно и ЭПО-чувствительными, и ЭПО-продуцирующими [2, 15]. Экспрессия ЭПО и эритропоэтиновых рецепторов представлена на клетках цито- и синцитиотрофобласта, эндотелиальных клетках плацентарных кровеносных сосудов на всех сроках гестации [2, 15].
В тканях плаценты женщин 1-й группы экспрессия ЭПО определялась чаще в симпластотрофобласте и эритроцитах сосудов стромы ворсин по сравнению с эндотелием сосудов и клетками (макрофагами) стромы ворсин (табл. 2).
В тканях плаценты женщин с умеренной ПЭ экспрессия ЭПО в симпластотрофобласте, эндотелии капилляров и эритроцитах сосудов ворсин, макрофагах стромы ворсин была значительно выше таковых в контроле (табл. 2). Причем экспрессия ЭПО чаще определялась в симпластотрофобласте ворсин.
При тяжелой ПЭ (табл. 2, рис. 1 см. на вклейке) экспрессия ЭПО в симпластотрофобласте, эндотелии сосудов и макрофагах стромы ворсин была достоверно выше, а в эритроцитах сосудов стромы ворсин – ниже по сравнению с группой контроля и 2-й группой наблюдения.
В то же время в 3-й группе показатели экспрессии ЭПО в симпластотрофобласте значительно превышали таковые в эндотелии сосудов, эритроцитах сосудов, макрофагах стромы ворсин.
Таким образом, результаты нашего морфометрического исследования показали значительное увеличение экспрессии ЭПО во всех изучаемых структурах плаценты при развитии и нарастании тяжести ПЭ. Одновременно при тяжелой ПЭ зарегистрировано снижение уровня ЭПО в эритроцитах капилляров ворсин.
Основная часть современных авторов указывает на участие плаценты в синтезе ЭПО в условиях плацентарной ишемии, в том числе и при ПЭ [2–4,16]. Предположено (S. Zamudio и соавт., 2007), что ядерная транскрипция гипоксия-индуцибельного фактора-1 клетками трофобласта способствует транспорту кислорода через плаценту посредством увеличения синтеза ЭПО, стимуляции эритропоэза и плацентарного неоангиогенеза за счет повышения уровня трансформирующего фактора роста β3 и фактора роста эндотелия сосудов [4]. Роль ЭПО в условиях плацентарной ишемии и гипоксии плода связывают с его нейропротективными эффектами, которые обусловлены антиапоптотическими и ангиогенными свойствами ЭПО [3, 4], что обусловливает его участие в выживаемости, пролиферации и дифференцировке клеток трофобласта. Кроме того, согласно результатам исследования V. Jain и соавт. (2006), повышение уровня ЭПО тормозит сократительную активность гладких мышц плацентарных сосудов, поэтому увеличение содержания ЭПО приводит к улучшению плацентарной перфузии в условиях ишемии плаценты и гипоксии плода [16]. Плацентарная ишемия является причиной формирования задержки развития плода и ПЭ, а ПЭ, в свою очередь, вызывает нарастание тяжести плацентарной недостаточности [4, 5]. Поэтому при развитии ПЭ можно ожидать увеличение плацентарной экспрессии ЭПО как результат развития гипоксии плаценты.
В результате нашего исследования зарегистрирована экспрессия ЭПО на мембранах эритроцитов в капиллярах ворсин. Действительно, ряд исследователей [17, 18] обнаружили рецепторы к ЭПО на эритроцитах, в том числе содержащих фетальный гемоглобин, однако их плотность на мембране красных клеток оказалась очень низкой. Предполагают, что связывание ЭПО с рецепторами на мембране эритроцитов позволяет поддерживать кальциевые каналы в закрытом состоянии. Деградация рецепторов к ЭПО на мембранах эритроцитов по мере их старения приводит к активации кальциевых каналов и запуску эриптоза. Аналогичная ситуация зарегистрирована при дефиците ЭПО, окислительном стрессе и осмотическом шоке [17, 18]. Указанные процессы ингибируются ЭПО, антиоксидантами [18]. При морфометрическом исследовании плацент женщин с тяжелой ПЭ нами зарегистрировано снижение экспрессии ЭПО в эритроцитах капилляров ворсин, что, как мы предполагаем, свидетельствуют о запуске программ эриптоза в этих клетках на фоне тех патологических изменений, которые характерны для тяжелой ПЭ (гипоксия, дислипидемия, активация перекисного окисления липидов, эндотелиальная дисфункция, системное воспаление) [5, 6, 9].
Мы решили изучить корреляционные связи сывороточного материнского ЭПО и КАэпо беременных с показателями экспрессии ЭПО в изученных нами структурах плаценты. Показатели экспрессии ЭПО в симпластотрофобласте, эндотелии капилляров, макрофагах стромы связаны положительными корреляционными связями с частотой случаев неадекватной продукции ЭПО (r=-0,377, р=0,014; r=-0,429, р=0,005; r=0,444; р=0,003 соответственно); отрицательными – с КАэпо (r=-0,377, р=0,014; r=-0,429, р=0,005; r=-0,398; р=0,009 соответственно). Показатель экспрессии ЭПО в эритроцитах капилляров связан положительными корреляционными связями с КАэпо (r=0,332, р=0,032), отрицательными – с частотой случаев неадекватной продукции ЭПО (r=-0,355, р=0,021).
Таким образом, неадекватная продукция ЭПО ассоциирована с повышенной плацентарной экспрессией ЭПО в симпластотрофобласте, эндотелии капилляров и макрофагах стромы хориальных ворсин. Мы не выявили статистически значимых корреляций сывороточного уровня ЭПО беременных с плацентарной экспрессией ЭПО. Вероятно, патологические изменения на уровне плаценты при развитии ПЭ связаны не с истинным количественным уровнем ЭПО сыворотки крови беременных женщин, а с формированием неадекватной его продукции.

Нами выявлены отрицательные корреляционные связи показателя экспрессии ЭПО в эритроцитах капилляров с частотой случаев неадекватной продукции ЭПО. Согласно данным литературы, эриптоз ингибируется ЭПО, при снижении его уровня механизм запрограммированной клеточной гибели будет инициирован в эритроцитах независимо от их возраста [17, 18]. Возможно, что в условиях неадекватной продукции ЭПО при плацентарной ишемии у плода активируются процессы запрограммированной клеточной гибели, в том числе и эриптоз.
С целью изучения значения неадекватной продукции ЭПО при таких акушерских осложнениях, как тяжелая ПЭ и суб- и декомпенсированная хроническая плацентарная недостаточность, использован корреляционный анализ Спирмена. Корреляций между сывороточным уровнем ЭПО и гестационной патологией нами не выявлено. Частота случаев неадекватной продукции ЭПО положительно коррелирует с частотой тяжелой ПЭ (r=0,372; p=0,015) и суб-, декомпенсированной хронической плацентарной недостаточности (r=0,418; p=0,006); показатель КАэпо имеет отрицательные корреляционные связи с частотой тяжелой ПЭ (r=-0,308; p=0,047) и суб-, декомпенсированной хронической плацентарной недостаточности (r=-0,303; p=0,05). Таким образом, указанная акушерская патология ассоциирована с развитием неадекватной продукции ЭПО, что, вероятно, свидетельствует об однотипных механизмах развития этих гестационных осложнений.
Мы предлагаем следующую схему участия ЭПО в патогенезе развития ПЭ (рис. 2).
Согласно современным представлениям причиной развития ПЭ является нарушение инвазии трофобласта, плацентарная ишемия [5, 6]. В основе формирования указанной патологии лежит дисбаланс факторов, регулирующих ангиогенез, процессы апоптоза и клеточной пролиферации [6, 19, 20]. Одним из таких факторов является ЭПО, экспрессия которого представлена в плаценте на всех сроках гестации [2, 15]. Поэтому нельзя исключить участие ЭПО в процессах инвазии цитотрофобласта, а значит и формирования плацентарной недостаточности и развития ПЭ.
При ПЭ в условиях плацентарной ишемии наряду с патологическими изменениями плаценты (ишемические инфаркты, незрелые хориальные ворсины [21]), активируются и компенсаторно-приспособительные механизмы: вследствие экспрессии гипоксия-индуцибельного фактора-1 увеличивается транспорт кислорода через плаценту в связи с повышением синтеза ЭПО, стимуляции эритропоэза и плацентарного неоангиогенеза, что отражает паракринную роль ЭПО в процессах выживания, пролиферации и дифференцировки клеток плацентарного трофобласта [2, 21].
Фактором, индуцирующим синтез ЭПО в перитубулярных и тубулярных клетках почек (до 85%), является гипоксия различного генеза [1, 12, 14], в том числе и плацентарная [2–4, 16]. Поэтому при развитии ПЭ на фоне ишемии плаценты ожидается увеличение уровня ЭПО в системном кровотоке матери. Действительно, результаты нашего исследования [9] указывают на незначительное повышение сывороточного показателя ЭПО при умеренной ПЭ, что подтверждается рядом авторов [4, 10].
Указанные изменения ЭПО мы связываем с увеличением не только почечной, но и плацентарной продукции данного гормона. N. Yazihan и соавт. (2007) считают, что увеличение уровня материнского ЭПО вызывает артериальную гипертензию при ПЭ, а также приводит к уменьшению оксида азота на уровне плаценты, нарушая инвазию трофобласта [10].
Однако согласно результатам нашего исследования случаи тяжелой ПЭ с первого триместра гестации сопровождались неадекватной продукцией ЭПО [9], что также подтверждается данными современной литературы [7]. Снижение уровня материнского сывороточного ЭПО, вероятно, связано с нарушением его почечной и, возможно, плацентарной продукции. Действительно, нами зарегистрированы более высокие уровни показателей азотистого обмена (креатинин, мочевина) при тяжелой ПЭ уже с первого триместра гестации [9]. Угнетение синтеза ЭПО почками, как мы считаем, связано с повышенным уровнем провоспалительных цитокинов [14], продукция которых увеличивается в условиях синдрома системного воспалительного ответа при развитии ПЭ [5, 22]. Источником провоспалительных интерлейкинов при ПЭ является и ишемизированная плацента. Согласно данным литературы, плацентарные макрофаги за счет секреции цитокинов могут не только изменять цитокиновый баланс, действуя на клетки микроокружения эндотелиальных клеток, но и самостоятельно активно влиять на все этапы ангиогенеза и развития плаценты [23]. Нельзя исключить вероятность, что при низких концентрациях интерлейкинов на начальных этапах формирования ПЭ характерен повышенный синтез ЭПО, а при ее тяжелом течении, когда количество цитокинов резко увеличивается, возможно, происходит снижение образования ЭПО. Этим, вероятно, объясняются неоднозначные результаты исследований, посвященных изучению ЭПО-статуса при ПЭ. Следует отметить, что при развитии и нарастании тяжести ПЭ у беременных кроме снижения продукции ЭПО нами выявлено угнетение эритропоэза, нарушение обмена железа без развития выраженного анемического синдрома [9]. Указанные изменения были зарегистрированы и другими авторами [7].
Такой вариант анемии, ассоциированной с ПЭ, следует рассматривать как частный случай анемии хронических заболеваний [24]. Развитие ЭПО-дефицитного анемического синдрома при ПЭ, безусловно, приводит к гемической гипоксии, замыкая порочный круг.
Кроме того, не следует исключать системные плейотропные протективные эффекты ЭПО в условиях его повышенной продукции. Согласно данным литературы ЭПО увеличивает длительность функционирования эндотелиальных клеток при кислородном голодании, обладает антиапоптическим эффектом по отношению к клеткам эндотелия, вызывает активацию эндотелиальной NO-синтетазы и предотвращает ангиоспазм, уменьшает NO-токсичность и обладает прямым антиоксидантным эффектом [25, 26]. Ренопротективные эффекты ЭПО связаны с увеличением регенерации эпителия канальцев почек и восстановлением функционального аппарата почки, уменьшением воспалительной реакции и дегенерации тканей [1, 27]. В печени ЭПО также снижают уровень окислительного стресса, воспаления и тканевую альтерацию [27, 28]. Нейропротективное действие ЭПО обусловлено антиапоптозными, противовоспалительными, антиокислительными, антинейротоксичными, нейротрофическими эффектами, активацией нейронной регенерации, защитой белого вещества головного мозга от отека [1, 26, 29]. Мы предполагаем, что в условиях неадекватной продукции ЭПО при тяжелой ПЭ снижается цитопротективное действие этого гормона на органы-мишени (эндотелий, печень, почки, центральная нервная система), что, вероятно, способствует развитию полиорганной недостаточности.
Таким образом, согласно результатам нашего исследования ЭПО, вероятно, принимает определенное участие в патогенезе формирования ПЭ, однако исследования в этой области пока единичны, и требуется их дальнейшее продолжение с целью выяснения значения этого гормона в развитии гестационной патологии.



