Актуальность проблемы вагинальной инфекции определяется наиболее высокой ее распространенностью среди всех генитальных воспалительных заболеваний и неблагоприятным влиянием на течение и исходы беременности. В настоящее время увеличивается доля заболеваний нижнего отдела полового тракта, связанных с количественным дисбалансом условно-патогенных микроорганизмов влагалища бактериальной и грибковой природы, которые встречаются у 40–65% беременных, а 5–10% из них страдают рецидивирующим бактериальным вагинозом или кандидозным вагинитом (КВ) [1–4].
Данные литературы свидетельствуют о неблагоприятном влиянии вагинальной инфекции на течение и исход беременности: высокой частоте (более 40%) преждевременного прерывания беременности, развития хориоамнионита и инфекции околоплодных вод, внутриутробной инфекции, послеродовых гнойно-воспалительных осложнений (в 3,5–5,8 раза чаще) и др. [5–8].
В зарубежных исследованиях обсуждается вопрос роли местного и системного иммунитета при КВ [9–11]. Полностью не изучен механизм переключения комменсального микроорганизма Candida albicans на патогенного возбудителя заболевания. Отсутствует единое мнение о специфике клеточного и гуморального иммунитета, ответственного за кандидозную колонизацию [12, 13].
Некоторые исследователи связывают механизм защиты против КВ с активностью клеток Т-хелперов 1-го типа [14]. В связи с тем, что для КВ характерно наличие признаков воспаления с соответствующей лейкоцитарной реакцией в морфологической структуре влагалища, вызывает интерес изучение местного иммунитета для совершенствования профилактики и лечения данного заболевания.
Целью данного исследования стало изучение состояния местного иммунитета у беременных с кандидозным вагинитом, а также оценка эффективности проведения этиотропной терапии.
Материал и методы исследования
Проведено проспективное когортное исследование, в которое были включены 125 беременных женщин. Основную группу составили 54 пациентки с верифицированным диагнозом кандидозный вагинит (КВ), группу сравнения – 71 беременная с нормоценозом влагалища (НЦ). Критерии включения: одноплодная беременность, срок гестации 12–24 недели, отсутствие тяжелой экстрагенитальной патологии.
Для диагностики КВ использовали критерии интегральной микробиологической оценки состояния вагинального микроценоза, включавшей микроскопию мазка, окрашенного по Граму, и культуральное исследование вагинального отделяемого. Ранее были выявлены два варианта КВ: классический вариант, когда дрожжеподобные грибы рода Candida являются моновозбудителем и вегетируют во влагалище на фоне абсолютного доминирования лактобацилл, и сочетание КВ с бактериальным вагинозом, при котором грибы сосуществуют с облигатно-анаэробными бактериями и гарднереллами, а лактобактерии или отсутствуют, или их титр резко снижен. В настоящую работу были включены женщины с классическим вариантом течения КВ.
Лечение пациенток с КВ проводили местным противогрибковым препаратом ливарол (кетоконазол) («Нижфарм», Россия), который обладает фунгицидным и фунгистатическим действием в отношении дерматофитов (Trichophyton spp., Epidermophyton floccossum, Microsporum spp.) и дрожжевых грибков (Candida spp., Pityrosporum spp.), механизм действия препарата заключается в угнетении биосинтеза эргостерола и изменении липидного состав мембраны грибков. Также известна активность кетоконазола в отношении стрептококков и стафилококков. Микробиологический контроль эффективности лечения проводили через 7–10 дней после проведенной терапии и в 32–34 недели беременности, вместе с исследованием уровня цитокинов.
Спектр оценки у беременных местного иммунитета включал исследование в отделяемом цервикального канала провоспалительных (TNF-α, IFN-γ, IL-1α, IL-2, IL-6) и противовоспалительных (IL-4, IL-10) цитокинов иммуноферментным методом (ELISA), уровень которых определялся до лечения в II триместре беременности и в 32–34 недели после лечения одновременно с пациентками группы сравнения. Во избежание деградации РНК взятие материала (вагинальные соскобы) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы «Проба НК» («ДНК-Технология», Россия)). Для проведения анализа использовали наборы фирмы «Цитокин» (Санкт-Петербург, Россия). Измерение оптической плотности проводили на планшетном анализаторе фирмы BioTek (США) при длине волны 450 нм. Количественное содержание цитокинов в цервикальной слизи нормировали путем пересчета на общий белок в пробах. Определение белка в пробах проводили колориметрическим методом с помощью бицинхониновой кислоты («Sigma», США).
Исследование профиля экспрессии мРНК цитокинов проводили методом ОТ-ПЦР. Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. Объем образцов после выделения составил 50 мкл. В работе использовались коммерческие реактивы («ДНК-Технология», Россия). В качестве праймеров для обратной транскрипции использовали специфические олигонуклеотиды. Нормировка проводилась по пяти референсным генам HPRT1, TBP, B2M, GUSB, ABL. Использован метод сравнения индикаторных циклов (метод Δ∆Cq). Для удобства интерпретации полученные данные были нормированы на медиану уровня экспрессии соответствующего гена в группе здоровых беременных.
Методы статистической обработки: для каждого количественного параметра были определены среднее значение (М), среднеквадратическое отклонение (δ), ошибка среднего (т), медиана (Me); проведен сравнительный анализ средних тенденций с помощью t-критерия Стьюдента (по результатам предшествующей проверки на нормальность). Для автоматизации статистической обработки использовали статистический пакет SPSS Statistics 17.0 for Windows.
Результаты и обсуждение
При микроскопии вагинального мазка, окрашенного по Граму, в основной группе установлено, что общее количество микроорганизмов у 8 (14,8%) пациенток было умеренным и составляло от 11 до 102 микробных клеток в поле зрения, у 34 (62,9%) было большим – 102–103 микробных клеток в поле зрения. У 12 (22,2%) пациенток выявлена массивная микробная обсемененность (>103 микробных клеток в поле зрения).
Среди эпителиальных клеток преобладали промежуточные (у 100,0% женщин), в 74,1% случаев промежуточные клетки сочетались с небольшим количеством поверхностных. У 16,7% женщин обнаружены парабазальные эпителиальные клетки.
У 51 из 54 (94,4%) пациенток с КВ наблюдалась лейкоцитарная реакция (>11 в поле зрения) и только у 3 (5,6%) количество лейкоцитов не превышало 10 в поле зрения.
Присутствие элементов вегетации дрожжеподобных грибов рода Candida: дрожжевых клеток, в том числе почкующихся, псевдомицелия, часто с бластоспорами, мицелия, микроколоний дрожжеподобных грибов рода Candida при микроскопии вагинальных мазков, окрашенных по Граму, в том или ином сочетании отмечено у всех наблюдаемых беременных этой группы.
По совокупности морфологических признаков были выделены 3 категории пациенток [1]:
- у 3 (5,6%) пациенток отмечалась слабо выраженная объективная симптоматика КВ: отсутствовала значительная лейкоцитарная реакция (количество лейкоцитов не превышало 10 в поле зрения), не было изменений в составе эпителия, дрожжеподобные грибы рода Candida выявляли в редких полях зрения;
- у 42 (77,7%) пациенток отмечена умеренная или выраженная лейкоцитарная реакция (15–50 лейкоцитов в поле зрения), но не было изменений со стороны эпителия, обнаружено умеренное или большое количество дрожжеподобных грибов рода Candida;
- у 9 (16,7%) пациенток была ярко выражена лейкоцитарная реакция (40–70 и более лейкоцитов в поле зрения), в составе эпителия определялись парабазальные клетки, выявлены в большом количестве элементы дрожжеподобных грибов рода Candida.
Культуральное исследование вагинального отделяемого было направлено на выделение и количественную оценку роста дрожжеподобных грибов рода Candida, их видовую идентификацию, а также оценку фоновой бактериальной микрофлоры при КВ. Обращает на себя внимание тот факт, что у 54 обследованных беременных было выделено 60 штаммов дрожжеподобных грибов рода Candida. Возбудителями КВ были дрожжеподобные грибы только рода Candida, представленные 5 видами. Наиболее часто выделяли Candida albicans – у 47 (87,0%) пациенток. Значительно реже высевали Candida glabrata – у 4 (7,4%); Candida parapsilosis, Candida kefyr и Candida tropicalis – по 1 (1,9%) случаю. Суммарно виды non-albicans выделены у 13,0% беременных. Концентрация дрожжеподобных грибов колебалась от 105 до 107 КОЕ/мл. Грибковые моноинфекции составили 98,1% (у 53 пациенток из 54), и только в одном случае (1,9%) КВ был вызван ассоциацией 2 видов грибов: Candida albicans и Candida tropicalis. Следует отметить, что ни разу не были выделены дрожжеподобные грибы в низких титрах (менее 104 КОЕ/мл), то есть ни в одном случае не шла речь о бессимптомном носительстве дрожжеподобных грибов [3, 4, 11].
С целью оценки сопутствующей КВ бактериальной микрофлоры исследован видовой состав условно-патогенных микроорганизмов (УМП) и лактобацилл, а также степень обсемененности ими вагинального отделяемого у наблюдаемых женщин [5].
Рост УПМ отмечен у 32 из 54 (59,3%) беременных с КВ, у 40,7% женщин роста транзиторных микроорганизмов в составе микробиоты влагалища не обнаружено. Группа факультативно-анаэробных УПМ была представлена 6 родами: Staphylococcus, Streptococcus, Enterococcus, Escherichia, Corynebacterium и Neisseria. Чаще других бактерий у обследованных женщин высевали эпидермальный стафилококк (37,0%), кишечную палочку, энтерококк и дифтероиды (по 12,9%). Другие виды микроорганизмов встречались в небольшом проценте случаев. В подавляющем большинстве случаев степень колонизации влагалища факультативно-анаэробными микроорганизмами не превышала 104 КОЕ/мл. Реже их титр достигал умеренных значений – 104–105 КОЕ/мл.
Лактобациллы у 38 беременных с КВ (70,4%) выделены в большом (107–108 КОЕ/мл) количестве и у 16 (29,6%) женщин умеренном (105–106 КОЕ/мл).
Таким образом, при видовом разнообразии состава возбудителей КВ лидирующее место занимал вид Candida albicans. Среди non-albicans видов превалировал вид Candida glabrata. При этом дрожжевые грибы выделяли при различной фоновой микрофлоре, когда доминировали либо лактобациллы, либо облигатные анаэробы [9].
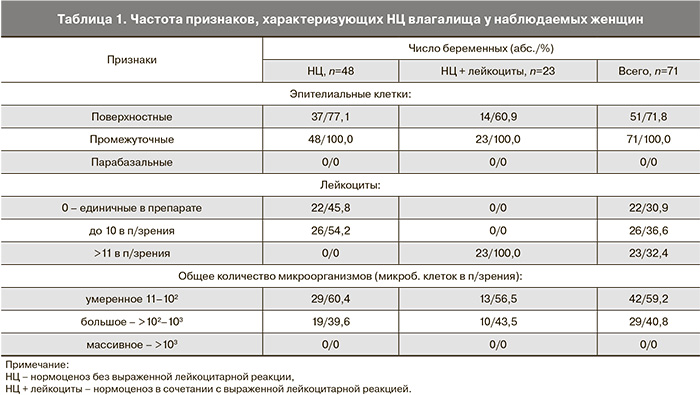
Группу сравнения, как было указано выше, составила 71 пациентка с диагностированным НЦ влагалищного биотопа по данным комплексного микробиологического обследования. Было обращено внимание, что у 23 (32,4%) женщин микроэкологические параметры нормы сочетались с повышенным содержанием лейкоцитов (>11 в поле зрения), тогда как у подавляющего большинства женщин (у 48–67,6%) нормофлора выявлена на фоне минимального количества лейкоцитов. Результаты микроскопического исследования мазков отделяемого влагалища, окрашенных по Граму, у пациенток с нормоценозом представлены в табл. 1.
Из табл. 1 следует, что при НЦ у беременных женщин в составе эпителия доминируют промежуточные клетки, которые выявлены у всех беременных женщин, поверхностные клетки обнаружены у 71,8% женщин. У большинства беременных с НЦ отсутствовала выраженная лейкоцитарная реакция: количество лейкоцитов у 22 (30,9%) женщин исчислялось единичными в поле зрения, а у 26 (36,6%) – не превышало 10 в поле зрения. Однако у 23 (32,4%) пациенток при нормальной микрофлоре отмечена выраженная лейкоцитарная реакция (20–40 лейкоцитов в поле зрения). Общая микробная обсемененность почти с одинаковой частотой в обеих группах была умеренной (у 59,2% женщин) или большой (у 40,8% женщин).

В составе микрофлоры абсолютно доминировали морфотипы лактобацилл, прочие морфотипы при микроскопии вагинальных мазков не определялись. При культуральном исследовании у 35 (49,3%) женщин выделены лактобациллы в умеренном или высоком титре (106–108 КОЕ/мл) и у 36 (50,7%) пациенток лактофлора выделена в ассоциации с факультативно-анаэробными микроорганизмами. Группа УПМ была представлена 4 родами: Staphylococcus, Enterococcus, Escherichia и Corynebacterium. Наиболее часто определялся эпидермальный стафилококк (39,4%). Значительно реже выделяли коринебактерии и энтерококки (12,7 и 8,4% соответственно). Кишечная палочка обнаружена в 4,2% случаев. Только у 10 (14,1%) беременных выделено по 2 вида УПМ. Сравнение видового спектра и частоты выделения УПМ среди пациенток с выраженной лейкоцитарной реакцией и минимальным количеством лейкоцитов не выявило достоверных различий. Степень обсемененности влагалищного содержимого факультативно-анаэробными микроорганизмами всегда была низкой и не превышала 104 КОЕ/мл. При этом количество лактобацилл превышало показатели обсемененности УПМ на 2–5 порядков.
Таким образом, при нормоценозе спектр УПМ факультативно-анаэробного происхождения был весьма ограничен, колонизация влагалища ими была низкой и выделяли их только на фоне абсолютного доминирования лактобацилл. При НЦ, сочетавшемся с выраженной лейкоцитарной реакцией, не выявлено заметного отличия в частоте выделения факультативных анаэробов, их видовом и количественном составе, также как не выявлено отличия в титре лактобацилл, в сравнении НЦ с минимальным количеством лейкоцитов.
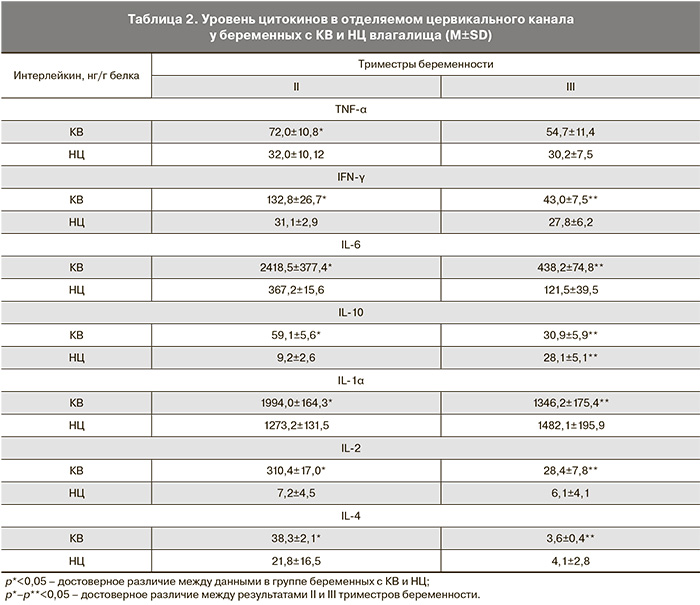
Для оценки локального воспалительного ответа были определены уровни цитокинов в отделяемом цервикального канала. Получены достоверные различия между результатами у беременных с КВ до проведения лечения и у женщин с НЦ влагалища. При этом уровни как про- так и противовоспалительных цитокинов в основной группе в 2 и более раз превышали аналогичные данные группы сравнения (табл. 2). Анализ изменений содержания цитокинов в цервикальной слизи в группе с НЦ влагалища показал, что практически все исследованные цитокины проявляют тенденцию к поддержанию постоянной концентрации на всем протяжении беременности (за исключением IL-10, уровень которого достоверно повышается в III триместре по сравнению с содержанием во II триместре) [12, 13, 15].
Детальный анализ динамики цитокинов по триместрам в основной группе беременных показал, что изменение содержания IFN-γ, IL-1α и IL-10 имеет следующую тенденцию: повышенное содержание в II триместре и снижение в III триместре (после лечения), приближающиеся к показателям при НЦ. Причем отмечается, что при достоверном снижении их концентрации после лечения средние значения содержания IFN-γ и IL-1α во II триместре беременности были более высокими по сравнению с группой с нормоценозом влагалища. Интересно отметить, что показатели содержания данных цитокинов в III триместре беременности в основной группе максимально приближены к значениям в группе сравнения.
Особенно активно в динамике беременности снижались уровни IL-6, IFN-γ, IL-2. В то же время обращает внимание достоверное повышение концентрации противовоспалительного цитокина IL-10 у здоровых женщин в поздние сроки беременности, что возможно обусловлено его супрессивным действием на воспалительный ответ перед родами у беременных с нормальной ванильной микрофлорой. Высокое содержание IL-10 при КВ во II триместре до проведения терапии, вероятно, связано ответной реакцией на активную продукцию провоспалительных цитокинов [16].
Результаты, полученные при определении IL-2 и IL-4 в цервикальной слизи при КВ, свидетельствуют о достоверном снижении содержания обоих цитокинов после лечения с сохранением минимальных концентраций к родам. Следует отметить, что из всех исследованных цитокинов особого внимания заслуживает характер изменения содержания IL-6. Динамика его при НЦ совпадает с динамикой при КВ, однако становится очевидным его повышенное содержание у беременных с КВ во II и III триместрах беременности.
В основной группе частота случаев с высокой концентрацией IL-6, составляющая 51,9%, с достоверностью ассоциировалась с высокой частотой низкой концентрации IL-10 (<47,9 нг/г), составляющей 68,5%. Такая же обратная взаимосвязь обнаруживалась при сравнении частоты высокой концентрации IL-10 и низкой концентрации IL-6, тогда как IL-4 не обладал подобной взаимосвязью. Обращает внимание, что все показатели уровня концентрации IL-6 и IL-10 находились вне пределов доверительных интервалов. Поскольку про- и противовоспалительные цитокины находятся в реципрокных взаимоотношениях, для установления корреляционной зависимости и ее степени был вычислен коэффициент парной корреляции Пирсона между уровнями IL-6 и IL-10. Его величина, составившая r=-0,858, выявила обратную сильную взаимосвязь в продукции этих цитокинов, тогда как между значениями концентрации IL-6 и IL-4, где r=-0,02, корреляция отсутствовала.
Учитывая, что цитокины являются короткоживущими молекулами, выброс которых обеспечивается активным синтезом, уровень мРНК соответствующего гена пропорционален количеству активного белка [12]. Это позволяет использовать определение уровня мРНК для опосредованной оценки локального цитокинового профиля. Так как определение цитокинов в отделяемом влагалища является достаточно трудоемким методом, перспективным представляется использование молекулярно-генетических методов для решения этой задачи, в связи с чем, в исследовании был также определен профиль экспрессии мРНК ряда генов цитокинов в группах во II триместре беременности (табл. 3).
Полученные результаты соответствовали данным, выявленным при непосредственной оценке уровня цитокинов до проведения лечения. Обращало на себя внимание статистически значимое повышение уровня экспрессии как провоспалительных цитокинов (IL-6, LIF), так и противовоспалительного цитокина IL-10.
Для терапии КВ в данном исследовании использовали местный препарат кетоконазол, который назначали в ванильных свечах (400 мг) по 1 свече в течение 5 дней. После окончания курса терапии у подавляющего большинства женщин (50–92,6%) отмечалось улучшение. Клинически оно выражалось в исчезновении выделений, гипюрами и отечности слизистой влагалища, чувства жжения и зуда. Микроскопия мазков, окрашенных по Грому, у данных пациенток показала отсутствие нитей мицелий и дрожжевых клеток, лейкоцитарная реакция была минимальной или умеренной. По данным микробиологического исследования у 44 из 50 (88,0%) женщин выделены лцактобациллы в большом (107–108 КОЕ/мл) и у 6 из 50 (12,0%) женщин умеренном (105–106 КОЕ/мл) количестве, рост УМП был у 7 (14,0%) пациенток в низком титре (102–103 КОЕ/мл).
Использование этиотропный терапии, в частности суппозиториев ливарол, способствует подавлению роста грибов рода Candida, ограничивает процессы эскалации за счет полиэтиленоксидной основы, что способствует разрешению симптомов воспаления, и, как следствие, нормализации показателей местного иммунитета. Полученные данные согласуются с результатами исследования О.И. Летяевой и О.А. Гризингер [17], которые использовали кетоконазол в комплексной терапии воспалительных заболеваний урогенитального тракта у женщин репродуктивного возраста, что привело к значимой клинической эффективности и восстановлению факторов противоинфекционный защиты.
В 7,4% случаях однократный курс терапии был неэффективен, женщины указывали на рецидивирующий характер течения КВ, с неоднократными приемом различных противогрибковым препаратов, в связи с чем пациенткам был рекомендован повторный курс лечения кетоконазолом. По данным микробиологической оценки состояния ванильного микроценоза было выявлено отсутствие нитей мицелий, только наличие дрожжевых клеток, слабовыраженная лейкоцитарная реакция, отмечен рост Candida albicans и Candida glabrata в умеренном количестве (105–107 КОЕ/мл). После завершения повторного курса терапии диагностировано клинико-лабораторное выздоровление.
В III триместре беременности при проведении контрольного исследования микробиоценоза влагалища у пациенток обеих групп был выявлен рецидив КВ в основной группе у 3 (5,6%) женщин, при этом по данным культурального исследования в 2 случая установлен рост Candida glabrata и в 1 случае – Candida albicans. Всем пациенткам проведена терапия ванильным кетоконазолом в течение 10 дней с положительным эффектом.
Заключение
Таким образом, в результате работы установлено, что местный иммунитет у беременных с КВ характеризуется достоверным повышением уровня про- и противовоспалительных цитокинов по отношению к их продукции у беременных с нормальным ванильным микроценозом во II триместре беременности. Следует отметить, что наиболее активно среди провоспалительных цитокинов возрастала концентрация IL-6. Корреляционный анализ выявил тесную отрицательную взаимосвязь между уровнями противовоспалительного цитокина IL-10 и провоспалительного цитокина IL-6, что, по-видимому, объясняет изменение содержания вышеуказанных цитокинов в III триместре. Увеличение содержания цитокинов, корректирующее с повышением экспрессии их мРНК, обосновывает необходимость назначения противовоспалительного лечения. Проведение этиотропный терапии кетоканазолом во II триместре приводит к снижению уровней про- и противовоспалительных цитокинов, приближающихся к показателям нормоценоза, что следует рассматривать как подтверждение эффективности проводимого лечения.



