Адекватная рецептивность эндометрия в значительной степени определяет успех имплантации эмбриона как в естественном цикле, так и в программе ЭКО. Результаты многочисленных исследований свидетельствуют о снижении рецептивности эндометрия у женщин с бесплодием и повторными неэффективными попытками ЭКО в анамнезе [1, 2].
Известно, что эффективность программы ЭКО во многом зависит от функциональной зрелости и готовности эндометрия к имплантации, а также от его синхронизации с развитием эмбриона. Эндометрий восприимчив для эмбриона только в течение ограниченного периода времени максимальной рецептивности – «окна имплантации», период которого составляет несколько дней – примерно с 20-го по 24-й день нормального менструального цикла, на 6–10-й день после пика ЛГ [3–6].
Поиску универсального маркера рецептивности, способного в полной мере отразить имплантационные свойства эндометрия, посвящено большое количество работ, однако клиническая интерпретация результатов этих исследований крайне ограничена [7].
Наиболее изученным маркером рецептивности эндометрия является лейкемия-ингибирующий фактор (LIF) – цитокин, который продуцируется эндометрием на протяжении всего менструального цикла, но значительный пик его экспрессии отмечается в «окно имплантации» и связан с периодом расцвета пиноподий – ультраструктурных маркеров рецептивности эндометрия. У человека LIF обнаружен практически во всех тканях и клетках репродуктивной системы [8–12]. LIF осуществляет свое действие за счет связывания с рецепторами: формирования гетеродимера с LIF-специфическим рецептором и с неспецифическим корецептором gp130, который также служит рецептором для цитокинов IL-6, IL-11, онкостатина М и др. [9, 12]. Дефекты продукции LIF приводят либо к нарушению имплантации бластоцисты, либо к неполноценной инвазии трофобласта, и как следствие – к прерыванию беременности на ранних сроках [8, 9, 12–14].
Экспрессию маркеров рецептивности эндометрия оценивают при иммуногистохимическом исследовании пайпель-биоптатов секреторного эндометрия. Однако несмотря на высокую информативность этот метод является инвазивным и применим только на этапе обследования женщины с бесплодием. Перспективным является поиск неинвазивных методов исследования паракринных регуляторов имплантации в цервикальной слизи (ЦС), являющейся продуктом секреции желез эндоцервикса и эндометрия, для оценки рецептивности эндометрия.
Цель исследования – оценить рецептивность эндометрия у пациенток с бесплодием на основании определения концентрации LIF и его рецептора (LIF-R) в ЦС и сопоставления с их иммуногистохимической экспрессией в ткани эндометрия.
Материал и методы исследования
 В исследование были включены 60 пациенток в возрасте от 26 до 38 лет с трубно-перитонеальным фактором бесплодия, имеющие более 2 неудачных программ ЭКО в анамнезе (основная группа), и 20 здоровых фертильных женщин аналогичного возраста (группа контроля). В обеих группах женщин оценивали концентрации LIF и LIF-R в ЦС и иммуногистохимическую экспрессию этих маркеров в пайпель-биоптате эндометрия. Пробы ЦС брали при помощи урогенитального велюр-зонда (Copan, Италия) в лютеиновую фазу менструального цикла в дни, определяемые по мочевому тесту на овуляцию (на 3-й, 5-й, 7-й и 9-й день после пика ЛГ). Концентрацию LIF и LIF-R в ЦС определяли методом иммуноферментного анализа с набором тест-систем фирмы Bender Medsystems (cotol. №242, США). Биопсию эндометрия выполняли под ультразвуковым контролем из области дна матки с помощью аспирационной кюретки Pipelle de Cornier (Laboratoire C.C.D., Франция). Проводили морфологическое и иммуногистохимическое исследования соскоба. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 ч. Образцы обработаны по общепринятой стандартной методике и заключены в парафин. Готовили срезы толщиной 4 мкм, помещали их на адгезивные предметные стекла, депарафинировали и по одному стеклу от каждого случая окрашивали гемотоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от 50 до 1000. Проводили гистологическое датирование эндометрия, оценку процента клеток поверхностного эпителия с наличием зрелых пиноподий в световом микроскопе при увеличении 400 в 5 полях зрения. Иммуногистохимические реакции проводили на депарафинированных срезах толщиной 4 мкм по общепринятым протоколам (DAKO protocols). Для выявления экспрессии LIF и LIF-R использовали первичные антитела к LIF и LIF-R (R&D Systems, USA, 1:100).
В исследование были включены 60 пациенток в возрасте от 26 до 38 лет с трубно-перитонеальным фактором бесплодия, имеющие более 2 неудачных программ ЭКО в анамнезе (основная группа), и 20 здоровых фертильных женщин аналогичного возраста (группа контроля). В обеих группах женщин оценивали концентрации LIF и LIF-R в ЦС и иммуногистохимическую экспрессию этих маркеров в пайпель-биоптате эндометрия. Пробы ЦС брали при помощи урогенитального велюр-зонда (Copan, Италия) в лютеиновую фазу менструального цикла в дни, определяемые по мочевому тесту на овуляцию (на 3-й, 5-й, 7-й и 9-й день после пика ЛГ). Концентрацию LIF и LIF-R в ЦС определяли методом иммуноферментного анализа с набором тест-систем фирмы Bender Medsystems (cotol. №242, США). Биопсию эндометрия выполняли под ультразвуковым контролем из области дна матки с помощью аспирационной кюретки Pipelle de Cornier (Laboratoire C.C.D., Франция). Проводили морфологическое и иммуногистохимическое исследования соскоба. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 ч. Образцы обработаны по общепринятой стандартной методике и заключены в парафин. Готовили срезы толщиной 4 мкм, помещали их на адгезивные предметные стекла, депарафинировали и по одному стеклу от каждого случая окрашивали гемотоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от 50 до 1000. Проводили гистологическое датирование эндометрия, оценку процента клеток поверхностного эпителия с наличием зрелых пиноподий в световом микроскопе при увеличении 400 в 5 полях зрения. Иммуногистохимические реакции проводили на депарафинированных срезах толщиной 4 мкм по общепринятым протоколам (DAKO protocols). Для выявления экспрессии LIF и LIF-R использовали первичные антитела к LIF и LIF-R (R&D Systems, USA, 1:100).
Результаты иммуногистохимических реакций для LIF оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (–) – 0 баллов; менее 5% иммуноокрашенных клеток (±) – 0, 5 балла; менее 20% иммуноокрашенных клеток (+) – 2 балла; от 20 до 40% окрашенных клеток (++) – 4 балла; более 40% окрашенных клеток (+++) – 6 баллов. По результатам исследования проводили статистический анализ с использованием метода дисперсионного анализа ANOVA (для нескольких групп), t-критерия Стьюдента и по методу Манна–Уитни. Связь между показателями оценивали по коэффициенту корреляции Пирсона (r).
Результаты исследования
Большинство пациенток с трубно-перитонеальным бесплодием были в возрасте от 25 до 38 лет. Длительность бесплодия в среднем составила 4,7±2,9 года, преобладало вторичное бесплодие. У 65% пациенток основной группы в анамнезе имели место 2 неудачные попытки ЭКО, у 25% женщин – 3 попытки и у 10% – 4 и более неудачных циклов ЭКО. Фертильные женщины контрольной группы были аналогичного возраста.
Концентрации LIF в ЦС у пациенток c бесплодием и женщин контрольной группы в естественном цикле представлены в табл. 1.
Концентрация LIF в ЦС у пациенток основной группы была достоверно ниже, чем в группе контроля на 3-й и на 7-й день после пика ЛГ (4,9±3,4 пг/мл и 7,3±2,8 пг/мл и 27,2±9,6 пг/мл и 32,2±7,3 пг/мл, р<0,05, соответственно). На 5-й и 9-й день после пика ЛГ концентрация LIF в ЦС в основной группе была ниже, чем в контрольной, но различия были недостоверны (16,4±6,1 пг/мл и 20,1±4,3 пг/мл и 14,1±8,7 пг/мл и 18,0±7,6 пг/мл, соответственно, р>0,05).
Концентрации LIF-R в ЦС у пациенток c бесплодием и женщин контрольной группы в естественном цикле представлены в табл. 2.
Концентрация LIF-R в ЦС в основной группе была также достоверно ниже, чем в контрольной на 5-й (113,0±37,4 пг/мл и 156,0±18,7 пг/мл, р<0,05), 7-й (174,2±42,4 пг/мл и 210,0±6,7 пг/мл, р<0,05) и на 9-й день после пика ЛГ (52,0±10,6 пг/мл и 98,1±25, 3 пг/мл, р<0,05). На 3-й день после пика ЛГ в основной группе концентрация LIF-R была ниже, чем в контрольной, но различия оказались не достоверными (74,0±47,6 пг/мл и 108, 0±7,4 пг/мл, р>0,05).
 Анализ морфологической структуры эндометрия показал, что в «окно имплантации» у всех пациенток наблюдалась секреторная трансформация эндометрия. При этом ранняя стадия фазы секреции обнаружена у 24 (40%), средняя стадия фазы секреции – у 27 (45%) и поздняя стадия фазы секреции – у 9 (15%) пациенток основной группы, тогда как в группе контроля превалировал эндометрий средней стадии секреции – 16(80%) (табл. 3).
Анализ морфологической структуры эндометрия показал, что в «окно имплантации» у всех пациенток наблюдалась секреторная трансформация эндометрия. При этом ранняя стадия фазы секреции обнаружена у 24 (40%), средняя стадия фазы секреции – у 27 (45%) и поздняя стадия фазы секреции – у 9 (15%) пациенток основной группы, тогда как в группе контроля превалировал эндометрий средней стадии секреции – 16(80%) (табл. 3).
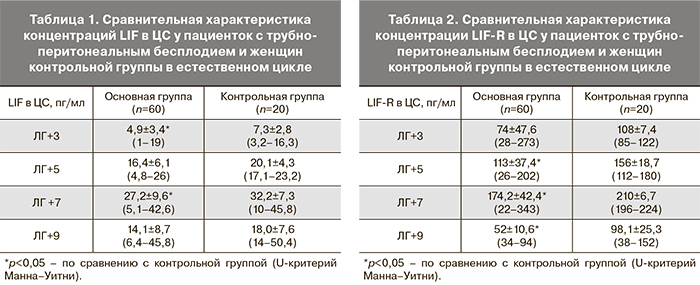
Результаты иммуногистохимического исследования эндометрия показали, что в основной группе преобладали пациентки с количеством зрелых пиноподий менее 20% в поверхностном эпителии эндометрия (45%). В контрольной группе зрелые пиноподии выявлялись более, чем на 40% поверхностного эпителия эндометрия у подавляющего большинства женщин (рис. 1).
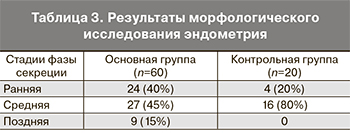
Результаты сравнительной оценки экспрессии LIF и LIF-R в эндометрии пациенток обеих групп показали снижение среднего уровня экспрессии LIF (4,4±0,2 балла и 6,0±0,1 балла, р<0,05) (рис. 2) и LIF-R (4,2±0,4 балла и 6,0±0,2 балла, р<0,05) (рис. 3) в основной группе по сравнению с контрольной группой.
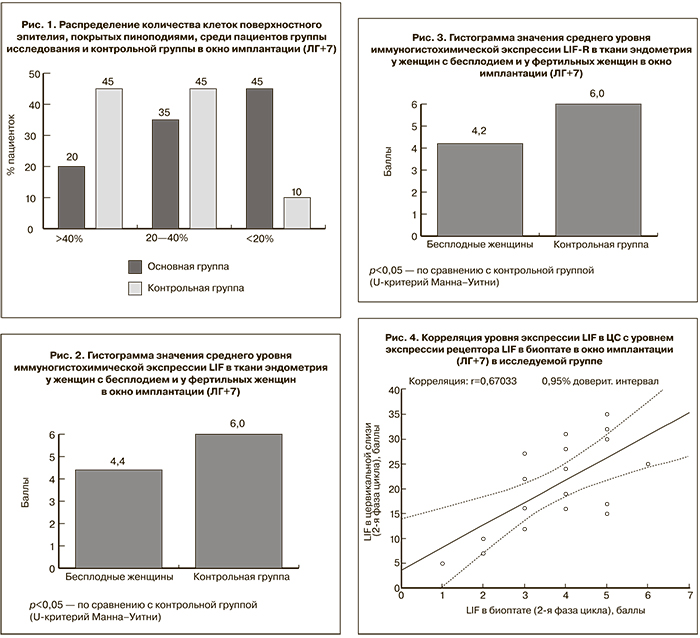
При оценке корреляционной связи концентрации LIF в ЦС с уровнем экспрессии LIF в биоптате в окно имплантации в основной группе и контрольной группах была отмечена прямая умеренная корреляционная связь (коэффициент корреляции r=0,67) (рис. 4).
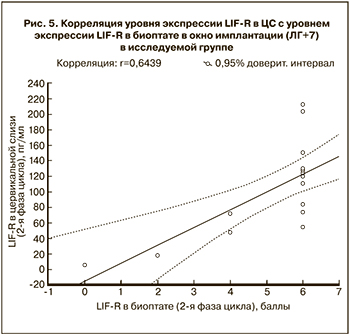
Аналогичная связь выявлена между концентрацией LIF-R в ЦС и уровнем его экспрессии в эндометрии (r=0,64) (рис. 5).
Обсуждение результатов
Успешная имплантация предполагает наличие синхронного взаимодействия бластоцисты и эндометрия. Готовность эндометрия к имплантации, или его рецептивность, развивается у фертильных женщин лишь в «окно имплантации» – среднюю фазу секреции менструального цикла. Нарушение рецептивности эндометрия характерно для женщин с бесплодием и является одной из наиболее частых причин повторных неудач программ ЭКО при наличии нормальной бластоцисты. Оценку рецептивности эндометрия в рутинной практике принято проводить только инвазивным способом при иммуногистохимическом исследовании ткани секреторного эндометрия на этапе обследования пациентки. Необходимость поиска быстрого, точного и неинвазивного метода оценки рецептивности эндометрия не вызывает сомнений [7]. Предпринимаются попытки исследования паракринных регуляторов имплантации в ЦС для оценки рецептивности эндометрия [13].
В работе проведена оценка рецептивности эндометрия у 60 пациенток с трубно-перитонеальным бесплодием и у 20 здоровых фертильных женщин на основании определения концентрации LIF и LIF-R в ЦС и сопоставления с их иммуногистохимической экспрессией в пайпель – биоптате эндометрия в «окно имплантации».
Результаты исследования показали нарушение имплантационного потенциала эндометрия у женщин с бесплодием и повторными неудачными попытками программ ЭКО, о чем свидетельствует достоверное снижение LIF в ЦС у пациенток с бесплодием по сравнению с фертильными женщинами на 3-й и на 7-й день после пика ЛГ, а также снижение концентрации LIF-R в ЦС в основной группе по сравнению с контролем на 5-й, 7-й и 9-й день после пика ЛГ (р<0,05). Эти данные согласуются с результатами исследований L. Aghajanova и соавт. (2008, 2010) и подтверждают высокую диагностическую ценность оценки экспрессии LIF в определении имплантационных свойств эндометрия [8, 9].
В результате морфологического исследования эндометрия также выявлено снижение рецептивности у пациенток с бесплодием и повторными неудачами ЭКО, что проявлялось обнаружением у 45% пациенток основной группы эндометрия ранней стадии секреции, а также низким процентом зрелых пиноподий на поверхностном эпителии слизистой тела матки. В основной группе эндометрий соответствовал средней стадии секреции лишь у 40% женщин, а у фертильных женщин – у подавляющего большинства (в 80% случаев). Количество зрелых пиноподий в поверхностном эпителии эндометрия (<20%) у большинства пациенток с бесплодием встречалось намного реже, чем в контрольной группе, где у подавляющего большинства женщин зрелые пиноподии выявлялись более, чем на 40% поверхностного эпителия эндометрия. В исследовании, проведенном G. Nikas и соавт. (2002), также было выявлено снижение количества зрелых пиноподий у пациенток с нарушением имплантации в анамнезе [15].
В работе было отмечено снижение иммуногистохимической экспрессии LIF во всех рассматриваемых гистологических структурах эндометрия у бесплодных женщин, что свидетельствует о нарушении рецептивности эндометрия и отражает нарушение его имплантационных свойств. При оценке корреляционной связи концентрации LIF в ЦС с уровнем его экспрессии в биоптате эндометрия в окно имплантации в основной группе и контрольной группах была отмечена прямая умеренная корреляционная связь (r=0,67). Аналогичная корреляционная связь между концентрацией LIF в ЦС и биоптате эндометрия (r=0,68) выявлена М.М. Левиашвили и соавт. [16]. Полученные данные, подтверждает высокую диагностическую ценность исследования экспрессии LIF в ЦС для оценки имплантационного потенциала эндометрия.
Результаты исследования показали, что концентрация LIF-R в ЦС в основной группе была также достоверно ниже, чем в контрольной на 5-й, 7-й 9-й день после пика ЛГ (р<0,05). Низкий уровень экспрессии LIF-R по сравнению контрольной группой выявлен в ткани эндометрия (р<0,05) . При оценке корреляционной связи уровня экспрессии рецептора LIF-R в ЦС с уровнем экспрессии LIF-R в биоптате эндометрия в «окно имплантации» у женщин с бесплодием была отмечена прямая умеренная корреляционная связь (r=0,64).
В работе M. Tawfeek и соавт. (2012) наблюдалось снижении экспрессии LIF-R в эндометрии у бесплодных женщин и доказана информативность использования LIF-R в качестве молекулярного маркера рецептивности эндометрия [17].
Заключение
Таким образом, у женщин с трубно-перитонеальным фактором бесплодия и повторными неудачными попытками ЭКО в анамнезе снижена концентрация LIF и LIF-R в ЦС, а также их иммуногистохимическая экспрессия в эндометрии. Выявлена прямая корреляционная связь между концентрацией маркеров в слизи и их экспрессией в эндометрии. Полученные данные свидетельствуют о том, что определение концентрации LIF и LIF-R в ЦС возможно использовать в качестве неинвазивного метода оценки имплантационного потенциала эндометрия.



