Приблизительно с 37 лет в организме женщины начинается процесс старения репродуктивной системы – прогрессирующее, необратимое угнетение биологических функций, сопровождающееся снижением фертильности. Этот инволюционный процесс доминирует в период менопаузального перехода и у значительной части женщин становится причиной приливов жара и ночной потливости, значительно снижающих качество жизни и вынуждающих обращаться за медицинской помощью [1–4]. Помимо типичных вазомоторных проявлений климактерического синдрома, женщин беспокоят разнообразные психосоматические симптомы: раздражительность, вялость, утомляемость, депрессия, головные боли, нарушение памяти, прибавка в весе, бессонница, суставные боли, сердцебиение, истерические припадки, дизурия, снижение либидо. Симптомы климактерического синдрома могут сохраняться более 15 лет после наступления менопаузы, а по мере старения женщины к ним присоединяются и поздние менопаузальные расстройства.
 Нейровегетативные проявления климактерических расстройств являются первыми и в наибольшей степени нарушающими качество жизни симптомами менопаузальных гормональных изменений. Патофизиология этих симптомов до конца не изучена. Происхождение вазомоторных жалоб (приливы жара и ночная потливость) связывают с периодическим или постоянным дефицитом эстрогенов, влияющим на способность центра терморегуляции стареющего гипоталамуса поддерживать температуру тела в нормальном диапазоне. У женщин с приливами жара границы терморегуляторной зоны сужены [5], и при этом даже незначительный выход температуры за верхний или нижний пределы данного диапазона приводит к развитию, соответственно, прилива или озноба. Большую роль в дезадаптации терморегуляции играет старение гипоталамуса, сопряженное со снижением его пластичности и нарушением обмена нейромедиаторов. В частности, с сужением терморегуляторной зоны связывают повышение содержания норадреналина и снижение серотонина в головном мозгу, но совершенно очевидно, что альтерации уровней нейрогормонов оказывают разнонаправленное действие, приводя к развитию множественных вегетативных, психических и поведенческих симптомов.
Нейровегетативные проявления климактерических расстройств являются первыми и в наибольшей степени нарушающими качество жизни симптомами менопаузальных гормональных изменений. Патофизиология этих симптомов до конца не изучена. Происхождение вазомоторных жалоб (приливы жара и ночная потливость) связывают с периодическим или постоянным дефицитом эстрогенов, влияющим на способность центра терморегуляции стареющего гипоталамуса поддерживать температуру тела в нормальном диапазоне. У женщин с приливами жара границы терморегуляторной зоны сужены [5], и при этом даже незначительный выход температуры за верхний или нижний пределы данного диапазона приводит к развитию, соответственно, прилива или озноба. Большую роль в дезадаптации терморегуляции играет старение гипоталамуса, сопряженное со снижением его пластичности и нарушением обмена нейромедиаторов. В частности, с сужением терморегуляторной зоны связывают повышение содержания норадреналина и снижение серотонина в головном мозгу, но совершенно очевидно, что альтерации уровней нейрогормонов оказывают разнонаправленное действие, приводя к развитию множественных вегетативных, психических и поведенческих симптомов.
Нет никаких сомнений, что восполнение дефицита эстрогенов является обоснованным методом лечения климактерических расстройств. Однако существование разнообразных механизмов формирования менопаузальных симптомов позволяет искать альтернативные пути улучшения качества жизни у женщин, которые не могут или, по разным причинам, не желают принимать гормональные препараты.
Изофлавоны сои широко используются в качестве альтерантивного метода лечения климактерических симптомов. Гормоноподобная активность изофлавонов описывается как селективная модуляция эстрогеновых рецепторов, объясняемая разным сродством биологически активных веществ к двум подтипам рецепторов эстрогенов (РЭ). Если афинность эстрадиола к РЭ принять за 100%, то афинность генистеина, наиболее сильного изофлавона, к РЭα составит 5%, к РЭβ – 36%, то есть в отношении РЭβ генистеин проявляет активность, сравнимую с активностью эстрона. Это делает фитоэстрогены безопасными с точки зрения избыточной пролиферации и предполагает возможность их длительного применения без прогестагенного прикрытия: низкое сродство к РЭα не позволяет фитоэстрогенам осуществить ростовые функции. Кроме того, связываясь с РЭ, фитоэстрогены блокируют взаимодействие с рецептором эндогенного эстрадиола, поэтому, будучи намного слабее эстрадиола, фитоэстрогены оказывают антиэстрогенное или эстрогенное действие в условиях, соответственно, высокой или низкой эстрогенной насыщенности, и что также позволяет относить их к разряду природных селективных модуляторов РЭ [6].
 В своей нативной форме гликозидов – соединений с сахарами – изофлавоны биологически инертны, и становятся активными только после гидролиза под действием микрофлоры кишечника и образования несахаристого компонента, так называемого агликона, обладающего эстрогенными эффектами, следовательно, зависят от состояния кишечного микроценоза. Этот факт, так же как и большие разбросы содержания изофлавонов в различных биологически активных добавках (БАД) и растительных экстрактах становится причиной противоречивых результатов клинических исследований, посвященных эффективности лечения климактерических расстройств с помощью фитоэстрогенов [7]. Синтетический генистеин, применяемый в активной форме в виде агликона в достаточной суточной дозе, может иметь преимущества перед другими видами средств, которые назначаются как альтернатива гормонам при лечении климактерических расстройств.
В своей нативной форме гликозидов – соединений с сахарами – изофлавоны биологически инертны, и становятся активными только после гидролиза под действием микрофлоры кишечника и образования несахаристого компонента, так называемого агликона, обладающего эстрогенными эффектами, следовательно, зависят от состояния кишечного микроценоза. Этот факт, так же как и большие разбросы содержания изофлавонов в различных биологически активных добавках (БАД) и растительных экстрактах становится причиной противоречивых результатов клинических исследований, посвященных эффективности лечения климактерических расстройств с помощью фитоэстрогенов [7]. Синтетический генистеин, применяемый в активной форме в виде агликона в достаточной суточной дозе, может иметь преимущества перед другими видами средств, которые назначаются как альтернатива гормонам при лечении климактерических расстройств.
Целью настоящего исследования стала оценка эффективности и безопасности синтезированного в активной форме генистеина в лечении климактерических симптомов у женщин в пери- и постменопаузе.
Материал и методы исследования
В исследование были включены 23 женщины в возрасте от 48 до 63 лет (средний возраст 55,3±3,9 года), предъявляющие жалобы на приливы жара, ночную потливость и другие симптомы климактерического синдрома.
Критериями включения в исследование были: возраст от 45 до 65 лет; статус репродуктивной системы, определенный как поздняя фаза менопаузального перехода («пропущенные» циклы) или постменопауза; диагностированный климактерический синдром; информированное согласие на участие в исследовании.
Критериями исключения из исследования были: регулярный менструальный ритм; длительность постменопаузы более 10 лет; аномальные маточные кровотечения; применение гормональных препаратов в 3-месячный период до включения в исследование; наличие заболеваний/состояний, требующих назначения гормональной, психотропной или другой терапии, влияющей на вегетативную нервную систему; хирургическое вмешательство, планируемое в период проведения исследования; тяжелые заболевания печени с нарушениями ее функции; подозреваемые онкологические заболевания.
Все женщины, включенные в исследование, интервьюировались с использованием русскоязычного опросника Medical Outcomes Study Short Form (MOS SF-36) для оценки качества жизни.
Наличие и выраженность вегетативных расстройств оценивались по опроснику для выявления вегетативных изменений, где количество баллов более 15 подразумевало наличие вегетативной дисфункции, и схеме исследования для выявления признаков вегетативных нарушений, где количество баллов более 25 подразумевало наличие вегетативной дисфункции.
В процессе опроса уточнялось число приливов в течение суток. Все проявления климактерического синдрома подразделялись на группы нейровегетативных, метаболических и психоэмоциональных симптомов и оценивались в баллах. Тяжесть климактерического синдрома оценивалась согласно модифицированному менопаузальному индексу (ММИ) (таблица).
Перед началом исследования проводился общий физикальный осмотр с определением индекса массы тела (ИМТ) и окружности талии (ОТ), гинекологический осмотр с проведением цитологического исследования мазков шейки матки. Проводились также общеклинические анализы крови и мочи. В биохимическом анализе крови определяли уровни аланинтрансферазы (АЛТ), аспартаттрансферазы (АСТ), щелочной фосфатазы, γ-глутамилтранспептидазы (ГГТ), общего билирубина, прямого билирубина, непрямого билирубина. Лабораторно-инструментальное обследование включало ультразвуковое исследование (УЗИ) органов малого таза, органов брюшной полости и молочных желез, маммографию. Все женщины подписали информированное согласие на участие в исследовании. После проведения обследования при соответствии критериям включения и отсутствии критериев исключения женщинам рекомендовался прием генистеина, синтезированного в активной форме (менорил), в суточной дозе 60 мг в течение
6 месяцев. Исходно, через 3 и 6 месяцев лечения проводилось анкетирование и обследование с проведением общего физикального и гинекологического осмотра, общеклинических тестов и биохимического анализа крови, УЗИ органов малого таза, брюшной полости и молочных желез.
Статистическая обработка результатов производилась в соответствии с общепринятыми методами медицинской статистики с использованием современных программ Statistica 6.0 и SPSS, Microsoft Excel 7 для Windows 98, Biostat. Данные описательной статистики представлены в виде средних значений и их стандартных отклонений, качественные – в виде абсолютных и относительных частот. Показатели опросника MOS SF-36 оценивались по результатам шкалирования с использованием специальных кодов и ключей. Обработка полученных показателей проводилась с оценкой среднего значения показателей (М), средней величины квадратичного отклонения (Е), показателя средней ошибки (m), критерия Стьюдента (t) для средних величин, вероятности ошибки (Р). Сравнение изменений количественных показателей осуществлялось по критериям Вилкоксона (для двух временных точек). Различие между сравниваемыми величинами признавалось достоверным при р<0,05 (95% уровень достоверности).
 Результаты исследования
Результаты исследования
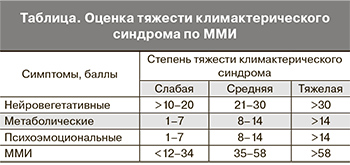
На основании подсчета ММИ у обследованных женщин тяжелый климактерический синдром был диагностирован в 2 (8,7%), умеренной тяжести – в 12 (52,2%), легкий – в 9 (39,1%) наблюдениях. Среднее число приливов в течение суток исходно составило 9,2±1,2, среднее значение ММИ – 37,4±7,2 балла. Синдром вегетативной дисфункции при объективной оценке был установлен у 17 (73,9%) пациенток, среднее значение уровня вегетативных расстройств составило 41,4±9,3 балла. Результаты анализа анкеты SF-36 позволили установить, что 4 (17,4%) женщины, несмотря на наличие климактерических жалоб, считали свое самочувствие хорошим или очень хорошим, тогда как 19 (82,6%) расценивали его как посредственное или плохое. У большинства женщин (60,9%) соматическое неблагополучие влияло на социальную активность и снижало работоспособность (рис. 1).
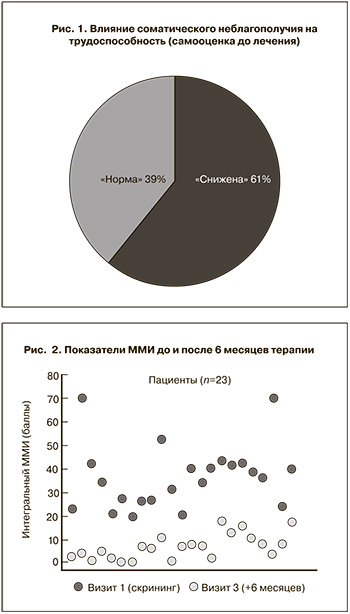
На фоне применения генистеина, синтезированного в активной форме (менорила), в суточной дозе 60 мг отмечались положительная динамика течения климактерического синдрома, в результате чего к моменту окончания исследования легкая степень климактерического синдрома по уровню ММИ сохранилась у 4 (17,4%) больных, исходно имевших климактерический синдром умеренной степени тяжести. У 19 (82,6%) женщин сумма баллов менопаузальных симптомов к концу лечения не превышала 11 (рис. 2). Вазомоторные симптомы демонстрировали наиболее быструю регрессию по сравнению с другими проявлениями климактерического синдрома. Через 3 месяца среднее число приливов снизилось на 57,6% с 9,2±1,2 до 3,9±1,6 и стабилизировалось на том же уровне (3,7±1,5) через 6 месяцев лечения при отмеченном уменьшении их интенсивности. Снижение числа приливов через 3 и 6 месяцев лечения по сравнению с исходным уровнем было достоверным (р<0,005). Средний балл ММИ снижался постепенно, составив 22,3±2,8 через 3 месяца и 6,97±2,4 через 6 месяцев. Редукция ММИ через 3 и 6 месяцев по сравнению с исходным значением была достоверной (р<0,0005). В целом, ММИ снизился на 81% исходного значения после 6 месяцев терапии.
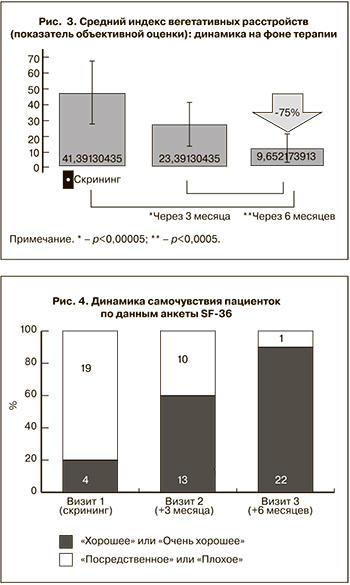
Отмечалась также выраженная положительная динамика состояния вегетативной нервной системы. После окончания терапии число баллов, отмеченных при самостоятельном заполнении опросников женщинами, не достигло 15, а число баллов, подсчитанных врачом при объективной оценке признаков вегетативной дисфункции, не достигло 25 ни в одном наблюдении. Средний индекс вегетативных расстройств снизился с 41,4±9,3 до 23,4±6,4 балла через 3 месяца и 9,7±4,3 балла через 6 месяцев, то есть редукция его к окончанию терапии составила 75% при высокой достоверности разницы по сравнению с исходным уровнем (р<0,00005) (рис. 3).
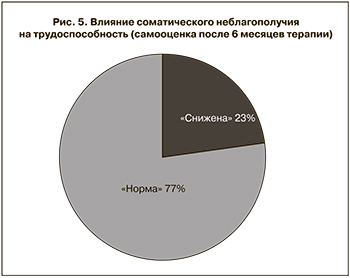
Анализ опросников SF-36 в процессе проведения исследования и после его окончания продемонстрировала положительное влияние генистеина в активной форме (менорила) на основные показатели качества жизни. Через 3 месяца 9 (39,1%) женщин поменяли оценку своего самочувствия с «посредственное/плохое» на «хорошее/очень хорошее» (рис. 4). После 6 месяцев приема менорила только 1 пациентка осталась недовольна своим самочувствием, тогда как 22 (95,7%) оценили самочувствие как «хорошее» или «очень хорошее» и выразили желание продолжить прием препарата. Среди этих 22 пациенток снижение трудоспособности из-за соматического неблагополучия сохранилось у 5 (23%) женщин (рис. 5). Такое расхождение в оценке своего самочувствия и влияния соматического неблагополучия на трудоспособность может быть связано с наличием иных, не ассоциированных с климаксом, нарушений здоровья. Хронические соматические заболевания, течение которых не зависит от наличия климактерических симптомов и в то же время может повлиять на трудоспособность, были отмечены у 13 (56,5%) женщин.
Таким образом, эффективность применения генистеина, синтезированного в активной форме, (менорила) субъективно была оценена как высокая, что подтверждалось объективной оценкой динамики ММИ и индекса вегетативной дисфункции.
За время наблюдения на фоне применения активного генистеина (менорила) мы не отметили серьезных нежелательных явлений, переносимость терапии была хорошей, комплаентность высокой. Существенного изменения ИМТ и ОТ за 6 месяцев не наблюдалось, несмотря на наличие тенденции к повышению массы тела в среднем на 1,2 кг. Для оценки безопасности синтетического генистеина мы проводили общеклинические тесты и биохимические исследования крови. Как на этапе скрининга, так и в конце приема генистеина (менорила) показатели этих тестов не выходили за пределы лабораторных норм. Достоверных изменений в уровне АЛТ, АСТ, щелочной фосфатазы, ГГТ, общего билирубина, прямого билирубина, непрямого билирубина выявлено не было.
Также не отмечалось существенных изменений в толщине эндометрия, измеренной перед исследованием и по его окончании. Средний показатель величины М-эха составил 3,19±0,23 мм до приема генистеина и 3,30±0,35 в конце курса терапии менорилом. Не было выявлено существенных изменений размеров матки, как и динамики структурных изменений миометрия у женщин с ранее диагностированной миомой матки. При исследовании состояния молочных желез по данным УЗИ у 11 (47,8%) отмечалась тенденция к регрессивным процессам, у 12 (52,5%) динамики состояния молочных желез не отмечено. При УЗИ органов брюшной полости также не было выявлено отрицательной динамики в состоянии печени и желчевыводящих путей.
Обсуждение
 Однозначного мнения об эффективности фитоэстрогенов в лечении климактерических расстройств нет. Накопившиеся на сегодняшний день исследования дают противоречивые результаты, хотя эти противоречия отчасти объяснимы. Изучение эффективности пищевых соевых продуктов не подразумевает отслеживания получаемой дозы изофлавонов, и испытуемые обычно употребляли их в произвольном количестве, чаще всего не обеспечивающим поступление 50 мг изофлавонов, то есть не достаточном для облегчения приливов [8]. Следует также принимать во внимание возможные отличия в действии самих фитоэстрогенов. Например, в одном из исследований, включавшем многочисленные препараты, эффективность изофлавонов красного клевера не превысила действие плацебо [9]. Исследование, оценившее эффективность консультирования женщин по увеличению потребления соевых продуктов, не выявило положительного результата с позиций облегчения приливов [8]. Сравнение эффективности оральных эстрогенов, экстракта сои и экстракта красного клевера продемонстрировало наибольшее сокращение числа приливов при использовании гормональной терапии, прием экстракта сои уменьшал число приливов в сутки в среднем на 1,15 эпизода меньше, чем эстрогены, а экстракт красного клевера – на 2,6 эпизода меньше, чем эстрогены [10].
Однозначного мнения об эффективности фитоэстрогенов в лечении климактерических расстройств нет. Накопившиеся на сегодняшний день исследования дают противоречивые результаты, хотя эти противоречия отчасти объяснимы. Изучение эффективности пищевых соевых продуктов не подразумевает отслеживания получаемой дозы изофлавонов, и испытуемые обычно употребляли их в произвольном количестве, чаще всего не обеспечивающим поступление 50 мг изофлавонов, то есть не достаточном для облегчения приливов [8]. Следует также принимать во внимание возможные отличия в действии самих фитоэстрогенов. Например, в одном из исследований, включавшем многочисленные препараты, эффективность изофлавонов красного клевера не превысила действие плацебо [9]. Исследование, оценившее эффективность консультирования женщин по увеличению потребления соевых продуктов, не выявило положительного результата с позиций облегчения приливов [8]. Сравнение эффективности оральных эстрогенов, экстракта сои и экстракта красного клевера продемонстрировало наибольшее сокращение числа приливов при использовании гормональной терапии, прием экстракта сои уменьшал число приливов в сутки в среднем на 1,15 эпизода меньше, чем эстрогены, а экстракт красного клевера – на 2,6 эпизода меньше, чем эстрогены [10].
Наши результаты, хотя и не были получены в сравнительном исследовании, сопоставимы с приведенными данными. Число приливов достоверно сокращалось на фоне использовании генистеина синтезированного в активной форме (менорила), но полного их купирования не происходило, в то время как применение эстрогенов обычно сопровождается практически полным исчезновением приливов в течение полугода терапии. Но анализ сравнительных исследований позволяет предположить, что изофлавоны сои отличаются наилучшим лечебным профилем среди всех фитоэстрогенов. Это подтверждает недавний мета-анализ, продемонстрировавший достоверно большую эффективность экстрактов сои и синтетических изофлавонов по сравнению с плацебо [11], причем различия по частоте приливов составили 20,6%, а тяжести приливов – 26,2%.
Среди изофлавонов сои также существуют свои лидеры. Данные систематического обзора [7] показали, что пищевые добавки, содержащие изофлавоны с преимущественным присутствием генистеина, более эффективны в облегчении приливов жара, чем продукты с низким содержанием генистеина. Прицельная оценка эффективности генистеина отдельно от других изофлавонов продемонстрировала его способность значительно уменьшать приливы жара [12–14]. Эффективность синтетического генистеина 30 мг/сут оценивалась в рандомизированном плацебо-контролируемом исследовании (РПКИ) [15], общая продолжительность которого составила 12 недель. Анализ результатов исследования показал, что у женщин, получавших генистеин, снижение частоты приливов за сутки было более выраженным, чем у женщин, получавших плацебо: от 9,4 до 4,7 (генистеин), от 9,9 до 7,1 (плацебо). У женщин из группы лечения генистеином, завершивших 12-недельное лечение в период исследования, частота приливов снизилась в среднем на 51%, что статистически значимо отличалось от снижения частоты приливов на 30% в группе плацебо. Эти данные сопоставимы с нашими наблюдениями, согласно которым снижение частоты приливов через 3 месяца составило 57,6%. Зависимость результатов лечения от дозы может объяснить более выраженное действие 60 мг генистеина в нашем исследовании по сравнению с 30 мг дозы, примененной в цитируемом РПКИ. Также следует принимать во внимание длительность лечения. В наибольшей степени наши результаты оказались сопоставимы с результатами крупного РПКИ [12], изучавшего эффективность генистеина в дозе 54 мг/сут на протяжении 12 месяцев. Редукция частоты приливов в группе исследования составила 56,4% и была более значимой у пациенток, получавших генистеин, достоверно превышая таковую в группе плацебо на 22% через 3 месяца, 29% через 6 месяцев и 24% через 12 месяцев.
Синтезированный в активной форме генистеин – единственное средство из фитоэстрогенов, имеющее доказательную базу длительного (до 24 месяцев) эффективного применения у женщин в периоде менопаузального перехода и постменопаузе. Безопасность генистеина также оценивалась в долговременных исследованиях. В результате этих испытаний не было обнаружено различий по частоте нежелательных явлений между группой лечения генистеином в суточной дозе 30 мг и группой плацебо [15]. Также не были выявлены различия между группами по результатам лабораторных анализов биохимических параметров, функциональных печеночных проб, гематологических показателей, концентраций фолликулостимулирующего гормона и 17β-эстрадиола, и по толщине эндометрия при сонографической оценке. Наш опыт применения генистеина, синтезированного в активной форме (менорила), в течение 6 месяцев полностью подтверждает данные, полученные другими авторами.
Безопасность генистеина в дозировке 54 мг/сут оценивалась в исследованиях длительностью от одного до трех лет, проведенных среди женщин в постменопаузе [12, 14, 16]. В этих исследованиях было показано отсутствие различий между группой лечения генистеином и группой плацебо по частоте и спектру нежелательных явлений, а также отсутствие влияния генистеина на конечные точки безопасности, включавшие плотность ткани молочной железы, толщину эндометрия, состояние влагалищного эпителия и функцию щитовидной железы. Результаты приведенных работ указывают на отсутствие гиперплазии эндометрия и на снижение частоты обмена сестринских хроматид, что является дополнительным обоснованием безопасности и, вероятно, снижения риска рака эндометрия на фоне применения синтезированного агликона генистеина. Таким образом, длительное применение генистеина может рассматриваться как надежный и безопасный способ коррекции менопаузальных расстройств.
Заключение
В России активный генистеин представлен средствами менорил и менорил плюс. В состав менорила входит 30 мг активного вещества, содержащегося в одной капсуле. Одна капсула менорил плюс включает комплекс биологически активных соединений: генистеин 15 мг, ресвератрол 15 мг, витамин D3 0,005 мг и К1 0,06 мг. Особенности состава и дозировки средств менорил и менорил плюс позволяют рекомендовать менорил женщинам с умеренно выраженным климактерическим синдромом для купирования приливов жара, тогда как менорил плюс может быть использован для профилактики возрастных изменений и при легком течении климактерического синдрома.
В проведенном исследовании было доказано, что применение генистеина, синтезированного в активной форме (менорила), в суточной дозе 60 мг на протяжении 6 месяцев достоверно улучшает качество жизни, снижает частоту и выраженность климактерических симптомов и вегетативной дисфункции у женщин в пери- и постменопаузе и может рекомендоваться женщинам, имеющим противопоказания к гормональной терапии или не желающим ее использовать.



