Первое описание гена Notch (notch, англ. – вырез, насечка) принадлежит Томасу Моргану, изучавшему образование вырезов на крыльях фруктовых мушек (Drosophila melanogaster), причиной которого являлась частичная потеря функции данного гена [1]. Сигнальный путь Notch является эволюционно-консервативным и соответственно аналогичным у всех живых организмов. Впервые он возник у многоклеточных организмов как дополнительный регулятор паракринных межклеточных взаимодействий [2]. Считается, что сигналы от Notch ответственны за выбор между возможными программами дифференцировки клеток и в зависимости от имеющихся условий могут стимулировать или угнетать процессы пролиферации, дифференцировки и апоптоза клеток.
У млекопитающих сигнальная система Notch представлена четырьмя рецепторами и пятью лигандами [3, 4]. Согласно данным литературы, именно взаимодействие рецепторов и лигандов Notch, расположенных на соседних клетках, приводит к активации данного сигнального пути [2, 3, 5, 6]. Опубликованные результаты исследований свидетельствуют о важности сигнального пути Notch для нормального развития плаценты. Нарушения в его работе могут оказывать влияние на процесс плацентации [7]. Вместе с тем, отмечается неоднозначность имеющихся результатов исследований, посвященных изучению роли системы Notch в плацентации.
Цель работы: обобщить и систематизировать имеющиеся данные о роли сигнальной системы Notch в нормальной плацентации и развитии патологии плаценты.
Молекулярная структура Notch
В клетках человека выявлено четыре трансмембранных рецептора семейства Notch (Notch1-4). Активация их, как и любого другого поверхностного рецептора, происходит при связывании с лигандом, которым является также мембраносвязанная молекула. Лигандами для Notch являются 2 группы молекул Jagged (Jag1 и 2 типа) и δ-подобные белки (Dll1, Dll3 и Dll4 у млекопитающих) [3, 4]. Notch и его лиганды являются однопроходными трансмембранными гетеродимерами. Внеклеточный домен как рецептора, так и лиганда состоит из многократно повторяющихся фрагментов эпидермального фактора роста (EGF), который может быть модифицирован путем присоединения к нему молекул полисахаридов. Рецепторы Notch также содержат несколько доменов, которые в отсутствии лигандов переводят его в неактивное состояние [8].
Сам белок Notch состоит из внеклеточного (NECD), трансмембранного (TM) и внутриклеточного доменов (NICD) с транскрипционной активностью [9, 10]. Внеклеточный участок рецептора содержит от 10 до 36 EGF-подобных повторяющихся фрагментов, необходимых для связывания с лигандом, и три копии околомембранных повторяющихся фрагментов. Последние известны как Lin-12-Notch повторяющиеся фрагменты (LNR), влияющие на взаимодействие вне- и внутриклеточных доменов Notch [11]. NICD построен из нескольких доменов, включая Rbp-связанный молекулярный домен (RAM), участвующий во взаимодействии с белками CBF-1, Lag-2, повторяющимся фрагментом анкирина (ANK), доменом, активирующимся при транскрипции (TAD), и C-концевым фрагментом, богатым пролином, глутаминовой кислотой, серином и треонином [8]. В последнее время установлено, что NICD является мишенью для множества посттранскрипционных модификаций, включая фосфорилирование, убиквитирование, гидроксилирование и ацетилирование [12].
Канонический и неканонический сигнальные пути Notch
Функции системы Notch могут быть реализованы двумя путями: каноническим и неканоническим. Канонический путь активируется тогда, когда лиганд Notch связывается с EGF повторами 12—12 и 24—29 внеклеточного домена рецептора соседней близлежащей клетки, результатом чего является последующий цитоплазматический распад внутриклеточного домена [13–15]. На молекулярном уровне запуск рецептора Notch при связывании с лигандом приводит к активации двух протеолитических процессов в рецепторе [16].
Первый протеолитический этап опосредован металлопротеиназным фактор некроза опухоли α-превращающим ферментом, также известным как дисинтегрин и металлопротеиназа 17 (ADAM17), воздействующим на внеклеточный домен рецептора Notch. При этом отщепленная внеклеточная субъединица рецептора подвергается «транс-эндоцитозу» соседними лигнад-экспрессирующими клетками [17]. По мнению E. Gazave с соавт. [18], данный процесс контролируется убиквитин-лигазами Neutralized или Mindbomb E3.
Присоединение внеклеточного лиганда к рецептору Notch также вызывает запуск второго протеолитического расщепления в трансмембранном участке рецептора, опосредованного γ-секретазой, активируемой презенилином-1 [19, 20]. Подобное расщепление приводит к высвобождению мембранно-связанной формы внутриклеточного домена Notch [14]. Высвобожденный домен переносится в ядро клетки, где взаимодействует с ДНК-связывающим фактором транскрипции CSL, результатом чего является активация генов-мишеней Notch, таких как ген HES и гены HES-зависимых белков (HERP) [19, 21–23].
В отсутствии внутриклеточного домена Notch ДНК-связывающий белок CSL активирует ко-рецепторные комплексы, подавляя транскрипцию генов-мишеней Notch [24]. При наличия внутриклеточного домена последний взаимодействует с CSL, результатом чего является активация коактиваторного комплекса, представленного mastermind-подобными белками (MAML-1) и другими хроматин-модифицирующими факторами транскрипции, результатом чего становится транскрипционная активация генов-мишеней Notch [25].
Канонический путь активации Notch характеризуется тем, что в нем не участвуют вторичные мессенджеры. Неканонический путь является CSL-независимым и в то же время может быть как лиганд-зависимым, так и лиганд-независисмым. Наиболее изученным эффектом реализации неканонического сигнального пути Notch считается регуляция Wnt/β-катенин сигнальной системы, где Notch связывает активный β-катенин – облигатный компонент сигнального пути Wnt [26].
Имеются данные о том, что взаимодействие между лигандами и рецепторами может как активировать, так и подавлять сигнальный путь Notch. Межклеточные взаимодействия (транс-транс взаимодействия) также могут регулировать этот сигнальный путь. Кроме того, активация пути Notch может происходить при связывании лигандов Notch, синтезируемыми клеткой, с рецепторами Notch, расположенными на той же самой клетке (цис-взаимодействия) [27]. В целом трансвзаимодействия между лигандами и рецепторами Notch приводят к активации сигнального пути, тогда как цис-взаимодействия подавляют его [3].
Сигнальный путь Notch в плаценте
Считается, что сигнальный путь Notch играет определенную роль в развитии беременности вообще и нормальном протекании процесса плацентации в частности. Так, Y. Afshar с соавт. [28] установили, что система Notch оказывает влияние на децидуализацию эндометрия и, таким образом, необходима для имплантации. Авторами показано, что под влиянием стимуляции хорионическим гонадотропином в сочетании с эстрогенами и прогестероном в периимплантационном периоде происходит активация рецептора Notch с последующим подавлением. Данный процесс рассматривается как один из ключевых для успешного наступления беременности [28]. Члены семейства Notch также были выявлены в развивающейся плаценте, при этом была показана их важная роль в нормальном развитии и функционировании плаценты, прежде всего, в регуляции процессов пролиферации и инвазии трофобласта, а также в плацентарном ангиогенезе [29, 30]. Также было установлено, что сигнальный путь Notch в различных субпопуляциях трофобласта может быть реализован как каноническим, так и неканоническим путем [31].
Следует также добавить, что для успешной имплантации необходимо четкое пространственно-временное распределение всех регуляторов функций трофобласта, а также процессов васкулогенеза и ангиогенеза [32–34]. Основными свойствами трофобласта считаются дифференцировка, пролиферация, миграция и инфазивность (в интерстиций и стенку сосуда). Дифференцировка цитотрофобласта приводит к появлению двух разнородных клеточных популяций: синцитиотрофобласта и вневорсинчатого трофобласта. При этом образование инвазивной популяции вневорсинчатого трофобласта – один из ключевых факторов, обеспечивающих нормальное протекание процессов имплантации и инвазии. В результате этого эпителиальный фенотип трофобласта меняется на эндотелиальный, характеризуя псевдоваскулогенез [35, 36]. Нарушения процессов псевдоваскулогенеза рассматриваются в качестве одного из ключевых моментов развития преэклампсии (ПЭ) [35].
Действительно, адекватная инвазия трофобласта в течение первой недели беременности – критический этап, влияющий на здоровье как матери, так и плода. Установлено, что нарушение инвазии приводит к развитию ряда осложнений беременности, включая ПЭ, задержку роста плода, привычные потери беременности [37, 38].
В свою очередь сигнальный путь Notch играет критическую роль в дифференцировке тканей посредством регуляции процессов пролиферации, клеточной смерти и специализации клеток [3]. Дифференцировка, пролиферация и инвазия трофобласта – ключевые этапы развития плаценты. Таким образом, система Notch может играть определенную роль в регуляции функций трофобласта.
Сигнальный путь Notch и трофобласт
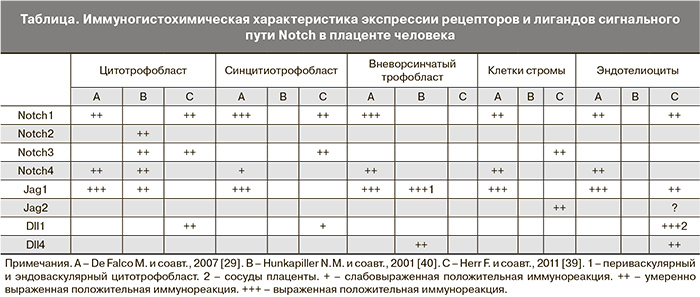
К сожалению, имеющиеся данные об экспрессии компонентов системы Notch в структурах плаценты немногочисленны и неполноценны. В таблице суммированы опубликованные результаты исследований локализации и уровня экспрессии рецепторов и лигандов Notch трофобластом человека.
По данным [29, 39] клетки цитотрофобласта экспрессируют рецептор Notch1. В то же время N.M. Hunkapiller с соавт. [40] отметили отрицательную реакцию данного типа рецептора в цитотрофобласте. В отношении других рецепторов Notch также имеются некоторые несоответствия, касающиеся их экспрессии в ткани плаценты. Подобные различия в результатах исследований объясняются использованием антител различных производителей, разницей в методиках планирования и проведения исследования, а также гетерогенностью ткани плаценты [41].
Кроме того, N.M. Hunkapiller с соавт. [40] выявили не только пространственные, но и временные различия в экспрессии компонентов системы Notch в ткани плаценты. Так, они установили, что экспрессия Notch2 была минимальной или отсутствовала в клетках-предшественниках цитотрофобласта, тогда как с началом инвазии его экспрессия в цитотрофобласте клеточных колонн была значительно повышена. Однако механизмы регуляции пространственной и временной экспрессии рецепторов Notch до сих пор не выяснены. Тем не менее, выявление экспрессии рецепторов и лигандов Notch в различных популяциях трофобласта при развитии плаценты свидетельствует об участии данной сигнальной системы в процессах дифференцировки и инвазии трофобласта. При этом отсутствуют четкие доказательства вовлеченности системы Notch в процесс пролиферации трофобласта.
В наблюдениях задержки роста плода установлено, что снижение уровня экспрессии белков Notch в ткани плаценты коррелирует с уменьшением ее массы [42]. Исходя из полученных результатов, авторы предположили, что белки системы Notch могут играть роль в пролиферации клеток плаценты. В этой связи для выяснения роли системы Notch в пролиферации трофобласта и, возможно, других клеточных элементов плаценты, необходимо проведение дополнительных исследований. Как видно из данных, представленных в таблице, в некоторых исследованиях отмечается коэкспрессия белков Notch в одних и тех же клетках.
Кроме того, P. Rizzo с соавт. [43] установили, что гиперэкспрессия Notch1 в клетках линии рака молочной железы приводит к увеличению экспрессии Notch4, а отсутствие экспрессии Notch1 приводит к снижению экспрессии Notch4. Следовательно, для выяснения взаимовлияний различных белков системы Notch в клетках плаценты необходимы дальнейшие исследования.
Роль системы Notch в плацентарном ангиогенезе
Рецепторы и лиганды Notch играют важную роль в процессах васкуло- и ангиогенеза. Частично это подтверждается экспрессией компонентов системы Notch в сосудах плаценты, показанное в некоторых исследованиях. Так, F. Herr с соавт. иммуногистохимическими методами изучили распределение рецепторов и лигандов Notch в плацентарных сосудах. Они установили, что рецептор Notch1 и его лиганды, Jag1, Dll4 и Dll1 локализовались в основном в эндотелиоцитах третичных ворсин, тогда как Jag1 экспрессировался перицитами. Также было установлено, что Jag1 экспрессируется преимущественно эндотелием крупных сосудов, тогда как Dll4 – капиллярами зрелых промежуточных и терминальных ворсин. Более тога, авторами было изучено одно наблюдение синдрома Alagille, связанного с мутацией Jag1, при котором экспрессия Jag1 плацентарными эндотелиоцитами отсутствовала, однако качественное и количественное распределение плацентарных сосудов при этом было не изменено [39].
Z. Sahin [42] с коллегами показали, что в нормальной плаценте человека рецептор Notch1 экспрессируется эндотелиоцитами сосудов как базальной (материнская часть), так и хорионической (плодная часть) пластинки. Результаты исследования M. De Falco и соавт. показывают, что умеренная экспрессия Notch1 и выраженная экспрессия Notch4 и Jag1 определяется в цитоплазме эндотелиальных клеток ворсин плаценты [29]. T. Kume в своем обзоре указывает, что экспрессия Notch1, Notch4, Dll1в плаценте и Dll4 преимущественно ограничена эндотелиальными клетками, что в целом, соответствует данным других исследователей [44]. Имеющиеся несоответствия в локализации компонентов системы Notch в плаценте в различных исследованиях могут быть связаны с особенностями их временного и пространственного распределения при плацентарном ангиогенезе [45].
Результаты других исследователей также подтверждают участие системы Notch в процессах васкуло- и ангиогенеза. Так, согласно результатам недавнего исследования J. Wagener с соавт. [46], повышение экспрессии Notch1 приводит к активации его таргетного гена, ингибитора клеточного цикла p21, что, в свою очередь стимулирует ангиогенез, опосредованный двумя активными формами белка CCN3 (NOV). Кроме того, Y. Fang с соавт., изучая особенности плацентарного ангиогенеза при прерывании беременности, выявили значимо повышенный уровень экспрессии Notch1 и незначимое повышение экспрессии его лиганда DLL4. Авторами также была выявлена положительная корреляция между уровнями экспрессии Notch1 и DLL4 [47]. Таким образом, система Notch играет определенную роль в образовании и росте сосудов плаценты, однако молекулярные механизмы их участия в плацентарном васкуло- и ангиогенезе пока не выяснены.
Роль плацентарной системы Notch в развитии преэклампсии
Как указано выше, система Notch играет важную роль в развитии плаценты. Поэтому нарушения ее функционирования могут вносить определенный вклад в развитие некоторых осложнений беременности, в том числе и ПЭ. Так, Sahin Z. с соавторами [42] выявил значимое снижение уровней плацентарной экспрессии при ПЭ белков Notch1 и 2, а также Jag2 при ПЭ по сравнению с контролем. Также они предположили, что сниженная экспрессия Notch1 в эндотелиоцитах сосудов плаценты при ПЭ может отражать нарушения развития и функционирования фето-плацентарной сосудистой системы. Кроме того, авторы отметили изменение клеточной локализации белков системы Notch при ПЭ в виде перехода мембрано-связанных форм белков Notch1, 2, 4 и Jag1 во внутрицитоплазматическую, связав этот процесс с возможным сдвигом канонического Notch-пути в сторону лиганд-независимого.
Аналогичные результаты приводят L. Cobellis с соавт. [45]: экспрессия белков системы Notch (Notch1, Notch4 и Jag1) в ткани плаценты при ПЭ была значимо ниже по сравнению с плацентами контрольной группы. Примечательно, что во всех исследованных наблюдениях беременность была доношенной. При этом авторы сделали заключение, что значимо сниженная экспрессия Notch1 в плаценте беременных с развившейся ПЭ указывает на важную его роль в процессе плацентации [45]. Результаты проведенных нами иммуногистохимических исследований также свидетельствуют о снижении интенсивности реакции Notch1 в синцитиотрофобласте терминальных ворсин и в клетках вневорсинчатого трофобласта плаценты при умеренной и тяжелой ПЭ [48].
Наряду с этим, N.M. Hunkapiller с соавт. [40] не выявили значимых различий в уровнях цитотрофобластической экспрессии белков Notch2-4 и рецептора Dll4 между группами контроля и ПЭ. Однако они обнаружили, что экспрессия Jag1 отсутствовала во многих плацентарных сосудах в группе ПЭ, тогда как в сосудах плацент при преждевременных родах она была выраженной. На основании полученных результатов авторы предположили, что корреляция между сниженной экспрессией Jag1 и нарушением ремоделирования спиральных артерий при ПЭ может свидетельствовать о важной функциональной роли системы Notch в ранних этапах плацентации [40]. Отсутствие различий в уровнях плацентарной экспрессии компонентов системы Notch было также показано в исследовании S.A. Founds с соавт., однако необходимо отметить, что авторы изучали экспрессию генов системы Notch в проспективном исследовании в биоптатах хориона [49]. Выраженная экспрессия компонентов системы Notch при ПЭ была также выявлена в структурах decidua basalis на основании изучения из транскрипционных профилей [41]. Необходимо отметить, что в большинстве представленных исследований группы ПЭ и контроля не были сопоставимы по срокам беременности, а в части из них беременность была осложнена не только ПЭ, но и задержкой внутриутробного роста плода [50]. Вместе с тем, результаты представленных исследований указывают на то, что система Notch играет существенную роль в развитии ПЭ.
Заключение
Notch-зависимое определение судьбы клеток играет важную роль в эмбриогенезе и в поддержании целостности тканей. Наличие рецепторов и лигандов системы Notch в трофобласте плаценты человека свидетельствует об участии сигнального пути Notch в программе дифференцировки трофобласта. Результаты немногочисленных исследований подтверждают важную роль системы Notch в процессе инвазии вневорсинчатого трофобласта, а также наличие временных и пространственных особенностей плацентарной экспрессии компонентов данной системы. Особенности экспрессии белков системы Notch в плацентарных сосудах указывают на их вовлеченность в процессы плацентарного васкуло- и ангиогенеза. Однако многие вопросы пока остаются без ответа. Во-первых, какие факторы вызывают активацию сигнального пути Notch в плаценте человека. Инициальные сигнальные пути и факторы, контролирующие экспрессию белков системы Notch в структурах трофобласта и сосудах плаценты также малоизученны. Во-вторых, большинство исследований роли сигнального пути Notch в процессе плацентации являются, по сути, описательными. Таким образом, для того, чтобы ответить на все поставленные вопросы, необходимо проведение масштабных исследований, включая эксперименты in vitro и in vivo, возможно, с использованием приматов, так как структура их плаценты максимально соответствует структуре плаценты человека.



