Несмотря на широкое распространение пролапса тазовых органов (ПТО), патофизиология и естественный процесс развития данного заболевания недостаточно изучен. Эпидемиологические исследования показали, что вагинальные роды и старение являются главными факторами риска развития ПТО [1]. G. Rortveit с коллегами отметили, что каждые последующие роды увеличивают риск возникновения пролапса: у однократно рожавших женщин OR=2,8 (95% ДИ: 1,1–7,2), после двух родов OR=4,1 (95% ДИ: 1,8–9,5), а в случаях трех и более родов OR=5,3 (95% ДИ: 2,3–12,3) [2]. Однако есть данные, что в формировании пролапса гениталий решающую роль играет не столько количество родов, сколько их особенности. Риск развития заболевания увеличивается при осложненном течении беременности и родов, в том числе при стремительных родах, разрывах промежности, наложении акушерских щипцов, вакуум-экстракции плода, эпизио- и перинеотомии, а также при крупном плоде, в результате перерастяжения и повреждения тканей связочного аппарата матки и тазового дна [3–5].
Механизмы, посредством которых происходит ослабление поддерживающих структур тазового дна, до сих пор окончательно не известны. Кроме того, неясны механизмы, откладывающие (пролонгирующие) клинические проявления генитального пролапса на долгие годы.
Исследования показали, что ключевым, решающим фактором для восстановления поддерживающих структур после вагинальных родов является синтез и соединение эластических волокон стенки влагалища [6]. Важную роль в данном процессе играет белок соединительной ткани фибулин-5 (FBLN5). FBLN5 является ключевым белком для сборки эластических волокон и, вероятно, выступает связующим звеном между клетками и тропоэластином для эффективного перекрестного взаимодействия и объединения тропоэластина в зрелые эластические волокна [7, 8].
Предполагается, что генетически обусловленные различия в строении и/или регенерации соединительной ткани могут вносить свой вклад в развитие пролапса органов тазового дна [9, 10]. Мутации в гене FBLN5 обусловливают развитие синдрома вялой кожи и возрастную дегенерацию макулы [11]. В экспериментальных исследованиях показана роль матриксного белка FBLN5 в аномальном эластогенезе, увеличении протеазной активности и ослаблении «поддержки» тазовых органов с возрастом [12]. Таким образом, ген FBLN5 может рассматриваться как один из наиболее перспективных для изучения в качестве гена предрасположенности к ПТО.
Целью данного исследования является поиск полиморфных вариантов гена FBLN5, ассоциированных с риском развития ПТО у женщин.
Материал и методы исследования
В исследовании приняли участие 502 пациентки из клинической базы кафедры акушерства и гинекологии № 1 лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова. Участницы были разделены по принципу наличия или отсутствия ПТО на 2 клинические группы – основную группу составили 210 женщин с ПТО II–IV стадии по системе POP-Q, а контрольную – 292 женщины без генитального пролапса; средний возраст в группах составил 57,65±10,80 и 57,25±12,70 года соответственно. Обе группы были аналогичны по факторам риска (возраст, индекс массы тела (ИМТ), репродуктивный период или менопауза/постменопауза, количество родов естественным путем, вес плода, наличие родовых травм).
Ген FBLN5 не имеет известных функциональных полиморфных вариантов, для которых была бы показана устойчивая ассоциация с экспрессией гена и заболеваниями соединительной ткани [13, 14]. Для ассоциативного исследования ПТО выбор сайтов для генотипирования был основан на использовании ресурса HaploView (version 4.2) для подбора таргетных SNP с целью покрытия всего гена. На рисунке показана гаплотипическая структура гена FBLN5. Ген включает девять блоков сцепления, в каждом из которых методом тетра-праймерной аллель-специфической полимеразной цепной реакции (ПЦР) было прогенотипировано по одному из таргетных SNP.
Генотипирование выполнялось в лаборатории экологической генетики ФГБУН Институт общей генетики им. Н.И. Вавилова РАН. Образцы крови собирали в вакутейнеры, содержащие ЭДТА, и хранили при -20–80°С до выделения ДНК. Для генотипирования выделяли ДНК из цельной крови с помощью наборов Diatom DNA Prep 200, основанных на использовании гуанидинтиоционата и Nucleus-сорбента (Isogene Lab. Ltd, Россия). Для проведения ПЦР использовали лиофилизированные наборы Master Mix (Фирма Изоген), в которые добавляли 10 мкл ПЦР-растворителя, 3 мкл праймеров (оптическая плотность 3–4 о.е.), 2 мкл деионизованной воды, 5 мкл исследуемой ДНК. Амплификацию проводили в амплификаторе Applied Biosystems 9700 (GeneAmp® PCR System 9700). Визуализация результатов осуществлялась в 2% агарозном геле с добавлением бромистого этидия.
Статистический анализ проводили стандартными методами с помощью пакета программ WinSTAT 2003.1, интегрированного в Excel. Методом χ2 оценивали соответствие распределения генотипов равновесию Харди–Вайнберга. Оценки частот генотипов и гаплотипов и их эффектов были получены методом логистического регрессионного анализа с помощью компьютерной программы SNPStats.

Результаты исследования и обсуждение
В ходе исследования пациентки были прогенотипированы по девяти tagSNP гена FBLN5 (rs2430339, rs12586948, rs2284337, rs2498841, rs2018736, rs12589592, rs2430369, rs2245701, rs2474028); все изученные варианты находились в состоянии равновесия по Харди–Вайнбергу. При статистической обработке всей выборки для гена FBLN5 был выявлен протективный rs12589592-A и рисковый rs2018736-С аллели (рецессивная модель, P=0,0026, OR=0,42, 95% ДИ: 0,24-0,75; аддитивная модель, P=0,032, OR=1,37, 95% ДИ: 1,03-1,84 соответственно) (табл. 1).
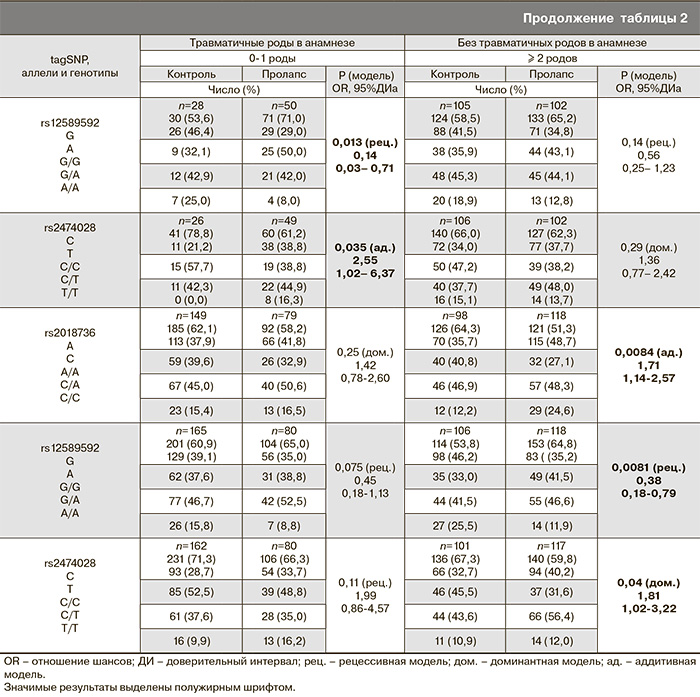
Эластические волокна играют важную роль во время беременности и родов, обеспечивая адаптацию тканей к значительному растяжению, однако родовые травмы (эпизио- и перинеотомия, разрывы промежности, применение акушерских щипцов, вакуум-экстракция плода) и роды крупным плодом приводят к перерастяжению и повреждению эластических волокон, провоцируя развитие ПТО. В связи с этим мы стратифицировали выборки по наличию/отсутствию травматичных родов в анамнезе, а также по весу ребенка при родах. В первом случае было обнаружено, что в группе с родовыми травмами минорные аллели rs12586948-A, rs2018736-С и rs2474028-Т чаще встречались у женщин с ПТО по сравнению с контрольной группой, а также был обнаружен протективный эффект аллеля rs12589592-А, который встречался чаще у здоровых женщин (множественный регрессионный анализ: доминантная модель, P=0,047, OR=1,83, 95% ДИ: 1,00-3,35; P=0,0033, OR=2,52, 95% ДИ: 1,35-4,71; P=0,028, OR=1,96, 95% ДИ: 1,07-3,59; рецессивная модель, P=0,0018, OR=0,27, 95% ДИ: 0,11-0,64 соответственно) (табл. 2).
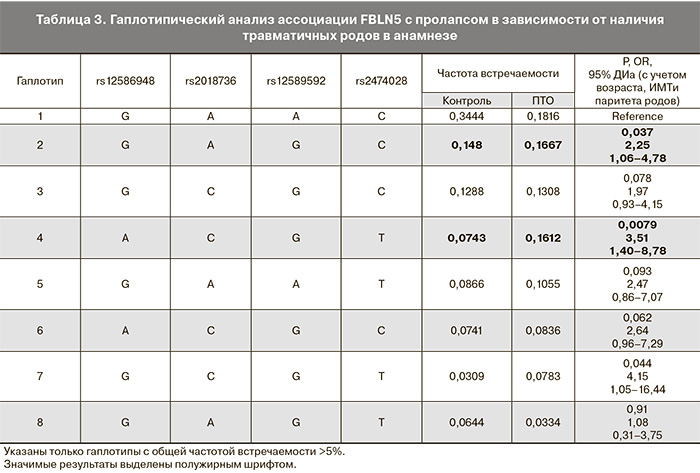
Гаплотип, состоящий из рисковых аллелей rs12586948(A) – rs2018736(C) – rs12589592(G) – rs2474028(T) при частоте встречаемости 16,12% в группе с травматичными родами характеризовался значимостью эффекта: P=0,0079, OR=3,51, 95% ДИ: 1,40-8,78 (табл. 3).
При стратификации выборки по массе плода аллельные варианты rs2018736-С, rs12589592-А, rs2474028-Т гена FBLN5 оказались ассоциированными с риском развития ПТО в группе женщин с макросомией плода (≥4000 г), в то время как эффекты в группе с нормальным весом плода не достигали уровня статистической значимости (множественный регрессионный анализ: доминантная модель, P=0,048, OR=3,25, 95% ДИ: 0,98-10,76; рецессивная модель, P=0,013, OR=0,14, 95% ДИ: 0,03-0,71; аддитивная модель, P=0,035, OR=2,55, 95% ДИ: 1,02-6,37 соответственно) (табл. 2).
Количество родов естественным путем является важным фактором риска опущения внутренних половых органов. Так, результаты исследования Oxford Family Planning Association study свидетельствуют о том, что вероятность развития ПТО повышается в 8 раз после 2 родов и в 12 раз после 4 и более родов [15]. Мы стратифицировали выборку по количеству родов на 2 группы: 0–1 роды и 2 родов и более. Статистически значимые результаты были получены в подгруппе женщин с 2 и более родами: обнаружено 2 рисковых rs2018736-С, rs2474028-Т и один протективный аллели rs12589592-А (множественный регрессионный анализ: аддитивная модель, P=0,0084, OR=1,71, 95% ДИ: 1,14-2,57; доминантная модель, P=0,04, OR=1,81, 95% ДИ: 1,02-3,22; рецессивная модель, P=0,0081, OR=0,38, 95% ДИ: 0,18-0,79, соответственно) (табл. 2).

В основе ПТО любой степени лежат изменения в соединительнотканных и мышечных компонентах тазового дна. В настоящее время существует ряд генов и локусов, которые можно рассматривать в качестве возможных кандидатов, участвующих в патогенезе данного заболевания [16].
За последние несколько лет накопилось достаточное количество работ, доказывающих важную роль белка FBLN5 в развитии ПТО [12, 17–21]. Однако до настоящего времени не проводились исследования по изучению ассоциации полиморфных вариантов гена FBLN5 с риском развития данного заболевания. При выполнении эксперимента на животных, заключающегося в растяжении влагалища (имитация родов) у Fbln5-/-мышей, отмечено быстрое прогрессирование ПТО, которое впоследствии никогда уже не устранялось [22]. Неоднократно была доказана роль в развитии пролапса гениталий еще одного гена, участвующего в формировании эластических волокон, LOXL1 (lysyloxidase-like 1) [12, 17]. Так, в эксперименте на мышах установлено, что примерно у одной трети самок LOXL1-/- развился тяжелый ПТО уже после первого помета [23]. Не так давно разработаны 2 модели мышей, обе с нулевыми мутациями (-/-) по генам FBLN5 и LOXL1. Интересно, что у этих мышей рано развиваются эластинопатии (эмфизема, морщинистая кожа, сосудистые отклонения и др.), в то время как ПТО развивается гораздо позднее, после вагинальных родов [12, 24].
Основным компонентом соединительной ткани являются коллагеновые волокна. Известно, что женщины с нарушениями метаболизма коллагена страдают от пролапса гениталий чаще других женщин [25]. А.Г. Ящук и соавт. установили ассоциации полиморфизмов Аlu и VNTR гена Соl3А1, кодирующего α-цепь коллагена III типа, с ПТО, выявив рисковые генотипы Alu-/- и VNTR*2*2 гена Соl3А1 [26]. Также изучалось влияние на развитие ПТО матриксных металлопротеиназ (ММP), ответственных за ремоделирование компонентов внеклеточной матрицы. При иммуногистохимических исследованиях биоптатов тканей поддерживающего аппарата органов малого таза отмечена повышенная экспрессия ММР-1, ММР-2 и ММР-9 на фоне увеличения в этих же тканях экспрессии коллагена III типа [27]. P. Skorupski и соавт. обнаружили корреляцию полиморфных вариантов 1G/2G MMP-1 в позиции−1607/−1608 и 5A/6A MMP-3 в позиции −1612/−1617 с повышенным риском развития ПТО у женщин [28].
При исследовании генов ферментов системы детоксикации было выявлено, что наиболее неблагоприятным прогностическим фактором клинического течения ПТО является комбинация «медленного» генотипа NAT2 с сочетанным «нулевым» генотипом GSTs [29]. Кроме того, показано, что в значительной степени с ПТО связаны по крайней мере 6 SNP, расположенных на участках хромосом 4q21, 8q24, 9q22, 11q14, 15q11 и 21q22, а также одиночные нуклеотидные полиморфизмы гена эстрогенового рецептора ERα (rs2228480) и гена рецептора прогестерона PGR (rs484389) [30, 31].
Заключение
В настоящей работе была обнаружена связь аллельных вариантов rs2018736-С, rs12589592-А, rs2474028-Т гена FBLN5 с риском развития ПТО в формируемых по разным критериям стратах с перинеальными травмами, макросомией плода и неоднократными родами. При этом все вышеперечисленные факторы способствуют перерастяжению и повреждению эластических волокон связочного аппарата матки и фасциально-мышечных структур тазового дна [3, 4, 32].
Генетический статус, определяемый носительством выявленных рисковых и протективных аллелей гена FBLN5, позволяет диагностировать риск развития ПТО у женщин с повреждениями мягких родовых путей в относительно молодом, пременопаузальном, возрасте. Дальнейшее изучение взаимосвязи клинических и молекулярно-генетических основ заболевания будет способствовать разработке комплексных превентивных мер: от коррекции образа жизни, выбора клинической тактики при решении вопроса о характере родоразрешения, до возможной специфической (рекомбинантной) терапии с целью уменьшения риска возникновения ПТО, профилактики прогрессирования заболевания и развития тяжелых форм дисфункции тазового дна.




