Гипоактивное расстройство полового влечения (HSDD) – это гнетущая постоянная или повторяющаяся недостаточность желания сексуальной активности, а также отсутствие сексуальных, эротических мыслей и фантазий [1]. HSDD является частым многофакторным нарушением в сексуальной сфере, которое испытывают около 7,4% женщин в развитых странах [2, 3]. Снижение сексуального влечения (желания) может быть вызвано дисбалансом возбуждающих и тормозных нейрональных механизмов и нейротрансмиттеров, которые регулируют сексуальные реакции [3, 4]. Предполагается, что у женщин с низким сексуальным влечением может наблюдаться избыточность тормозных нейромодуляторов (серотонина, опиоидов, эндоканнабиноидов) по сравнению с уровнями возбуждающих нейромодуляторов (норадреналина, окситоцина, дофамина, меланокортинов); однако механизм патологического снижения сексуального влечения у женщин в настоящее время изучен недостаточно [5].
Сексуальная дисфункция может оказывать глубокое негативное воздействие на общее состояние здоровья женщины, на еe взаимоотношения с партнeром и близкими [3]. В широкомасштабном исследовании, в котором изучалось влияние сексуальной дисфункции на качество жизни, 70% женщин со сниженным сексуальным влечением отмечали личные и межличностные последствия такого состояния, которые включали потерю эмоциональной связи с сексуальным партнером, негативное самовосприятие образа тела, снижение уверенности в себе [5, 6]. Лечение HSDD часто не проводится [7]. В настоящее время единственными препаратами, зарегистрированными для лечения HSDD у женщин репродуктивного и пременопаузального возраста, являются флибансерин и бремеланотид; однако разрешены и официально продаются они только в США [8, 9]. Как флибансерин, так и бремеланотид обладают определeнными ограничениями в применении, а их эффективность невелика [7]. Существует неудовлетворенная медицинская потребность в удобном, безопасном и эффективном лекарстве для лечения женщин, страдающих HSDD.
Дизайрикс (МНН оренетид, кодовое наименование BP101) – это исследуемый лекарственный препарат, пептид, состоящий из пяти аминокислот, применяемый в виде назального спрея. Механизм действия Дизайрикса в настоящее время продолжает изучаться, но имеющиеся данные показывают, что он воздействует на структуры мозга, ответственные за регуляцию сексуального и репродуктивного поведения [10]. Интраназальное введение Дизайрикса стимулировало сексуальное поведение у крыс, как предполагается, воздействуя на ядра гипоталамуса и лимбико-ретикулярной системы [10]. В ряде исследований было показано, что Дизайрикс, проникая через слизистую оболочку носа к нейронам обонятельных луковиц, а затем через их аксоны, которые составляют обонятельные тракты на базальной поверхности мозга, попадает в гипоталамические структуры. In vitro Дизайрикс в высоких концентрациях ингибирует активацию отдельных рецепторов гамма-аминомасляной кислоты (ГАМК)-А. Эти данные согласуются с имеющимся представлением о том, что ГАМК влияет на сексуальное поведение [11–14]. Кроме того, Дизайрикс стимулирует сексуальное поведение у животных при интракраниальном введении в преоптическую область, роль которой в репродуктивном и сексуальном поведении была продемонстрирована в ряде исследований [10, 15–17]. Данные последних исследований позволяют предположить, что Дизайрикс оказывает влияние на механизмы глутаматной нейрональной передачи в промежуточном мозге и, возможно, в префронтальной коре.
Человеческая сексуальность и сексуальное влечение/желание являются факторами, влияющими на общее благосостояние и состояние здоровья мужчин и женщин на протяжении всей жизни [18]. Лекарственный препарат «Дизайрикс» изучался в нескольких клинических исследованиях: его
безопасность была установлена в исследованиях I фазы BP101-HV01 и BP101-HV02. Результаты рандомизированного двойного слепого плацебо-контролируемого исследования II фазы (BP101-SD01) показали, что препарат «Дизайрикс», применяемый в виде назального спрея, безопасен, значительно улучшает сексуальное влечение (желание), сексуальное функционирование и уменьшает сопутствующий дистресс у женщин [19].
Целью данного исследования III фазы было подтверждение безопасности и эффективности Дизайрикса у женщин с HSDD репродуктивного и пременопаузального возраста. Исследование было одобрено Министерством здравоохранения Российской Федерации (РКИ № 688 от 25.12.2017 в государственном реестре лекарственных средств grls.rosminzdrav.ru/CIPermitionReg.aspx) и независимыми Этическими комитетами каждого из участвовавших в исследовании клинических центров. Перед включением в исследование все участницы предоставили письменное информированное согласие на участие в нeм. Информация об исследовании была внесена в международный реестр клинических исследований ClinicalTrials.gov, с номером NCT03463707.
Материалы и методы
Дизайн исследования
Данное многоцентровое рандомизированное двойное слепое плацебо-контролируемое 12-недельное исследование в параллельных группах проводилось в 19 амбулаторных клинических центрах в Российской Федерации с марта 2018 г. по февраль 2019 г. На этапе исходной оценки и далее в ходе исследования участницы должны были ежедневно заполнять электронный дневник в течение 28–30 дней для оценки исходного состояния сексуальной функции. Также на исходном этапе участницы проходили лабораторные и инструментальные скрининговые анализы и обследования, в том числе оценки с использованием соответствующих опросников и шкал. После завершения периода скрининга и окончательной оценки всех критериев отбора участницы были рандомизированы в группы лечения либо препаратом «Дизайрикс», либо идентичным ему плацебо в соотношении 1:1.
Курс терапии продолжался 4 недели, после завершения лечения участниц наблюдали ещe 8 недель, в ходе которых участницы не получали никакого лечения.
В ходе данного исследования была издана одна поправка к протоколу клинического исследования, которая была предварительно одобрена Минздравом РФ и всеми независимыми Этическими комитетами. Вносимые поправкой изменения устраняли выявленные внутренние несогласованности и незначительные ошибки протокола; также было отложено запланированное время проведения промежуточного анализа: данный анализ запланировали после включения 189 рандомизированных участниц вместо 160, как планировалось исходно. Сдвиг запланированного времени проведения промежуточного анализа был вызван техническими особенностями набора участниц в данное исследование. Внесенные изменения не влияли на дизайн исследования, качественный состав участниц, объем и результаты процедур оценки.
Участницы исследования и основные критерии участия
Критериями включения в исследование являлись: установленный диагноз снижения или утраты сексуального влечения (код по МКБ-10: F52.0), соответствующий диагнозу приобретенного генерализованного гипоактивного расстройства полового влечения (HSDD), согласно диагностическому и статистическому руководству по психическим болезням версии IV (DSM-IV), с продолжительностью текущего эпизода не менее 6 месяцев; возраст женщин от 21 до 50 лет; стабильные моногамные отношения с одним половым партнером-мужчиной длительностью не менее года; наличие регулярного менструального цикла. Статус «пременопауза» определялся как стадии -5–-3 по классификации периодов репродуктивной функции женщин (градации Staging System for Reproductive Aging In Women, STRAW). Участницы соглашались при появлении влечения предпринимать попытку полового контакта не менее 2 раз в месяц при доступности партнера физически в течение не менее 50% времени ежемесячно, используя при этом эффективные методы контрацепции на протяжении всего исследования. Для включения в исследование участница должна была иметь минимальный общий балл 15 по шкале сексуального дистресса у женщин (FSDS-R). Участницы должны были заполнять электронный дневник не менее 80% дней на этапе исходной оценки.
Участниц не включали в исследование при наличии в качестве основного диагноза другой сексуальной дисфункции, или значимого психического расстройства, или подозрения на депрессивное расстройство, оцениваемое как наличие 20 и более баллов по шкале депрессии Бека на скрининге. Также не включали женщин, проходивших психотерапевтическое лечение по поводу проблем в сексуальной сфере и/или проблем во взаимоотношениях с половым партнeром в течение предшествующих 12 месяцев. Участниц не включали в случае приeма запрещeнных в исследовании препаратов, включая антидепрессанты (в том числе селективные ингибиторы обратного захвата серотонина и ингибиторы обратного захвата серотонина и норадреналина). Другими критериями невключения были: наличие острых и обострения хронических воспалительных заболеваний носовой полости и носоглотки, наличие соматических заболеваний или других причин, препятствующих регулярной половой жизни, алкогольная зависимость, выраженные жизненные стрессогенные обстоятельства или наличие лекарственной или наркотической зависимости в анамнезе в течение предшествующих 12 месяцев.
Участниц исключали из исследования в случае беременности, несоблюдения правил участия в исследовании, а также если было выявлено, что участница включена в исследование с нарушением критериев отбора.
Исследуемый препарат, рандомизация и маскирование
Участниц исследования случайным образом в соотношении 1:1 распределяли (рандомизировали) либо в группу препарата «Дизайрикс», назначаемого в виде назального спрея в дозе 2 мг 1 раз в день (по одному впрыску, содержащему 1 мг препарата в каждый носовой ход), либо в группу плацебо, внешне полностью идентичного Дизайриксу. Первое применение препарата производилось после обучения и под контролем медицинского персонала. В дальнейшем участницы применяли исследуемый препарат самостоятельно в домашних условиях. Лечение длилось 4 недели.
Рандомизация проводилась централизованно через интерактивную систему с доступом в интернет [IWRS] на основании заранее созданного компьютерного алгоритма (рандомизационного листа) с присвоением каждой участнице рандомизационного номера, связанного с индивидуальным номером флакона с исследуемым препаратом (применяли блочную рандомизацию с размером блока, равным 4). В результате процедуры рандомизации сотрудники исследовательского центра через систему IWRS получали информацию о номере флакона, который выдавали участнице исследования.
В данном исследовании была исключена возможность повлиять на выбор группы, в которую при рандомизации распределялась конкретная участница. Схема рандомизации (рандомизационный лист) не была известна ни сотрудникам исследовательского центра, ни участницам, ни другому, непосредственно вовлечeнному в проведение исследования, персоналу. Таким образом, никто из них не знал, какое лечение получает конкретная участница исследования.
Методы оценки
Оценка безопасности включала сбор информации о нежелательных явлениях (НЯ), стандартные клинические лабораторные и инструментальные анализы и обследования и оценку основных жизненно важных показателей. Дополнительно у всех участниц оценивали концентрации в крови следующих гормонов: лютеинизирующего, фолликулостимулирующего, эстрадиола, пролактина, общего тестостерона. Информация о НЯ, включая тип и интенсивность, собиралась на протяжении всего исследования. Лабораторные параметры оценивались на исходном этапе, в конце лечения и после завершения лечения, в периоде наблюдения, в конце каждого месяца; масса тела и жизненно важные показатели измерялись при каждом посещении клиники. НЯ были закодированы с использованием медицинского словаря для нормативно-правовой деятельности (версия 21.1).
Для ежедневной фиксации параметров сексуальной активности в исследовании использовался электронный дневник участницы, в котором фиксировались, в том числе, удовлетворительные половые контакты (SSE) и половые контакты, завершившиеся оргазмом. Другие необходимые оценки также проводились через электронный дневник каждые 4 недели с использованием инструментов самооценки, валидированных для оценки состояния пациенток с HSDD, а именно: индекса женской сексуальной функции (FSFI), шкалы сексуального дистресса у женщин (FSDS-R) и шкалы общего впечатления пациентки об улучшении (PGI-I). Все шкалы и опросники применялись на русском языке с использованием валидированных переводов.
Конечные точки
Основной конечной точкой эффективности было изменение количества SSE после 4 недель лечения в сравнении с исходным периодом. Вторичные конечные точки эффективности включали изменение количества SSE после завершения лечения, а также изменения количества половых контактов, завершившихся оргазмом, общего балла опросника FSFI и его доменов («желание», «возбуждение», «любрикация», «оргазм», «удовлетворение» и «боль», связанная с вагинальным проникновением), суммарного балла и отдельно балла вопроса 13 по шкале FSDS-R, результатов по шкале PGI-I. Изменения анализировали после 4 недель лечения и после завершения лечения спустя 4 недели и 8 недель. Все изменения сравнивались между терапевтическими группами и с исходным периодом.
В течение периода лечения участницы записывали в дневник количество доз препарата, принятых между визитами в клинику. Исследователи отслеживали информацию из дневников, чтобы контролировать комплаентность участниц. Приемлемым уровнем комплаентности было применение препарата в течение не менее 80% дней запланированного курса лечения.
Статистический анализ и расчeт выборки
Анализ безопасности проводился у всех участниц, получивших хотя бы одну дозу исследуемого препарата или плацебо. Анализ эффективности всех конечных точек проводился в популяции полного набора данных, включавшей всех рандомизированных участниц, получивших хотя бы одну дозу исследуемого препарата или плацебо. Эта популяция соответствовала модифицированному принципу анализа данных в зависимости от назначенного вмешательства (modified intention to treat analysis, mITT). Модификация состояла во включении в анализ участниц, у которых имелись исходные данные, а также данные для анализа хотя бы одного показателя эффективности после начала терапии. Для восстановления пропущенных данных использовали методы переноса вперeд результатов последнего наблюдения (LOCF) и переноса вперeд результатов исходного наблюдения (BOCF). Для показателей эффективности, основанных на данных дневника участницы (удовлетворительных половых актов, числа половых контактов, завершившихся оргазмом), проводили стандартизацию к 28-дневному (4-недельному) периоду по следующей формуле: 28 × (число событий/число заполненных дней в дневнике).
В данном исследовании проверялась статистическая гипотеза о превосходстве препарата «Дизайрикс» над плацебо по основной конечной точке – изменению количества SSE после 4 недель лечения в сравнении с исходным периодом. В связи с исходно запланированным демаскированным промежуточным анализом с возможностью остановки в случае демонстрации ранней эффективности или с пересчетом необходимого количества участниц, для корректировки уровня значимости в связи с множественностью сравнений была выбрана функция зависимости вероятности ошибки первого рода от объема полученных данных (alpha spending function) типа Pocock. Значение двустороннего уровня альфа для промежуточного анализа было установлено на уровне 0,041, а для финального анализа – 0,024 соответственно (при общем двустороннем уровне значимости в исследовании 5%, одностороннем 2,5%).
В связи с завершением исследования после ранней демонстрации эффективности в ходе промежуточного анализа результаты сравнения по основной конечной точке представлены на двустороннем уровне значимости 0,041. При этом для вторичных конечных точек применялось критическое значение двустороннего уровня значимости 0,05 (5%), без корректировки.
Основную конечную точку эффективности анализировали с использованием ковариационного анализа (ANCOVA) с лечением в качестве фиксированного фактора и исходным значением показателя в качестве ковариаты. Этот же метод применяли для анализа изменения количества SSE после завершения лечения, количества половых контактов, завершившихся оргазмом, общего балла опросника FSFI и его доменов, суммарного балла по шкале FSDS-R и отдельно балла вопроса 13. Результаты по шкале PGI-I анализировали методом дисперсионного анализа (ANOVA) для всех визитов. Проверку применимости проводили с помощью графических методов, в том числе анализа остатков по моделям.
Все статистические анализы были выполнены с использованием статистического пакета SAS 9.4.
Расчeт размера выборки проводили, основываясь на данных предыдущего клинического исследования II фазы, ожидая стандартизированный размер эффекта для изменения количества SSE в этом исследовании порядка 0,47. Предполагая данную величину эффекта при двустороннем уровне значимости 0,024 и не менее 85% мощности теста для обнаружения различий между средними значениями основного критерия эффективности в группах терапии, количество участниц, включенное в итоговый статистический анализ, должно было составить 100 в каждой группе лечения (всего 200 участниц). С учетом возможного 10% выбывания участниц в ходе исследования и коэффициента 1,15 из-за возможного применения непараметрических методов анализа для SSE, было рекомендовано рандомизировать не менее 256 участниц, по 128 в каждую терапевтическую группу. Промежуточный анализ был запланирован по прошествии τ=0,74 времени исследования (на основе данных 189 рандомизированных участниц). Расчeт проводился с использованием программного пакета PASS 13.
Результаты
Распределение участниц исследования
Всего в данное исследование было скринировано 205 участниц, из них 189 участниц были рандомизированы: 95/189 (50,3%) – в группу препарата «Дизайрикс» и 94/189 (49,7%) – в группу плацебо; из них в анализ эффективности были включены 94/95 (98,9%) участниц в группе Дизайрикса и 90/94 (95,7%) участниц в группе плацебо. Итоговое распределение участниц с указанием причины выбывания представлено на рисунке 1.

Набор, лечение и последующее наблюдение участниц проводились в период с марта 2018 г. по ноябрь 2018 г. Запланированный демаскированный промежуточный анализ был проведeн независимым статистиком на основе данных 189 рандомизированных участниц и продемонстрировал превосходство Дизайрикса над плацебо по основной конечной точке. Основываясь на результатах этого анализа, независимый комитет по мониторингу данных рекомендовал завершить исследование вследствие демонстрации ранней эффективности.
Демографические и исходные характеристики
Демографические и исходные характеристики обеих групп были сходными (табл. 1, 2). Все участницы были европеоидами, их средний возраст составлял 34 (6,39) года. Большинство участниц – 162/189 (85,7%) – были в стадии -4 по классификации STRAW. Средняя продолжительность текущего эпизода HSDD составила 20,47 (18,81) месяца в группе Дизайрикса и 16,67 (12,28) месяца в группе плацебо. Среднее время от снижения или потери сексуального влечения до первого обращения за медицинской помощью составило 5,7 (13,76) месяца в группе Дизайрикса и 2,31 (7,65) месяца в группе плацебо.
Оценка безопасности
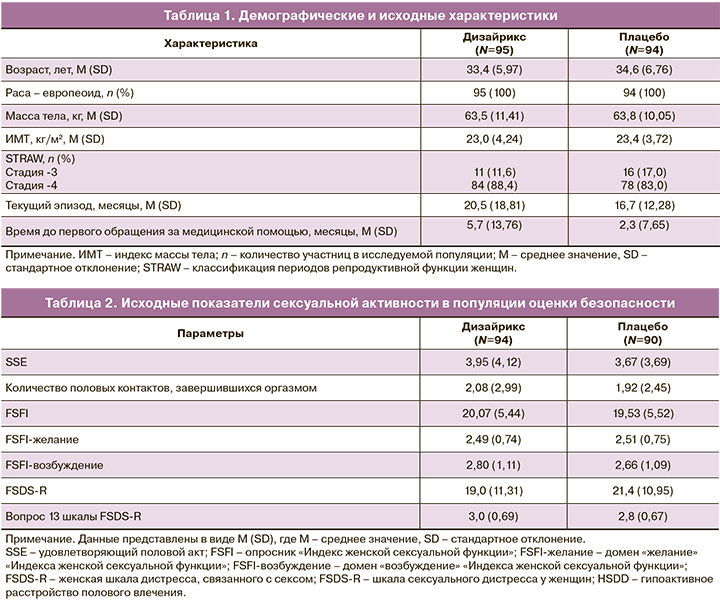
Всего было зарегистрировано 81 НЯ у 33/95 (34,7%) участниц в группе Дизайрикса и 76 НЯ у 29/94 (30,9%) участниц в группе плацебо. Большинство НЯ – 138/157 (87,9%) – имели легкую степень тяжести. Не было зарегистрировано тяжелых НЯ, а также НЯ, потребовавших отмены исследуемого препарата или назначения дополнительного лечения. У 1/94 (1%) участницы в группе плацебо был зарегистрирован самопроизвольный аборт. Наиболее частые НЯ, связанные с приeмом Дизайрикса, представлены в таблице 3.
Эффективность
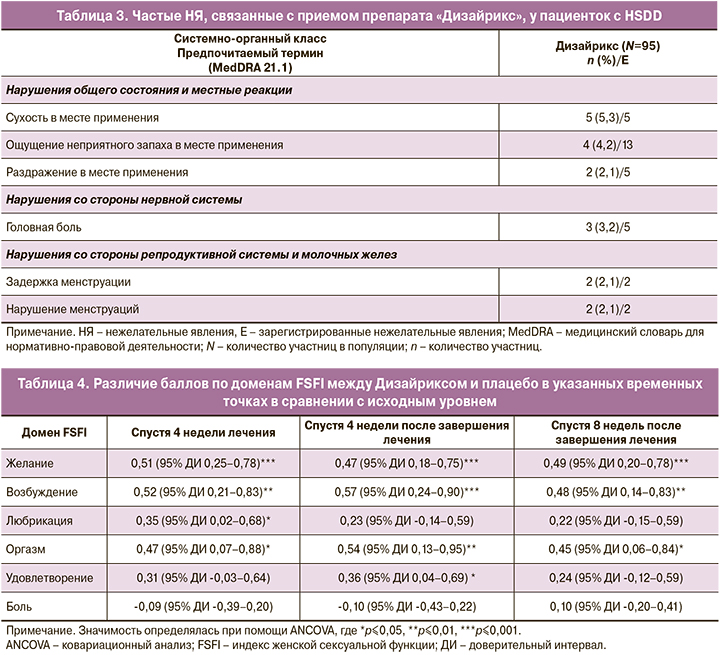
Участницы, принимавшие Дизайрикс, продемонстрировали статистически и клинически значимые улучшения как по основной конечной точке, так и по большинству вторичных конечных точек. Основной критерий эффективности был достигнут, поскольку препарат Дизайрикс вызывал большее увеличение количества SSE в ходе 4 недель лечения, чем плацебо: разность средних значений составила 1,83 (95,9% ДИ: 0,28–3,39; р=0,02) (рис. 2). Аналогично в группе Дизайрикса также было продемонстрировано значимо большее увеличение количества SSE по сравнению с плацебо спустя 4 недели 2,38 (95% ДИ: 0,62–4,13; р<0,01) и 8 недель 2,37 (95% ДИ: 0,70–4,05; р<0,01) после завершения лечения (рис. 2).
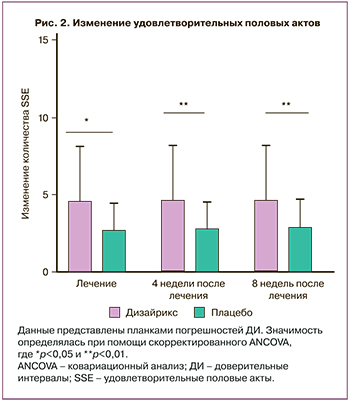
Среди женщин, получавших Дизайрикс, большее количество сообщили об увеличении общего балла опросника FSFI, при этом разница между группами Дизайрикса и плацебо составила 2,03 (95% ДИ: 0,42–3,65; р=0,01) после 4 недель лечения и 2,03 (95% ДИ: 0,33–3,73; р=0,02) и 1,95 (95% ДИ: 0,24–3,66; р=0,03) спустя 4 и 8 недель после завершения лечения соответственно (рис. 3a). Баллы доменов «желание», «возбуждение» и «оргазм» опросника FSFI были значимо выше в группе Дизайрикса по сравнению с плацебо на протяжении всего исследования (табл. 4). Балл домена «желание» индекса FSFI значимо вырос по сравнению с исходным уровнем: на 0,51 (95% ДИ: 0,25–0,78; р<0,001) после 4 недель лечения, на 0,47 (95% ДИ: 0,18–0,75; р<0,01) спустя 4 недели и на 0,49 (95% ДИ: 0,20–0,78; р<0,001) спустя 8 недель после завершения лечения (табл. 4, рис. 3b).
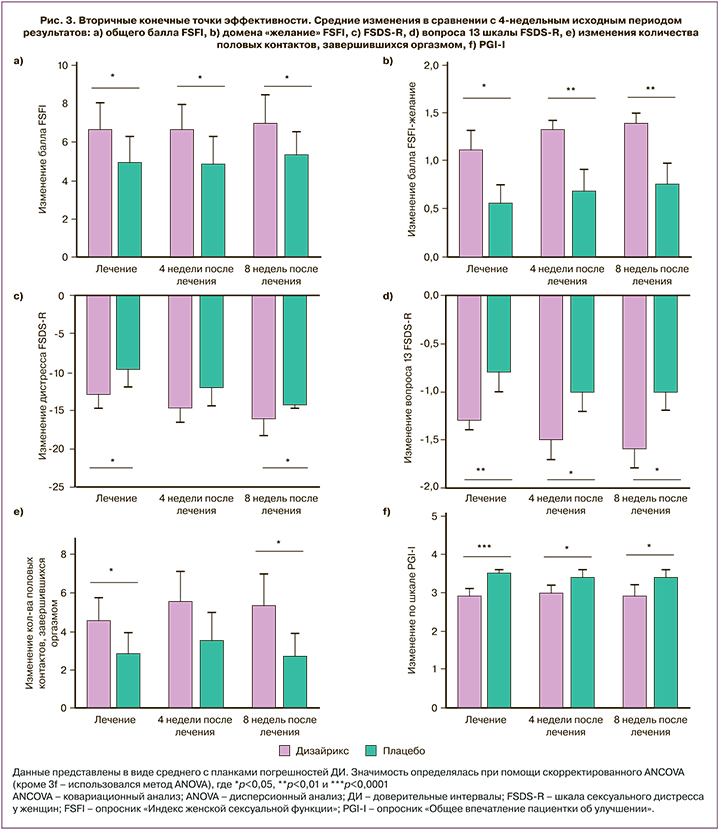
Разница между группами Дизайрикса и плацебо по общему баллу FSDS-R составила -2,9 (95% ДИ: -5,6–-0,2; р=0,04) после 4 недель лечения, -2,6 (95% ДИ: -5,5–0,3; р=0,08) спустя 4 недели и -3,6 (95% ДИ: -6,4–-0,8; р=0,01) спустя 8 недель после завершения лечения (рис. 3c). Аналогично изменения балла по вопросу 13 шкалы FSDS-R были значимо больше в группе Дизайрикса после 4 недель лечения – -0,4 (95% ДИ: -0,7–-0,1; р<0,01) и спустя 4 и 8 недель после завершения лечения – -0,3 (95% ДИ: -0,6–-0,0; p=0,03) и -0,5 (95% ДИ: -0,8–-0,2; p<0,01) соответственно (рис. 3d).
Участницы, получавшие лечение Дизайриксом, отмечали значимо большее число половых контактов, завершившихся оргазмом, после 4 недель лечения – 1,30 (95% ДИ: 0,05–2,56; р=0,04) и спустя 8 недель после завершения лечения 1,92 (95% ДИ: 0,38–3,46; p=0,01) в сравнении с группой плацебо (рис. 3e). По шкале PGI-I отмечалось значимое улучшение среднего балла в группе Дизайрикса в сравнении с плацебо: 0,5 (95% ДИ: -0,8–-0,3; p<0,001), -0,4 (95% ДИ: -0,7–-0,2; p<0,01) и -0,5 (95% ДИ: -0,7–-0,2; p<0,01) соответственно при оценке на 4, 8 и 12-й неделях исследования (рис. 3f).
Обсуждение
HSDD – это распространенное сексуальное расстройство у женщин, характеризующееся гнетущим снижением или отсутствием сексуального желания/влечения [2, 7, 20, 21]. Несмотря на одобрение лекарственных препаратов флибансерина (2015 г.) и бремеланотида (2019 г.), существует неудовлетворенная медицинская потребность в высокоэффективном, удобном и безопасном лекарстве для лечения женщин репродуктивного и пременопаузального возраста [8, 9].
В исследовании оценивались эффективность и безопасность препарата «Дизайрикс» для лечения женщин репродуктивного и пременопаузального возраста, страдающих HSDD. Основной критерий эффективности был достигнут, поскольку по сравнению с исходным уровнем у пациенток из группы Дизайрикса было значимо более выраженное увеличение количества SSE в течение 4 недель лечения в сравнении с получавшими плацебо. Также показано, что Дизайрикс безопасен и хорошо переносится. Наиболее частыми симптомами, возникающими при лечении препаратом «Дизайрикс», были головные боли, сухость в носу и неприятный запах. Большинство зарегистрированных НЯ было легкой степени тяжести, и не отмечалось каких-либо тяжелых НЯ, а также НЯ, потребовавших отмены исследуемого препарата или назначения дополнительного лечения.
Важно отметить, что среднее изменение количества SSE в группе Дизайрикса было вдвое выше по сравнению с плацебо, что указывает на клиническую эффективность препарата. Кроме того, эффективность показана и по ряду дополнительных показателей. Так, Дизайрикс значимо увеличил количество SSE по сравнению с исходным уровнем спустя 4 и 8 недель после завершения лечения; кроме того, Дизайрикс продемонстрировал превосходство над плацебо по увеличению общего балла опросника FSFI на протяжении всего исследования. Показатели доменов «желание», «возбуждение» и «оргазм» FSFI были значимо выше во всех временных точках, в то время как преимущество по доменам «любрикация» и «удовлетворение» было значимым только в точке 4 недели после завершения лечения. Кроме того, Дизайрикс уменьшал дистресс, согласно результату по вопросу 13 шкалы FSDS-R, во все зафиксированные моменты времени исследования и увеличивал количество успешных половых контактов, завершившихся оргазмом, как во время лечения, так и спустя 8 недель после его завершения.
Методы оценки эффективности, использованные в этом исследовании, широко использовались в других клинических исследованиях препаратов для лечения HSDD [21–23]. Существуют определeнные дискуссии об использовании количества SSE в качестве основной конечной точки, что отражено в руководстве американского агентства FDA для ключевых исследований женской сексуальной дисфункции [23]. Оценка SSE основана на подсчете частоты и, возможно, не учитывает, действительно ли увеличивается сексуальное желание [23]. Имеющиеся в настоящее время данные свидетельствуют о том, что надлежащим образом валидированные опросники, такие как FSFI, могут лучше подойти для оценки изменений женской сексуальной дисфункции в клинических исследованиях, чем фиксация определeнных событий [23]. В клинических исследованиях у пациенток с HSDD общий балл опросника FSFI и его отдельных доменов, а также общий балл шкалы FSDS-R и балл вопроса 13 шкалы FSDS-R часто используются в качестве переменных для оценки результата наравне с баллом домена «желание» опросника FSFI [22, 24, 25]. Данное исследование включает все эти параметры, чтобы предоставить исчерпывающие данные об эффективности препарата Дизайрикс.
В исследовании у 33/95 (34,7%) участниц в группе Дизайрикса наблюдались НЯ. Для сравнения, в рандомизированных двойных слепых плацебо-контролируемых клинических исследованиях флибансерина и бремеланотида сообщалось о НЯ у соответственно 56,1 и 62% участниц [26, 27]. Эти НЯ привели к тому, что 10,4 и 5% участниц, получавших флибансерин и бремеланотид соответственно, отказались от дальнейшего участия в клинических исследованиях [26, 27]. В терапевтической группе Дизайрикса не отмечалось случаев отмены препарата или необходимости назначения других препаратов для лечения возникающих НЯ. Также не отмечалось тяжeлых или серьeзных НЯ, связанных с Дизайриксом, в то время как таковые наблюдались и у флибансерина, и у бремеланотида [26, 27]. У получавших Дизайрикс частым НЯ была головная боль 3/95 (3,2%), но она же со сходной частотой отмечалась в других исследованиях у пациенток, получавших флибансерин и бремеланотид [26, 27]. Это свидетельствует о том, что Дизайрикс может иметь благоприятный профиль безопасности по сравнению с другими методами лечения HSDD.
Все участницы были представлены женщинами европеоидной расы репродуктивного и пременопаузального возраста, что может ограничить экстраполяцию результатов настоящего исследования на население в целом. Кроме того, требовалось, чтобы участницы исследования имели стабильные гетеросексуальные отношения в течение как минимум одного года, что исключало другие виды сексуальных отношений. По этим причинам желательно впоследствии подтвердить как безопасность, так и эффективность Дизайрикса в более широкой клинической популяции.
Раннее завершение клинического исследования, основанное на заранее оговоренном условии демонстрации эффективности по основной конечной точке в ходе промежуточного анализа, привело к меньшему числу набранных участниц. Это могло привести к снижению статистической мощности исследования по отдельным показателям, что объясняет недостижение статистической значимости по этим показателям в некоторые моменты времени.
Длительность терапии Дизайриксом составляла 28 дней, что является удобным, относительно краткосрочным курсом лечения. С другой стороны, более длительная терапия может оказаться более эффективной, однако для подтверждения этого необходимы клинические исследования с большей длительностью лечения Дизайриксом.
Ограничения исследования
Данное исследование – многоцентровое рандомизированное плацебо-контролируемое в параллельных группах, проведеннное в соответствии с правилами надлежащей клинической практики (GCP) и международными рекомендациями. Исследование проводилось в одной стране, с участием только женщин европеоидной расовой группы репродуктивного и пременопаузального возраста, что может ограничивать применимость результатов к населению в целом.
Заключение
Полученные в ходе этого исследования данные подтверждают существование нового и высокоэффективного подхода к негормональному лечению женщин репродуктивного и пременопаузального возраста, страдающих HSDD. Препарат «Дизайрикс», применяемый в виде назального спрея, хорошо переносился и продемонстрировал статистически и клинически значимое улучшение по основной конечной точке – количеству SSE в ходе 4 недель лечения в сравнении с плацебо. По всем вторичным критериям эффективности положительные изменения в группе Дизайрикса были выше по сравнению с плацебо, достигнув статистически значимой разницы в большинстве случаев. При рассмотрении этих результатов, наряду с данными о характере и частоте НЯ, можно заключить, что лекарственный препарат «Дизайрикс» имеет благоприятный терапевтический профиль и может быть рекомендован для лечения женщин репродуктивного и пременопаузального возраста, страдающих HSDD.



